神经肽Y对海马神经元“癫痫样”动作电位的影响
董长征董秀芳孔艳莉陈尧赵磊李哲赵文清李文玲
神经肽Y对海马神经元“癫痫样”动作电位的影响
董长征*董秀芳△孔艳莉*陈尧*赵磊*李哲*赵文清*李文玲*
【摘要】目的 探讨神经肽Y(neuropeptide Y,NPY)对海马神经元“癫痫样”动作电位的影响。方法 用无镁细胞外液处理原代培养12 d的海马神经元3 h,诱导海马神经元癫痫样放电,建立海马神经元癫痫样放电模型;用全细胞膜片钳电流钳模式检测神经元动作电位,分别给予0.1 μmol/L和1 μmol/L NPY各1 μL,给药时间 10 s,观察其对神经元动作电位频率及波幅的影响。结果 无镁细胞外液处理神经元3 h,可以形成稳定的海马神经元癫痫样放电模型,频率16~23 Hz,波幅75~96 mV。模型组神经元动作电位频率为(18.00±2.32)Hz,而0.1 μmol/L和1 μmol/L NPY组分别为(4.75±1.04)Hz和(1.50±0.75)Hz。与模型组相比较,两种浓度NPY组均降低了动作电位发放的频率 (P<0.05)。模型组神经元动作电位波幅为 (82.25±5.17)mV, 而0.1 μmol/L和1μmol/L NPY组分别为(49.75±2.49)mV和(40.00±2.20)mV。与模型组相比较,两种浓度NPY组均降低了动作电位发放的波幅(P<0.05)。两种浓度NPY之间相比较,也有统计学差异(P<0.05)。1 μmol/L NPY明显抑制了动作电位发放的频率和波幅。结论 NPY能够抑制无镁细胞外液诱发的神经元癫痫样电活动,为应用NPY抑制癫痫发作提供了细胞电生理学证据。
【关键词】神经肽Y 癫痫 神经元 动作电位 全细胞膜片钳记录
神经肽Y(neuropeptide,NPY),全名神经肽酪氨酸,由36个氨基酸组成的多肽。Tatemoto等[1]于1982年首先在猪脑中提取。作为广泛分布于中枢神经系统的神经递质,NPY被认为具有抗癫痫发作的作用。前期动物实验已证实利用腺相关病毒载体将NPY基因转移至脑内,通过基因转染的方法可以减轻红藻氨酸致痫大鼠的发作程度[2]。神经元动作电位是指神经元受到外界刺激时在静息电位的基础上产生的可扩布的电位变化过程,反映了机体神经元的兴奋性,与癫痫发病的生理机制密切相关。目前为止,NPY抑制癫痫发作的细胞分子学机制仍不十分清楚。本研究以原代培养的大鼠海马神经元癫痫样放电模型为基础,研究NPY对海马神经元癫痫动作电位的影响,探讨NPY抑制癫痫发作的细胞分子学机制。
1 材料与方法
1.1 研究对象 新生24 h Wistar大鼠15只,由英国利兹大学生物系实验动物中心提供。主要试剂和仪器:Neurobasal TM,胎牛血清(FBS),胰蛋白酶(Trypsin),L-多聚赖氨酸,N-2-羟乙基哌嗪-N′-2-乙磺酸均购自GIBCO公司,氯化镁(MgC12·6H2O)分析纯 (Fisher Scientific,UK),膜片钳放大器(Axon patch 200B,USA),模/数转换器 (Digidata 1320A 16-bit Aequisition System, USA),灌流控制系统BPS-8(Axon, USA), 倒置显微镜Olympus CK2(Olympus,Japan)。
1.2 海马神经元原代培养 在解剖显微镜辅助下,分离新生24 h Wistar大鼠双侧海马组织,根据参考文献[3]的方法,进行原代神经元培养,细胞数调整为2×105cells/mL,然后将细胞接种于细胞培养皿,在CO2培养箱中进行培养。自第6 d起,用加入10 μmol/L阿糖胞苷(Ara-C)抑制胶质细胞生长。培养12 d的细胞用于后续膜片钳试验。
1.3 神经元癫痫样放电模型的建立 将培养12 d的海马神经元,用无镁(Mg2+free)细胞外液处理3 h,用于后续膜片钳试验。采用EPC-10膜片钳系统进行全细胞模式的电流钳记录神经元的动作电位,若出现自发的稳定的癫痫样异常放电形式,说明造模成功。正常细胞外液组成成分:NaCl 147 mmol/L,HEPES 10 mmol/L,Glucose 13 mmol/L,KCl 2 mmol/L,CaCl22 mmol/L,MgCl22 mmol/L;用5 mmol/L NaOH调节 pH至 7.3,调整渗透压为280~320 mOsm/L。无镁细胞外液组成成分:NaCl 147 mmol/L,HEPES 10 mmol/L,Glucose 13 mmol/L,KC1 2 mmol/L,CaCl22 mmol/L;用5 mmol/L NaOH调节pH至7.3,调整渗透压为280~320 mOsm/L。培养的神经元被分为3组:模型组(Mg2+free组),NPY(0.1 μmol/L)干预组,NPY(1 μmol/L)干预组。模型组只用无镁细胞外液处理3 h;NPY(0.1 μmol/L)干预组, 在神经元癫痫样放电模型建立成功后,给予0.1 μmol/L NPY;NPY(1 μmol/L)干预组,在神经元癫痫样放电模型建立成功后,给予1 μmol/L NPY。
1.4 全细胞膜片钳模式记录海马神经元动作电位
1.4.1 记录动作电位的电极内液 记录动作电位的电极内液组成成分:KCl 147 mmol/L,MgC122 mmol/L,HEPES 10 mmol/L,EGTA 1 mmol/L;用3 mmmol/L KOH调节pH至7.3,调整渗透压为280~320 mOsm/L。实验前用孔径0.22 μm的一次性针头滤器过滤灭菌。
1.4.2 全细胞膜片钳记录模式 选择美国WPI公司生产的电导率高且噪声低的有芯膜片钳玻璃管,用PP-830型电极拉制仪(Electrode Puller)分两步法拉制而成,入液的电阻值为6~8 MΩ。在微操纵器辅助下,将微电极吸附在神经元细胞膜上,形成高阻封接后,负压破膜,形成细胞内液与电极内液相通的全细胞记录模式。实验在室温(23℃~25℃)条件下进行。
1.4.3 电流钳模式下记录海马神经元的动作电位
设定参数:记录模式为C-Clamp,Gain 2 mv/PA,C-fast 7.86 pF, C-Slow 50.00 pF, Amplitude 5.0 mV,length 5.0 ms,Imembrane 0 pA。先检测无镁细胞外液处理后神经元的动作电位,通过灌流给药系统分别给予0.1 μmol/L和1 μmol/L NPY干预10 s, 然后再次记录神经元动作电位的频率和波幅,实验数据由pClamp 9.0软件采样系统获得,直接进入Clamfit 9.0软件数据处理系统进行测量、分析、作图。
1.5 统计学分析 采用SAS 8.0进行分析。实验数据采用均数±标准差±s)表示,采用方差分析及q检验,α=0.05。
2 结果
2.1 原代培养大鼠海马神经元的形态学 体外培养神经元第12 d的海马神经元在倒置显微镜下观察可见:细胞周围有光晕,胞体略突出饱满、折光性良好,细胞突起长而相互连接,彼此间广泛突触联系形成(图1)。选取形态一致的多角形,胞体饱满,周围带光晕发育良好神经元用于后续膜片钳试验。
2.2 海马神经元无镁细胞外液处理前后动作电位的变化 在全细胞电流钳记录模式下操作,体外培养正常海马神经元可见自发性兴奋性突触后电位,偶有动作电位发放,见图2;无镁细胞外液处理神经元3 h后,可检测到频发的动作电位发放,频率16~23Hz,波幅75~96m V,见图3。
2.3 NPY对海马癫痫样神经元动作电位的影响全细胞电流钳记录结果显示:模型组神经元动作电位频率为(18.00±2.32)Hz,而0.1μmol/L和1μmol/L NPY组分别为(4.75±1.04)Hz和(1.50± 0.75)Hz,与模型组相比较,两种浓度NPY组均降低了动作电位发放的频率(q分别为 3.98、4.25,P<0.05)。模型组神经元动作电位波幅为(82.25 ±5.17)mV,而0.1 μmol/L和1 μmol/L NPY组分别为(49.75±2.49)mV和(40.00±2.20)mV,与模型组相比较,两种浓度NPY组均降低了动作电位发放的波幅 (q分别为3.45、3.86,P<0.05)。0.1 μmol/L NPY给药后动作电位的频率和幅度降低的程度小于1 μmol/L NPY组神经元,统计学分析有统计学差异(q分别为3.52、3.41,P<0.05)。结果见图4、5,表1。
表1 各组海马神经元动作电位频率和波幅(±s)

表1 各组海马神经元动作电位频率和波幅(±s)
1)与模型组相比,经q检验,P<0.052)与NPY 0.1 μmol/L组相比,经q检验,P<0.05
组别模型组NPY 0.1 μmol/L组NPY 1 μmol/L组n888频率(Hz)18.00±2.32 4.75±1.041)1.50±0.751),2)波幅(mV)82.25±5.17 49.75±2.491)40.00±2.201),2)
3 讨论
文献报道去除细胞外的 Mg2+[4]或通过用印防己苦毒素(picrotoxin)封闭GABA受体[5]从而诱发出神经元急性发作间期放电 (Interictal bursting)。Mg2+在维持中枢神经系统正常电生理活动和神经元的兴奋性具有重要作用,它能够阻滞钙离子细胞内流,减少细胞损伤;还能拮抗如谷氨酸、天冬氨酸等兴奋性氨基酸的作用,抑制细胞去极化;Mg2+还参与Na+-K+-ATP酶的形成,维护细胞膜的稳定性而阻止癫痫的发作。因此,移除细胞生存环境的Mg2+,可以诱发神经元的高兴奋性状态,模拟神经元异常放电。Sombati等研究提示无镁诱发的神经元出现自发性反复性发放的动作电位与临床癫痫发作时的电生理活动极为类似,抗癫痫药物如苯妥英钠能抑制这类动作电位的发生[6]。本研究根据上述镁离子的生理特性,移除细胞外液镁离子来模拟“癫痫微环境”,诱导原代培养海马神经元癫痫样放电。结果显示经无镁细胞外液处理3 h后,神经元都出现频发的高波幅动作电位发放,证实了此癫痫神经元放电模型的可靠性,适合用于膜片钳电生理检测。
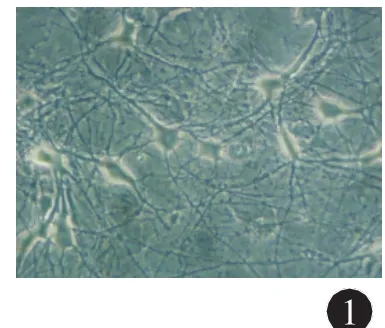
图1 培养12 d海马神经元(×400),bar=30 μm
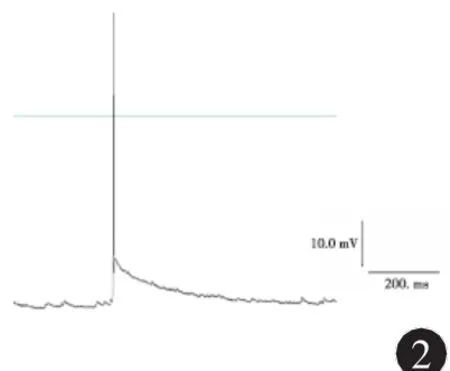
图2 正常海马神经元动作电位
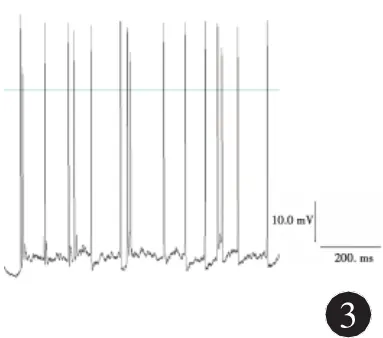
图3 无镁细胞外液处理3 h后海马神经元的动作电位
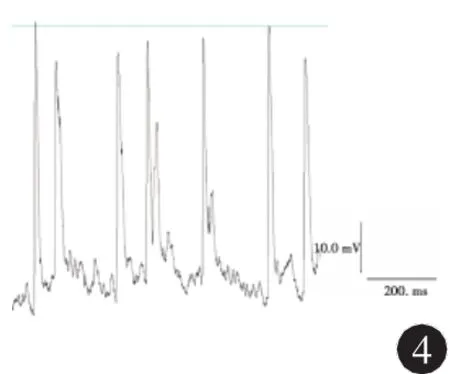
图4 0.1 μmol/L NPY给药后海马神经元动作电位

图5 1 μmol/L NPY给药后海马神经元动作电位
良好的神经元活性是神经电生理实验的前提基础。我们采用原代培养12d的海马神经元进行电生理研究,因为此时培养的海马神经元贴壁后形成许多突起,彼此之间形成复杂的神经网络,表明培养的海马神经元在体外仍能形成广泛的突触联系,具备突触间生物信息传递的形态学基础,能很好模拟在体神经元的生理状态,为神经元细胞分子水平的研究提高良好基础。
在体癫痫模型证实NPY具有较确切的抗惊厥作用。大鼠海马组织中GABA受体被印防己苦毒素(picrotoxin)阻断后,将NPY注射入被印防己苦毒素诱发的大鼠模型脑海马CA1区可以抑制动物癫痫发作[7]。在红藻氨酸(KA)诱发癫痫模型中将NPY注入到侧脑室能有效抑制运动性癫痫的发作,并能够大幅度缩短在海马齿状回和CA3区记录到的由红藻酸诱发的发作期癫痫异常脑电[8]。癫痫的本质是大脑神经元的异常超同步化放电,那么,NPY能否对对海马神经元癫痫样放电产生抑制作用,是本研究的关键所在。2011年Stjepana Kovac报道:1滋mol/L NPY可以降低大鼠海马脑片双脉冲刺激引起神经元癫痫样放电的波幅和频率,而对鼠脑额叶皮层放电无影响[9]。上述研究应用脑片作为观察对象,而对培养海马神经元的影响并未涉及。本实验以培养的海马神经元作为研究对象,同样选择1滋mol/LNPY进行研究,为了进一步了解不同浓度NPY对实验的影响,选择0.1滋mol/L NPY进行对照。试验结果显示:两种浓度的NPY均能够抑制癫痫样海马神经元的动作电位发放,与给药前相比能够降低其动作电位的频率和幅度,发挥抑制神经元异常放电的作用。并且,NPY抑制作用还具有浓度依赖性,在一定范围内,浓度越高抑制作用越强。本实验1滋mol/L NPY对无镁诱发的高波幅动作电位的抑制率要比0.1滋mol/L NPY要高,频率降低也更多,但是在目前浓度下并没有彻底抑制住动作电位的发放。可能与给药的浓度和持续时间均有关系。实验不足之处在于仅仅观察了两种浓度NPY对神经元放电的影响,NPY的有效作用范围有待进一步确定细化。总之,本研究初步结果从细胞电生理水平证实了NPY具有抑制海马神经元癫痫样放电的特性,为临床应用NPY进行抗癫痫治疗提供了更多的实验证据。
致谢:衷心感谢英国利兹大学江林华教授对本课题在膜片钳记录方面给予的技术指导。
参考文献
[1]Tatemoto K.Neuropeptide Y:complete amino acid sequence of the brain peptide[J].Proc Natl Acad Sci USA,1982,79(18):5485-5489.
[2] 董长征,赵文清,李文玲,等.重组腺相关病毒介导人源性神经肽Y基因转染对红藻氨酸致痫大鼠行为及脑电图的影响[J].第三军医大学学报,2010,32(19):2140-2142.
[3]Deshpande LS,Nagarkatti N,Ziobro JM,et al.Carisbamate prevents the development and expression of spontaneous recurrent epileptiform discharges and is neuroprotective in cultured hippocampal neurons[J].Epilepsia,2008,49(10):1795-1802.
[4]Bijak M.Inhibitory effect of neuropeptide y on epileptiform activity in the frontal cortex and hippocampus in vitro[J].Pol J Pharmacol,1995,47(5):461-463.
[5]Klapstein GJ,Colmers WF.Neuropeptide Y suppresses epileptiform activity in rat hippocampus in vitro[J].J Neurophysiol,1997,78(3):1651-1661.
[6]Carter DS,Deshpande LS,Rafiq A,et al.Characterization of spontaneous recurrent epileptiform discharges in hippocampalentorhinal cortical slices prepared from chronic epileptic animals[J].Seizure,2011,20(3):218-224.
[7]Sørensen AT,Kanter-Schlifke I,Lin EJ,et al.Activity-dependent volume transmission by transgene NPY attenuates glutamate release and LTP in the subiculum [J].Mol Cell Neurosci,2008,39(2):229-237.
[8]Kuruba R,Hattiangady B,Parihar VK,et al.Differential susceptibility of interneurons expressing neuropeptide Y or parvalbumin in the aged hippocampus to acute seizure activity[J].PLoS One,2011,6(9):e24493.
[9]Kovac S,Megalogeni M,Walker M.In vitro effects of neuropeptide Y in rat neocortical and hippocampal tissue [J].Neurosci Lett,2011,492(1):43-46.
(责任编辑:甘章平)
* 河北省人民医院功能神经外科(石家庄 050051)
△ 邢台市第一医院神经内科
【中图分类号】R742.1
【文献标识码】A
收稿日期:(2012-05-26)
doi:10.3969/j.issn.1002-0152.2012.08.006
通讯作者(E-mail:liwelling@163.com)
The expression of neuropeptide Y on action potential in hippocampal epileptic neurons.
DONGChangzheng,DONG Xiufang,KONG Yanli,CHEN Yao,ZHAO Lei,LI Zhe,ZHAO Wenqing,LIN Wenling.Department of Functional Neurosurgery,Hebei General Hospital,No.348 Heping West Road,Shijiazhuang 050051,China.Tel:0311-85989935.
【Abstract】Objective To investigate the effects of NPY on action potential of the hippocampal epileptic neurons in rats.Methods E12 rat primary hippocampal neurons were exposed to magnesium-free solution for 3 h to establish the model of"epileptic neuron.Whole cell current clamp was used to detect action potentials of the hippocampal epileptic neurons.The frequency and amplitude of neuronal action potential were recorded following treatment with 0.1 μM and 1 μM NPY for 10 s.Results A stable model of epileptiform discharges at frequency 16~23 Hz and amplitude 75~96 mV was successfully created by exposure of the hippocampal neurons to magnesium-free extracellular fluid for 3 h.The frequency of action potential was 18.00±2.32 Hz in the model group,4.75±1.04 Hz in the 0.1μmol/L NPY group and 1.50±0.75 Hz in the 1μmol/L NPY group, respectively.Compared with the model group,the frequency of action potential was significantly decreased in both NPY groups(P<0.05).The amplitude of action potential in the model group was 82.25±5.17 mV in the model group, 49.75±2.49 mV in the 0.1 μmol/L NPY group and 40.00±2.20 mV in the 1 μmol/L NPY group,respectively.Compared with the model group,the amplitude of action potential was significantly decreased in both NPY groups(P<0.05).The inhibitory effects on the frequency and amplitude of action potential were more pronounced in 1 μmol/L NPY group than in 0.1 μmol/L NPY group(P<0.05).Conclusion NPY can inhibit neuronal epileptiform activity induced by magnesium-free extracellular solution,which provides evidence of cell electrophysiology for NPY application in treatment of seizures.
【Key words】Neuropeptide Y Epilepsy Neuron Action Potential Whole cell patch clamp recording
——从一道浙江选考生物学试题谈起

