环介导等温扩增法快速检测结核分枝杆菌的临床应用评估
陈涛 周琳 周杰 李海成 江勇 彭东东 周志刚 彭建明 文力何超文 钱明 孙毅凡 石磊 钟球
环介导等温扩增法快速检测结核分枝杆菌的临床应用评估
陈涛 周琳 周杰 李海成 江勇 彭东东 周志刚 彭建明 文力何超文 钱明 孙毅凡 石磊 钟球
目的进行环介导等温扩增法(LAMP法)快速检测结核分枝杆菌的临床验证与应用,评估该方法在结核病临床诊断中的效能>。方法选取广东6地市专业结核病防治机构(简称“结防机构”)的肺部不同疾病及健康人员的痰标本2129份,分别采用直接涂片法、罗氏固体培养法及LAMP法检测痰标本中结核分枝杆菌;另广州、汕头两市337例结核病患者的痰标本浓缩处理后进行实时荧光定量(qPCR)及LAMP两种方法检测>。结果2129例痰标本中,直接涂片法、罗氏固体培养法和LAMP法的阳性检出率分别为13.2%(282/2129)、21.7%(463/2129)和20.3%(432/2129);同罗氏培养法相比,LAMP法灵敏度、特异度、阳性和阴性预测值分别为89.1%(432/485)、95.5%(1570/1644)、85.4%(432/506)和96.7%(1570/1623);337例浓缩处理后的痰标本qPCR阳性率为35.0%(118/337),LAMP阳性率为35.9% (121/337);LAMP法同直接涂片法检测、罗氏固体培养法和qPCR法比较,检测结果实际一致率分别为87.9%(Kappa值=0.612)、96.1%(Kappa值=0.89)和91.4%(Kappa值=0.812)>。结论LAMP法用于痰标本中结核分枝杆菌检测,其效能同罗氏培养法及qPCR法相当,同直接涂片法相比,LAMP法能够大幅提高阳性检出率,具有很好的临床应用和推广前景。
分枝杆菌,结核; 核酸扩增技术
结核病是全球卫生的主要挑战之一。根据最新的《世界卫生组织全球结核控制报告》,2009年约有940万结核病新发病例,170万人因结核病而死亡。目前我国结核病年发病人数约为130万,占全球发病的14.3%,位居全球第二位。
然而,与严峻的结核病形势相比,结核病临床诊断能力一直不如人意。目前的检测方法主要有痰涂片直接镜检法、培养法、免疫学方法和以PCR技术为基础的分子生物学法(如常规PCR、实时荧光PCR[1-3]、DNA 图谱[4]等)。其中最主要的方法还是痰涂片直接镜检法和培养法,但其低检出率及长检测周期直接制约了其检测效能;血清学方法特异度差;传统PCR技术对于操作人员的技术要求及昂贵的仪器及耗材等直接制约了其推广。因此,研究和开发新的快速、简便、经济及有效的诊断技术成为目前结核病实验室研究的一大热点。环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术是Notomi等[5]于2000年发明的一种全新的核酸扩增方法,该法具有PCR技术的全部优点,且使用高效的DNA聚合酶和2对引物,识别靶基因的6个不同区域,进一步缩短了检测时间,增强了反应的特异度。该技术无需昂贵的核酸扩增仪和检测设备,在等温条件(60~65℃)下完成反应,扩增产物可以肉眼直接观察,因此成本大大降低[5-9],更利于基层单位推广应用。
本研究对笔者成功建立并开发的结核分枝杆菌LAMP快速检测反应体系进行优化和企业小批量的生产,并且将生产的试剂盒在广东省6家临床医疗单位的检验科进行现场验证检测,共检测2129例不同肺部疾病患者及健康人的痰标本。LAMP检测结果与直接涂片抗酸染色法、罗氏固体培养法比较;另外,选取其中部分样本采用中山大学达安基因公司的MTB qPCR试剂盒检测进行比较、验证。
材料和方法
一、研究对象与标本
2129例(名)研究对象与标本来自广东省结核病防治研究所及六家地级市结核病防治机构(简称结防机构)(东莞市慢性病防治院、佛山市慢性病防治院、惠州市慢性病防治院、江门市慢性病防治院、汕头市慢性病防治院及广州番禺区慢性病防治站)的不同肺部疾病患者及健康人(均提供知情同意书),收集采取上述对象的清晨深部咯出痰液。标本采用顺序纳入的方式纳入2129例样本(样本量估算采用美国CDC提供的Epi InfoTM软件,计算最低样本量为1282例)。根据肺结核及其他肺部疾病的临床诊断标准,即综合病史、症状、体征、细菌学检查、X线胸片等辅助检查,以及诊断性治疗效果等确诊患者1327例为肺结核患者;581例为其他肺部疾病患者[包括上部呼吸道感染138例,慢性肺炎191例,哮喘、支气管扩张及慢性阻塞性肺疾病193例,非结核分枝杆菌(NTM)感染引起的肺部疾病38例,不明原因的短期咳嗽、咯痰21例];221名为健康人群。痰标本要足量(>2ml),4℃保存,存放时间不超过2d。每一份痰标本分别采用直接抗酸染色法,罗氏固体培养法和LAMP法检测。同时另选取337例肺结核患者痰标本先做浓缩处理后进行qPCR及LAMP法检测。
二、标本处理
痰标本按照结核病细菌学检验规程进行前处理。直接碱处理法:向痰液中加入等体积的4%氢氧化钠溶液,涡旋震荡器震荡,使标本液化均匀,在15~20min时间段内完成罗氏培养和LAMP检测的操作;中和离心法(浓缩法):向痰液中加入等体积前处理液(等体积4%氢氧化钠和2.94%的柠檬酸三钠混合,加N-乙酰半胱氨酸至其终浓度为1%),涡旋震荡器震荡,使标本匀化,室温静置15min,离心,沉淀用PBS溶解,再离心洗涤后加入50μl DNA提取液充分混匀,沸水浴10min,10 000g离心2min,收集上清用于qPCR和LAMP检测。
三、痰涂片和培养
痰标本采用萋-尼抗酸染色法,按照《中国结核病防治规划痰涂片镜检标准化操作及质量保证手册》进行操作及镜检报告。
痰培养采用改良罗氏培养基碱处理后直接接种法。取前处理后的标本0.1ml,无菌操作接种于培养基斜面上,每份标本同时接种在两管培养基上。放置于37℃培养箱中孵育。接种后3周观察菌落生长情况,然后每周观察结果一次。发现菌落生长者,可报告Mtb培养阳性,若满8周仍无菌落生长,则报告培养阴性。
痰标本阳性与阴性定义:结核分枝杆菌阳性(true-positive)痰标本是指:(1)培养阳性且鉴定为Mtb;(2)培养阴性但涂片阳性,LAMP阳性且结合临床表征诊断为结核病患者的标本。结核分枝杆菌阴性(true-negative):(1)培养和涂片检测均为阴性;(2)涂片阴性,培养阳性,但菌鉴结果为NTM菌群。
四、LAMP检测
Mtb核酸检测试剂盒(DNA恒温扩增法)试剂盒由广州迪澳生物科技有限公司提供(试剂盒引物见表1),按照试剂盒操作说明,将反应液60~65℃下反应60min,反应完成后立刻在80℃下进行反应终止。每轮反应均进行阳性及阴性对照反应。反应结束后,通过肉眼进行观察,橙色表示结果为阴性,绿色表示结果为阳性(图1)(注:本实验的LAMP法检测Mtb的特异度、敏感度、稳定性等方面的优化工作由本课题合作团队早期完成,相关论文已发表[6])。
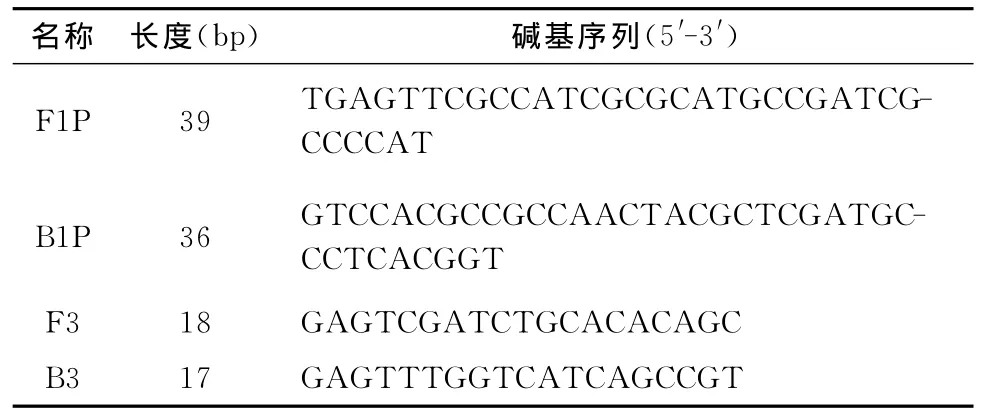
表1 LAMP法检测Mtb的引物
五、荧光定量PCR试剂盒
Mtb荧光定量PCR检测试剂盒购自中山大学达安基因股份有限公司,按照试剂盒说明书进行操作。向PCR反应管[已含有耐热DNA聚合酶、缓冲液(buffer)和脱氧核苷酸(dNTP)]中加入上述煮沸法提取的DNA模板2μl。PCR扩增程序为:93℃预变性2min,93℃30s,55℃45s,循环40次,72℃5min。
六、操作流程及质量控制
(1)LAMP-Mtb检测反应体系的建立和条件优化工作由广东省结核病防治研究所和华南理工大学轻工与食品学院共同完成。(2)临床验证实验由6家临床单位的临床医生和检验技师共同完成。所有参与医师及检验技师经过专项的培训,通过直接涂片抗酸染色、罗氏固体培养及LAMP检测的熟练度测试合格后进入实验。(3)所有试验的涂片、培养及LAMP反应的产物及结果由广东省结核病防治研究所按照数字表法随机抽取复检:涂片复染色后复检、培养的阳性菌株的Mtb或NTM菌种鉴定及LAMP再次扩增。
七、统计学处理方法
本研究数据采用Office 2010收集整理,采用SPSS统计软件的Wilcoxon秩和检验比较三种检出率的差异性;采用配对卡方检验(McNemar Test)和Kappa检验(下同)分析三种检测方法的一致性,以P<0.05为差异有统计学意义。
结 果
一、抗酸染色涂片法、罗氏培养法和LAMP法检出率比较
对2129例痰标本分别用涂片法、罗氏培养法和LAMP三种方法检测 Mtb,结果见表2,涂片阳性294例[经硝基苯甲酸 (PNB)及噻吩-2-羧酸肼(TCH)试验鉴别282例为 Mtb,12例为NTM],阳性率为13.2%(282/2129);罗氏培养阳性485例(经PNB/TCH 试验鉴别463例为 Mtb,22例为NTM),阳性率为21.7%(463/2129);LAMP扩增阳性506例(432例为Mtb,74例为假阳性),阳性率为20.3%(432/2129)。LAMP与抗酸染色涂片法的阳性检测率不同,差异有统计学意义(Z=6.565,P=0.000<0.05);LAMP与罗氏培养法的阳性检测率差异无统计学意义(Z=1.273,P=0.203>0.05)(表2)。

图1 LAMP反应结果图
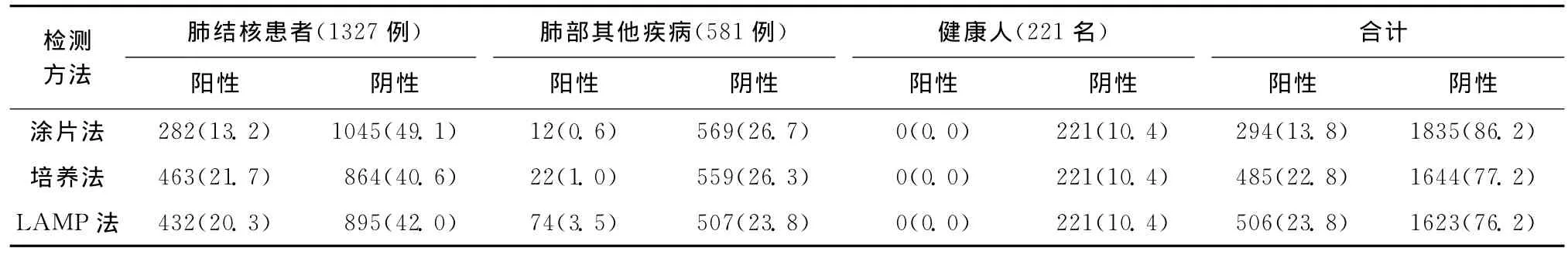
表2 直接涂片抗酸染色法、罗氏培养法及LAMP法检测效果[例或名(占有率,%)]

表3 不同检测单位直接涂片法、罗氏培养法及LAMP法检测结核分枝杆菌的差异性分析
上述结果说明LAMP法比临床最主要的检测方法——涂片法的阳性检出率高,且同结核病诊断参考标准——罗氏培养法相比,阳性检出率效果相当。
二、三种检测方法的检出效能的差异性分析
432例LAMP阳性标本被确诊为Mtb阳性(True-positive);1530例 LAMP阴性标本被确诊为Mtb阴性(true negative);53例 LAMP阴性(22例涂片阳性,31例培养阳性且鉴定为Mtb)被确定为假阴性(false-negative);74例LAMP阳性(其中,12例抗酸染色涂片和培养均阳性,10例培养阳性标本经[经硝基苯甲酸(PNB)及噻吩-2-羧酸肼(TCH)试验鉴别鉴别为NTM;52例培养和涂片均为阴性被诊断为肺部其他感染性疾病)被确定为LAMP假阳性(false-positive)。LAMP法灵敏度、特异度、阳性和阴性预测值分别为87.0%~94.4%(总体为89.1%)、92.9%~97.0%(总体为95.5%)、83.1%~88.2%(总体为85.4%)和96.1%~97.9%(总体为96.7%),说明LAMP在临床应用具有很高的诊断效能,与罗氏培养相比差异无统计学意义(表3)。
三、LAMP法同抗酸染色涂片法、罗氏培养法和qPCR检测方法的一致性分析
1.将LAMP法与抗酸染色涂片法检测Mtb的结果对比:两种检测方法结果的一致性为87.9%,预期结果的一致性为68.9%,Kappa值为0.612(P=0.021<0.05),Kappa值介于0.61~0.80之间,说明两种检测方法结果大部分一致(表4)。
2.LAMP法与培养法检测结果比较:LAMP法和培养法的检测结果的一致性为96.1%,预期结果的一致性为64.2%,Kappa值为0.89(P=0.012<0.05),说明这两种检测方法结果完全一致(表5)。
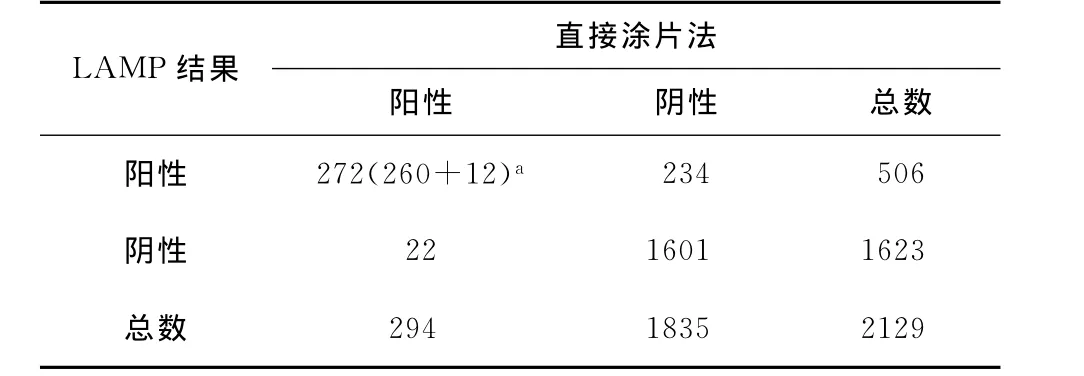
表4 LAMP法与直接涂片法检测Mtb的一致性分析(例或名)
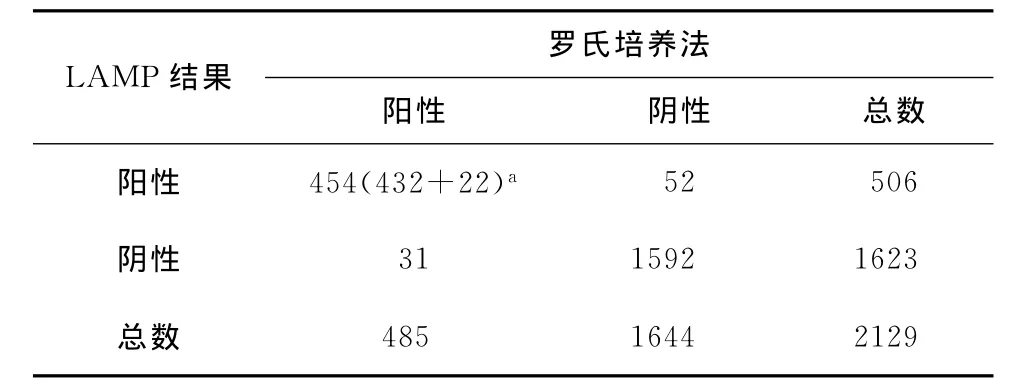
表5 LAMP法与罗氏培养法检测Mtb的一致性分析(例或名)
3.LAMP法与qPCR法检测结果比较:分别从广州市和汕头市选择的337例结核病患者的痰标本,先进行中和离心(浓缩)后,再做LAMP法与qPCR法检测。检测结果为:LAMP法的阳性检出率为35.9% (121/337),qPCR法的阳性率为35.0%(118/337);两种方法检测结果的一致性为91.4%,预期结果的一致性为54.2%,Kappa值为0.812>0.8(P=0.033<0.05),说明这两种检测方法的检测效果完全一致(表6)。

表6 LAMP法与qPCR法检测Mtb的一致性分析(例或名)
讨 论
根据2010年全国第五次结核病流行病学调查结果[7],估算我国全人群活动性肺结核患病率为392/10万,其中传染性肺结核患病率为100/10万,也就是说我国平均每10万人口中约有400名活动性肺结核患者,其中有1/4具有传染性。据此估算2010年我国现有活动性肺结核患者总数为523万,其中传染性肺结核患者总数为134万。由目前的趋势预计,到2020年结核病仍将是全球重大传染病之一。
研究和开发快速、简便、敏感度好、特异度高的Mtb新的检测方法成为亟待解决的问题。目前也涌现出一批具有一定市场应用前景的技术方案,例如反向杂交线性探针技术、Gene-Expert技术、基因芯片技术等,这些大部分仍处于实验室开发和临床前验证阶段。然而,在发展中国家,尤其是结核病发病率较高的中国、印度、巴基斯坦等国[7],上述检测方法的技术要求,仪器昂贵等问题将成为广泛推广的瓶颈。等温扩增技术在日本、欧洲等国家得到广泛研究和开发,但是到目前为止仍处于实验室或者临床前评估阶段[8-17],反应试剂的开发仍处于实验室摸索阶段,未能达到稳定性强、敏感度和特异度都能够适合临床应用的水平[18]。
本课题组研究的创新性在于成功实现了LAMP技术从实验室研究向临床应用的转化,在技术的稳定性、方法的灵敏度及特异度方面均取得了令人满意的结果。相比其他报道,本研究团队经过近8年的研究,开发出一套完整、稳定的等温扩增的反应体系和技术。笔者开发的针对Mtb的等温扩增试剂盒及检测技术在广东省6家地市结核病防治专业医院完成了的临床应用及验证评估,并取得了可喜的效果。本研究大大推进了LAMP技术在临床应用,全面推广指日可待。其优势主要表现在以下几个方面:(1)提高肺结核患者的阳性检出率:同直接涂片抗酸染色相比,痰液中Mtb的阳性检出率提高了64.3%(P<0.05);(2)检测速度快:等温扩增法的诊断效能几乎等同于罗氏培养法,但是其检出时间仅仅需要1h左右,大大降低了诊断延误的时间和几率;(3)操作方法简单,无需特殊仪器:等温扩增的操作没有传统PCR复杂和技术要求严格,同时不需要昂贵的扩增仪器;(4)实验室交叉污染风险低:整个反应始终在密闭的环境(无需打开管盖),最终通过肉眼辨别颜色变化来判断结果,如果实验人员不出现操作失误(打开扩增产物的管盖),该方法几乎不存在扩增产物的气溶胶污染实验室的情况发生,在本研究临床验证的过程中,笔者多次对实验室的环境和水样做针对IS6110片段的PCR检测实验,未发现假阳性产生,说明实验室没有受到等温扩增的产物污染;(5)本研究临床验证的实验均由各自实验室的技术人员独立完成,虽然不同实验室的实验室环境、操作人员的技术水平和熟练度均存在一定差异,但最终的检测报告显示各自实验室的检测结果的差异性不具有统计学意义,说明笔者研究团队开发的等温扩增方法具有一定稳定性,具备了大面积使用的潜能,甚至可以在社区医院或者乡镇卫生院开展。
随着肺结核的反复发作及治疗病程的延长,部分患者肺部感染为分枝杆菌复合菌群,甚至是Mtb和NTM复合感染。对于本试验中出现22例LAMP检测假阳性(鉴定为NTM菌)的患者,通过回复性观察,发现有17例抗结核治疗效果显著;同时对22例NTM阳性产物进行分离培养,并再次LAMP试验,仅发现7例LAMP阳性。因此,笔者高度怀疑其中多数患者同时伴有Mtb和NTM复合感染,为今后的相关研究提供了一种启示。
本研究的试验试剂只是针对人型Mtb进行检测,因此无法检测出Mtb复合菌群的其他类型及其他致病性的环境分枝杆菌,这在一定程度上影响了该方法的临床检出效能。随着结核病发现力度的加大和控制水平的提高,一方面临床上NTM感染引起的疑似结核病患者逐渐增多,迫切需要实验室能够检测具体致病菌型;另一方面临床医生往往希望通过对菌株的活力及死活状态的判断来评估抗结核的效果。因此,开发出能够同时检测出多种分枝杆菌及能够鉴别死活菌的等温扩增试剂将成为下一步研究的重点。
[1]Hale YM,Pfyffer GE,Salfinger M.Laboratory diagnosis of mycobacterial infections:new tools and lessons learned.Clin Infect Dis,2001,33(6):834-846.
[2]Pandey BD,Poudel A,Yoda T,et al.Development of an inhouse loop-mediated isothermal amplification(LAMP)assay for detection ofMycobacterium tuberculosisand evaluation in sputum samples of Nepalese patients.J Med Microbiol,2008,57(Pt 4):439-443.
[3]Hillemann D,Warren R,Kubica T,et al.Rapid detection ofMycobacterium tuberculosisBeijing genotype strains by real-time PCR.J Clin Microbiol,2006,44(2):302-306.
[4]Haldar S,Chakravorty S,Bhalla M,et al.Simplified detection ofMycobacterium tuberculosisin sputum using smear microscopy and PCR with molecular beacons.J Med Microbiol,2007,56(Pt 10):1356-1362.
[5]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA.Nucleic Acids Res,2000,28(12):E63.
[6]林世平,杨应周,谭卫国,等.环介导等温扩增法快速检测结核分枝杆菌的初步观察.中国防痨杂志,2010,32(8):467-469.
[7]卫生部召开新闻发布会介绍全国肺结核疫情现状(DB/OL).[2011-03-21].http://www.gov.cn/gzdt/2011-03/21/content_1828718.htm.
[8]Aryan E,Makvandi M,Farajzadeh A,et al.A novel and more sensitive loop-mediated isothermal amplification assay targeting IS6110for detection ofMycobacterium tuberculosiscomplex.Microbiol Res,2010,165(3):211-220.
[9]Geojith G,Dhanasekaran S,Chandran SP,et al.Efficacy of loop mediated isothermal amplification(LAMP)assay for the laboratory identification ofMycobacterium tuberculosisisolates in a resource limited setting.J Microbiol Methods,2011,84(1):71-73.
[10]Lange C,Mori T.Advances in the diagnosis of tuberculosis.Respirology,2010,15(2):220-240.
[11]Broccolo F,Scarpellini P,Locatelli G,et al.Rapid diagnosis of mycobacterial infections and quantitation ofMycobacterium tuberculosisload by two real-time calibrated PCR assays.J Clin Microbiol,2003,41(10):4565-4572.
[12]Lopez AD,Mathers CD,Ezzati M,et al.Global and regional burden of disease and risk factors,2001:systematic analysis of population health data.Lancet,2006,367(9524):1747-1757.
[13]Shrestha NK,Tuohy MJ,Hall GS,et al.Detection and differentiation ofMycobacterium tuberculosisand nontuberculous mycobacterial isolates by real-time PCR.J Clin Microbiol,2003,41(11):5121-5126.
[14]Liu KT,Su WJ,Perng RP.Clinical utility of polymerase chain reaction for diagnosis of smear-negative pleural tuberculosis.J Chin Med Assoc,2007,70(4):148-151;discussion 146-147.
[15]Iwamoto T,Sonobe T,Hayashi K.Loop-mediated isothermal amplification for direct detection ofMycobacterium tuberculosiscomplex,M.avium,and M.intracellulare in sputum samples.J Clin Microbiol,2003,41(6):2616-2622.
[16]Scarparo C,Piccoli P,Rigon A,et al.Comparison of enhancedMycobacterium tuberculosisamplified direct test with COBAS AMPLICORMycobacterium tuberculosisassay for direct detection ofMycobacteriumtuberculosiscomplex in respiratory and extrapulmonary specimens.J Clin Microbiol,2000,38(4):1559-1562.
[17]Mathema B,Kurepina NE,Bifani PJ,et al.Molecular epidemiology of tuberculosis:current insights.Clin Microbiol Rev,2006,19(4):658-685.
[18]George G,Mony P,Kenneth J.Comparison of the efficacies of loop-mediated isothermal amplification,fluorescence smear microscopy and culture for the diagnosis of tuberculosis.PLoS One,2011,6(6):e21007.
Clinical application of loop-mediated isothermal amplification method in rapid detection ofMycobacterium tuberculosis
CHEN Tao*,ZHOU Lin,ZHOU Jie,LI Hai-cheng,JIANG Yong,PENG Dong-dong,ZHOU Zhi-gang,PENG Jian-ming,WEN Li,HE Chao-wen,QIAN Ming,SUN Yi-fan,SHI Lei,ZHONG Qiu.*Center for Tuberculosis Control and Prevetion of Guangdong Province,Guangzhou 106130,China
ZHONG Qiu,Email:zhongqiu@vip.163.com;ZHOU Lin,Email:gdtb_bg@vip.163.com
ObjectiveTo evaluate the diagnostic value of a loop-mediated isothermal amplification(LAMP)method for rapid detection ofMycobacterium tuberculosis.Methods2129sputum samples of suspected TB patients from 6cities in Guangdong province and 337enriched sputum samples randomly selected from Guangzhou and Shantou cities were collected.M.tuberculosisin 2129sputum samples were detected by smear,Roche solid culture and LAMP methods.M.tuberculosisin 337sputum samples were detected by quantitative polymerase chain reaction(qPCR)and LAMP methods. Results For 2129sputum samples,the positive rates of smear,culture and LAMP were 13.2%(282/2129),21.7%(463/2129)and 20.3%(432/2129),respectively.Compared with Roche culture method,sensitivity,specificity,positive predictive value and negative predictive value of the LAMP method were 89.1%(432/485),95.5%(1570/1644),85.4%(432/506)and 96.7%(1570/1623),respectively.For 337enriched sputum samples,the positive rates of qPCR and LAMP were 35.0% (118/337)and 35.9% (121/337),respectively.Compared LAMP with smear,culture and qPCR,the consistent rate of the results were 87.9%(K=0.612),96.1%(K=0.89)and 91.4%(K=0.812),respectively. Conclusion The LAMP method was equivalent to culture and qPCR,superior to smear method in detectingM.tuberculosisof sputum specimens.In addition,LAMP method showed the advantages of rapid,simple operation and no equipment,indicating good prospects for clinical application and promotion in the diagnosis of tuberculosis.
Mycobacterium tuberculosis; Nucleic acid amplification techiques
“十二五”国家科技重大专项(2012ZX10004903);“十二五”广东省“结核病防治转化”医学重点实验室
106130广州,广东省结核病控制中心参比实验室(陈涛、周琳、李海成、江勇、钱明、钟球);广东省佛山市第四人民医院(周杰);广东省汕头市结核病防治所(彭东东);广东省东莞市慢性病防治院(周志刚);广东省惠州市结核病防治所(彭建明);广东省江门市结核病防治所(文力);广州市番禺区慢性病防治站(何超文);暨南大学医学院微生物与免疫学教研室(孙毅凡);华南理工大学轻工与食品学院(石磊)
钟球,Email:zhongqiu@vip.163.com;周琳,Email:gdtb_bg@vip.163.com
2012-05-16)
(本文编辑:薛爱华)

