FH/Wjd大鼠的生物学特性及其在药理学研究中的应用
李语玲,梁建辉
(北京大学中国药物依赖性研究所,北京 100191)
酒精依赖综合征(alcohol dependence syndrome,ADS)是饮酒导致的对酒精的精神和躯体依赖,可连续或间断出现对酒精的渴求和经常需要饮酒的强迫性体验,停止饮酒常出现戒断症状。酒精滥用与成瘾在我国已经是一个日趋严重的社会和医学问题,因此,对这一课题的研究具有非常重要的社会现实意义。目前,研究酒精成瘾的动物模型主要是通过选择性培育技术建立的,包括高度酒精偏爱(high alcohol-preferring,HAD)大鼠、酒精偏爱 iP(inbred P,iP)大鼠、LE(long evans,LE)大鼠和撒丁岛酒精偏爱(sardinian alcoholpreferring,sP)大鼠[1]。这些大鼠的饮酒量是其对照组大鼠饮酒量的4~5倍。然而,近交系的FH/Wjd大鼠是一种先天性的嗜酒大鼠,对体积分数为0.05的酒精溶液的饮用量可达5 g·kg-1·d-1,而对照组非嗜酒的ACI/N大鼠饮酒量只有0.45 g·kg-1·d-1。抑郁症是一种慢性、反复发作的精神类疾病,临床表现有焦躁情绪、快感缺失、睡眠障碍、负罪感和反复自杀念头等,严重危害了人们的身心健康。根据世界卫生组织统计,预计到2020年,抑郁症可能成为仅次于冠心病的第二大疾病。抑郁症表现多样,病因、发病机制复杂[2],应激抑郁模型是目前常用的抑郁动物模型,表现出类似于快感缺失、兴趣减退及精神运动性迟滞等人群抑郁症患者常见的一些行为特征[3]。而FH大鼠是一个具有先天性抑郁表现的大鼠,在强迫游泳实验(forced swimming test,FST)中FH/Wjd大鼠行为绝望表现比ACI/N大鼠明显。大量的行为学研究表明,FH/Wjd大鼠是一个可以模拟人群饮酒和抑郁表现的遗传性动物模型。
本文将从FH大鼠的来源、各亚系的特点、FH/Wjd大鼠的酒精偏爱、抑郁表现、遗传背景及神经递质系统几个方面,阐述FH/Wjd大鼠的生物学特性及其在药理学研究中的应用。
1 FH大鼠的培育历史
FH大鼠属于近交系大鼠品系,目前培育的有FH/Wjd、FH/Har(IR)、FHH/Eur和FHL/Eur 4个亚系。对FH大鼠酗酒的研究可追溯到20多年前,科研人员怀疑酗酒与5-HT系统功能异常存在相关性[4]。研究表明,FH/Wjd大鼠的确是一种遗传性5-HT功能低下的大鼠。如果测定出FH/Wjd大鼠具备大量自主饮酒的特点,将是非常有意义的。FH大鼠的祖系是远交系的Wistar(Wistar Kyoto)大鼠。纽约卫生中心W.Jean Dodds教授将这个大鼠近亲繁殖了19代[5],得到了FH/Wjd品系。Gordon Harrington教授通过近亲杂交培育了中度嗜酒(2~3 g·kg-1·d-1)的FH品系,命名为 IR(Iowa reactive)大鼠[2]。除上述品系外,Ethel Tobach教授还培育了远交系。这些品系被运往欧洲后,荷兰Eurasmus大学的Provoost教授有选择性地近交繁育了患有高血压(FHH/Eur)和低血压(FHL/Eur)的亚系。Overstreet教授把上述4个亚系的大鼠杂交,并对其性状进行了分析,研究结果表明:FH/Wjd大鼠的饮酒量明显多于FH/Har、FHL/Eur和FHH/Eur亚系,但总的饮液量与后3者没有明显差异。表明总饮液量和自主饮酒量是FH/Wjd大鼠两个独立的特性。而在FST中,FH/Wjd、FHH/Eur和 FHL/Eur比 FH/Har大鼠的行为绝望表现更加明显。自主饮酒和行为绝望的特性在FH大鼠各品系间分布的不一致,说明饮酒和抑郁可能受不同遗传因素的影响[5]。
2 FH/Wjd大鼠饮酒行为特性
2.1酒精双瓶自由选择饮酒实验(ethanol 2-bottle choice paradigms)采用酒精双瓶自由选择饮酒实验方法研究FH/Wjd大鼠嗜酒的行为特性[6],对FH/Wjd和ACI/N两组大鼠同时给予体积分数为0.05的酒精和自来水双瓶自由选择,计算24 h内大鼠的饮酒量、饮水量和酒精偏爱度。FH/Wjd 大鼠的饮酒量 >5 g·kg-1·d-1,酒精偏爱度 >65%,而对照组的ACI/N大鼠饮酒量只有0.45 g·kg-1·d-1,说明FH/Wjd大鼠的饮酒量和酒精偏爱度明显高于它的对照组[7]。
FH/Wjd大鼠夜间饮酒量大于白天,约为4.6倍,偏爱度约为白天的1.2倍,饮水几乎无昼夜差异。所以我们在研究戒酒药物时多选择夜循环开始前给药[6]。Cowen等[8]发现阿片受体拮抗剂纳曲酮可以明显降低FH/Wjd大鼠的饮酒量和酒精偏爱度,增加其饮水量,但是药效维持时间很短,并且大鼠的总饮液量也有所降低,限制了纳曲酮的临床应用。基于黄豆苷(daidzin)和乙醛脱氢酶-2(aldehyde dehydrogenase 2 ,ALDH-2)的晶体结构,Arolfo等[9]合成的 CVT-10216可以剂量依赖性地降低FH/Wjd大鼠的饮酒量和酒精偏爱度,并且对饮水、摄食没有抑制作用,CVT-10216可能会成为临床治疗酗酒病人的良好药物。目前,FH/Wjd大鼠作为一个先天嗜酒的大鼠模型被越来越多的研究酒精成瘾的实验室所应用。
2.2酒精剥夺(deprivation-induced drinking paradigms)FH/Wjd大鼠连续饮体积分数为0.1的酒精至少6周,待饮酒量稳定后,撤去酒瓶,连续剥夺24 h,在夜循环开始前30 min放回酒瓶测定每天饮酒量的变化,连测7 d。7 d后再次进行酒精剥夺并测定饮酒量的变化[10]。结果显示:酒精剥夺后,大鼠前3 d的饮酒量增高20% ~25%,然后逐渐降低,d 7降至剥夺前的饮酒量水平。再次进行酒精剥夺时又会出现饮酒量增多的现象。这种剥夺导致的饮酒量增加是大鼠对酒精渴求的标志。戒酒药物可以干预这种饮酒量的增加,酒精剥夺实验是利用FH/Wjd大鼠的饮酒特性评价戒酒药物药效的常用实验方法。CVT-10216就可以明显地抑制酒精剥夺诱导的FH/Wjd大鼠饮酒量的增加[9]。
2.3操作性自身饮酒实验(operant ethanol self-administration paradigms)操作性自身饮酒实验流程分为训练阶段和实验阶段。根据蔗糖消退方法进行操作性自身给酒训练。踏板稳定后测定FH/Wjd大鼠30 min内的踏板次数与饮酒量,与ACI/N大鼠相比较,FH/Wjd大鼠的饮酒量约为0.5 g·kg-1,明显高于 ACI/N 大鼠(<0.3 g·kg-1),说明FH/Wjd大鼠与iP大鼠相近,是一种可以短期建立操作性自身饮酒行为的大鼠模型[11]。用戒酒药物干预时,FH/Wjd大鼠踏板饮酒精的次数减少,而踏板寻求饮水的次数增加[9],FH/Wjd大鼠操作性自身饮酒实验也是戒酒药物药效学评价的良好技术平台。此外,FH/Wjd大鼠还满足以下酗酒动物模型必备的条件:能在短时间内自主饮足量的酒精;达到药理学明显的血液酒精浓度[12];饮酒后对酒精产生耐受和依赖[10]。综上所述,FH/Wjd大鼠是一种比较理想的酗酒动物模型[7]。
3 FH/Wjd大鼠抑郁的行为特性
强迫游泳实验(FST)最早由 Porsolt等[13]提出,在一个高40 cm,直径18 cm圆筒形的容器中注满水,并保持水温在25℃。动物先表现出挣扎逃脱行为,一段时间之后,出现不动状态(immobility),即行为绝望(behavioral despair)。在首次FST中,FH/Wjd大鼠在5 min中有(191±6)s的不动时间,ACI/N大鼠只有(85±11)s的不动时间,这说明FH/Wjd大鼠不动状态比ACI/N大鼠更加明显,这种在应激状态下产生的行为绝望与抑郁症患者精神运动性迟滞表现相似,并且这种行为绝望可以被抗抑郁药——选择性5-HT重摄取抑制剂(selective serotonin reuptake inhibitors,SSRIs)慢性给药所拮抗。因此,FH/Wjd大鼠可以作为研究抑郁症的动物模型[14]。Tab 1总结了FH/Wjd大鼠符合抑郁症表现的其他标准[7],其中FH/Wjd大鼠的睡眠及认知行为是否符合标准,还有待于进一步研究。
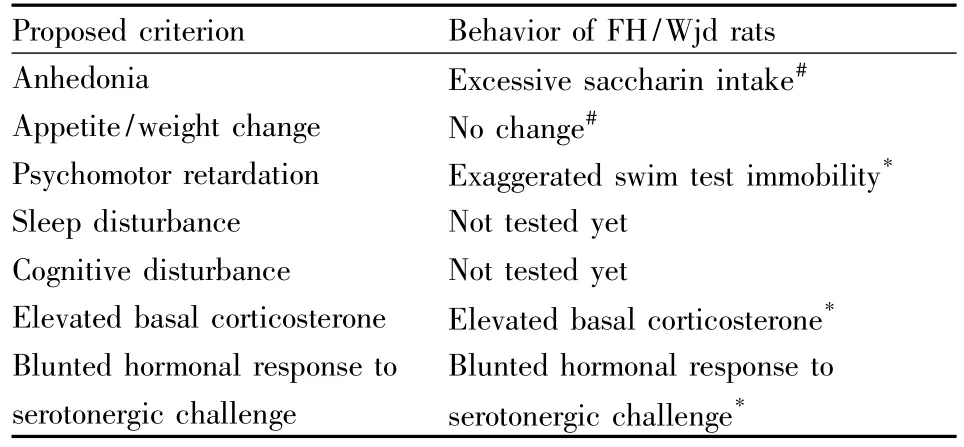
Tab 1 FH/Wjd rat meets criteria for animal model of depression
4 与FH/Wjd大鼠嗜酒、抑郁有关的神经递质系统
研究资料显示,中枢5-HT能神经功能降低时,机体(动物或人)的摄酒行为增加,而提高中枢5-HT能神经功能,将抑制摄酒行为的发生。FH/Wjd是一种遗传性5-HT系统功能低下的大鼠,具有先天嗜酒的行为特性。
在非先天性嗜酒动物试验中,采用5-HT能神经元毒素选择性破坏5-HT能神经元可以使动物对酒精的摄入量增加,但不能促使先天嗜酒的动物饮酒量的增加,可能是由于先天性嗜酒动物中枢5-HT能神经的功能已经处于低下状态[15]。
对于FH/Wjd大鼠,长期酒精作用可以抑制突触小体对5-HT的再摄取,使得5-HT在突触间隙的浓度增加[16]。临床资料证实SSRIs对于某些亚型的酒精成瘾患者具有较好的疗效。此外,5-HT促释放剂也可以提高神经突触间隙中5-HT的浓度,对酒精成瘾产生治疗作用。
5-羟色胺转运体(serotonin transporter,5-HTT)可以摄取突触间隙的5-HT,影响5-HT在突触间隙的存留时间,从而影响5-HT对突触后膜受体的激活作用。与非嗜酒的Wistar大鼠相比,先天嗜酒FH/Wjd大鼠的5-HTT的数目在腹侧被盖区(VTA)、伏核区(NAc)及嗅球结节等与“奖赏”有关的边缘脑核团明显增加。这种5-HTT数目的增加可能导致5-HT在突触间隙存留时间缩短,从而降低5-HT能神经的传递功能。未饮酒的FH/Wjd大鼠脑侧间隔、腹侧苍白球、NAc和VTA区5-HTT的密度比Wistar大鼠明显增高。此外,在嗜酒的FH大鼠大脑皮层前部和海马回,与5-HT1A受体结合的标记物明显增多,这种增加被认为是由于5-HT在突触后膜的递质功能减弱导致受体“上调”的结果。
研究表明,圣约翰草提取物可以降低FH/Wjd大鼠的酒精偏爱度,同时缓解其抑郁表现。有效剂量的圣约翰草提取物可引起5-HTT的上调,海马和隔核5-HT1A受体下调,由此可见,圣约翰草可以调节FH/Wjd大鼠脑内5-HT系统,产生戒酒的药理作用(Tab 2 列出了其它有效化合物)[1,7]。此外,γ-氨基丁酸、内源性阿片肽、多巴胺和谷氨酸神经递质系统也与FH/Wjd大鼠酗酒及抑郁的发生有关。

Tab 2 Successful drug treatments in FH/Wjd rats
5 FH/Wjd大鼠嗜酒和抑郁的遗传学研究
对近交系FH/Wjd大鼠和与它性状相近的非酒精偏爱的ACI/N大鼠采用系统杂交法得到F2代大鼠,若F1代大鼠父本来自于FH/Wjd大鼠,母本来自于ACI/N大鼠,表示为FA,F1代的父本来自于ACI/N,母本来自于FH/Wjd大鼠,则为AF。F2代有4种可能性即FA X FA、FA X AF、AF X FA、AF X AF。在大约65~70日龄时,对F1代和F2代的大鼠进行5 min的FST[7]。2~3 d后,再对其进行双瓶选择自由饮酒实验,测定饮水量、饮酒量和饮糖量,结果显示:FH/Wjd组大鼠饮酒量最多,ACI/N组最少,而杂交组的饮酒量居于两者之间,说明加性基因(additive genetic)参与饮酒量的调节,并且两个杂交组之间饮酒量差异没有显著性,提示饮酒量未受母系遗传的影响。总之,酗酒是5-HT系统功能障碍的一种表现,但是,FH大鼠的亚系FHH/Eur、FHL/Eur和FH/Har饮酒量并不是很多,一些有FH大鼠显型(皮毛特征)的F2代大鼠饮酒量也并不多,因此,需要做更进一步的研究,来确定5-HT系统功能障碍对FH/Wjd大鼠饮酒所起的作用。
在FST中,杂交组AF1、FA1大鼠的不动状态时间更接近于FH/Wjd大鼠,而不是ACI/N大鼠,并且AF1与FA1不动状态的时间差异没有显著性,说明行为绝望也未受母系遗传因素的影响。但是,在饮糖方面,FH/Wjd大鼠饮糖量多于ACI/N大鼠,并且FA杂交后代饮糖量多于AF后代,说明饮糖量受到了母系遗传因素的影响。对这4种大鼠进行遗传学分析显示:饮酒和酒精偏爱度的相关性非常高(r>0.9),酒精和蔗糖的摄入中度相关(r=0.3),行为绝望与饮酒和饮水的相关系数几近于零[10]。观测F2代大鼠这两个性状的同时进行基因筛选,数量性状遗传位点(quantitative trait loci,QTL)的不同或许可以解释这两个性状的遗传差异[17]。Nurnberger等[18]研究发现,人 1 号染色体的某个区域可能与酗酒和抑郁的发生有关,这为进一步的动物学研究提供了理论基础。
6 结论
FH/Wjd大鼠是一个类似于iP大鼠的品系,比其它品系的FH大鼠或ACI/N大鼠自主饮酒量都多。FH/Wjd大鼠符合酗酒动物模型的大部分标准及抑郁模型的部分标准。因此,可以用作研究酗酒和抑郁的动物模型。FH/Wjd大鼠和ACI/N大鼠的杂交F1和F2代的QTL研究表明,饮酒和抑郁的遗传相关性低,并且受多种遗传因素的影响。目前,QTL的研究仅发现了几个基因位点,深入详细的遗传信息的研究可以把数量性状研究位点的范围更加缩小,对染色体定位的进一步研究可以提供更确切的理论依据。迄今为止,临床已有的戒酒药物副作用大,复发率高,限制了其临床应用。FH/Wjd大鼠的研究对开发新型、安全可靠、疗效明显具有戒酒药理活性的化合物提供了良好的实验动物模型。
[1]Overstreet D H,Rezvani A H,Cowen M,et al.Modulation of high alcohol drinking in the inbred Fawn-Hooded(FH/Wjd)rat strain:implications for treatment[J].Addict Biol,2006,11(3 -4):356-73.
[2]刘佳莉,苑玉和,陈乃宏.抑郁症的治疗研究进展[J].中国药理学通报,2011,27(9):1193 -6.
[2]Liu J L,Yuan Y H,Chen N H.Research progress in treatment of depression[J].Chin Pharmacol Bull,2011,27(9):1193 -6.
[3]汤 球,刘志学,崔淑芳,等.大鼠抑郁症模型的建立与评价[J].实验动物科学,2011,28(1):6 -9.
[3]Tang Q,Liu Z X,Cui S F,et al.Establishment and evaluation of the animal model of depressed rats[J].Lab Anim Sci,2011,28(1):6-9.
[4]Lemarquand D,Pihl R O,Benkelfat C.Serotonin and alcohol intake,abuse,and endence-findings of animal studies[J].Biol Psychiatry,1994,36(6):395 -421.
[5]Overstreet D H,Rezvani A H.Behavioral differences between two inbred strains of Fawn-Hooded rat:A model of serotonin dysfunction[J].Psychopharmacology(Berl),1996,128(3):328 -30.
[6]景 丽,张振华,王卫平,等.先天性嗜酒大鼠的饮酒行为特性[J].中国药理学与毒理学杂志,2009,23(1):65 -9.
[6]Jing L,Zhang Z H,Wang W P,et al.Characteristics of alcohol-preferring behavior in FH/Wjd rats[J].Chin J Pharmacol Toxicol,2009,23(1):65 -9.
[7]Overstreet D H,Rezvani A H,Djouma E,et al.Depressive-like behavior and high alcohol drinking co-occur in the FH/WJD rat but appear to be under independent genetic control[J].Neurosci Biobehav Rev,2007,31(1):103 -14.
[8]Cowen M S,Rezvani A H,Jarrott B,Lawrence A J.Ethanol consumption by Fawn-Hooded rats following abstinence:effect of naltrexone and changes in mu-opioid receptor density[J].Alcohol Clin Exp Res,1999,23(6):1008 -14.
[9]Arolfo M P,Overstreet D H,Yao L,et al.Suppression of heavy drinking and alcohol seeking by a selective ALDH-2 inhibitor[J].Alcohol Clin Exp Res,2009,33(11):1935 -44.
[10]Rezvani A H,Parsian A,Overstreet D H.The Fawn-Hooded(FH/Wjd)rat:a genetic animal model of comorbid depression and alcoholism[J].Psychiatr Genet,2002,12(1):1 - 16.
[11]Rezvani A H,Overstreet D H,Cleves M,et al.Further genetic characterization of the fawn-hooded(FH/Wjd)rat,an animal model of comorbid depression and alcoholism[J].Psychiatr Genet,2007,17(2):77 -83.
[12]Rezvani A H,Overstreet D H,Janowsky D S.Genetic serotonin deficiency and alcohol preference in the fawn hooded rats[J].Alcohol Alcohol,1990,25(5):573 -5.
[13]Porsolt R D,Le Pichon M,Jalfre M.Depression:a new animal model sensitive to antidepressant treatments[J].Nature,1977,266(5604):730-2.
[14]Borsini F,Meli A.Is the forced swimming test a suitable model for revealing antidepressant activity[J]?Psychopharmacology(Berl),1988,94(2):147 -60.
[15]陈 锋,Lawrence A J,梁建辉.酒精滥用与成瘾中枢神经递质的研究进展[J].中国药物依赖性杂志,2007,16(1):5 -12.
[15]Cheng F,Lawrence A J,Liang J H.Alcohol abuse and addiction research progress in central neurotransmitter[J].Chin J Drug Depend,2007,16(1):5 -12.
[16]Aulakh C S,Tolliver T,Wozniak K,et al.Functional and biochemical-evidence for altered serotonergic function in the Fawn-Hooded rat strain[J].Pharmacol Biochem Behav,1994,49(3):615-20.
[17]Overstreet D H,Rezvani A H,Parsian A.Behavioural features of alcohol-preferring rats:focus on inbred strains[J].Alcohol Alcohol,1999,34(3):378 -85.
[18]Nurnberger J I Jr,Foroud T,Flury L,et al.Evidence for a locus on chromosome 1 that influences vulnerability to alcoholism and affective disorder[J].Am J Psychiatry,2001,158(5):718 -24.

