牦牛乳中主要过敏原的分离纯化
李海梅,马 莺,崔艳华,汪加琦,李启明,何胜华
(1.哈尔滨工业大学食品科学与工程学院,150090 哈尔滨;2.新希望乳业有限公司研究开发中心,610041 成都)
牦牛乳中主要过敏原的分离纯化
李海梅1,马 莺1,崔艳华1,汪加琦2,李启明2,何胜华1
(1.哈尔滨工业大学食品科学与工程学院,150090 哈尔滨;2.新希望乳业有限公司研究开发中心,610041 成都)
为研究牦牛乳蛋白质的过敏性,用化学方法分离牦牛乳中主要的过敏原蛋白质,采用快速蛋白纯化系统(FPLC)结合凝胶层析技术对分离出的蛋白质进行纯化.在牦牛脱脂乳中添加10%醋酸至酪蛋白的等电点pH4.6,使酪蛋白和乳清蛋白分离.根据酪蛋白在尿素溶液中的溶解度和对钙的敏感性不同,对酪蛋白进行粗分级,得到αs-酪蛋白和β-酪蛋白.应用离子交换色谱和葡聚凝胶sephadex G100进一步纯化粗分级得到的酪蛋白,得到αs-casein和β-酪蛋白.以柠檬酸钠为螯合剂、在低pH并有盐存在的条件下从酸乳清中分离出β-乳球蛋白,FPLC纯化后用RP-HPLC检测其纯度,得到αs-casein和β-酪蛋白纯度分别为87.13%和88.58%,β-乳球蛋白的纯度为80.00%.
牦牛乳;酪蛋白分离;β-乳球蛋白分离;快速蛋白纯化色谱
牛乳中主要的过敏原蛋白为αs-酪蛋白、β-酪蛋白和β-乳球蛋白[1].牦牛乳蛋白质组成与牛乳相似[2],哺乳动物又具有交叉免疫原性,因此,牦牛乳中的过敏原蛋白质可能与牛乳中的相似.为了更好地研究牦牛乳的过敏机制,对牦牛乳中主要过敏原蛋白质进行分离纯化是非常必要的.
目前能有效分离乳中αs-酪蛋白、β-酪蛋白的方法很多,如反相高效液相色谱(RP-HPLC)、毛细管电泳、疏水层析等,β-乳球蛋白的分离方法也很多,如盐析、等电点沉淀、三氯乙酸沉淀、离子交换层析、疏水层析等[1,3-5].但这些方法都不能分离出足够多的目的蛋白用于过敏原的分析[6-9],或成本高、工艺复杂.蛋白质快速分离纯化系统(FPLC)是20世纪中期开始应用的一种大量分离蛋白质的技术[10-12],它既可以实现对蛋白质的快速分离,又可以对蛋白质进行富集.化学分离结合FPLC方法能更有效地分离并纯化乳中的蛋白质.因此,本实验应用化学分离结合FPLC阴离子交换层析和葡聚糖凝胶Sephadex G100层析来分离纯化和富集牦牛乳酪蛋白.
1 实验
1.1 材料与试剂
Cellulose DE-52(Whatman);N,N'-甲叉双丙烯酰胺(Merck公司);乙腈(色谱纯),上海国大化工有限公司;丙烯酰胺,Sigma公司;Sephadex G100,Sigma公司;其他所用试剂均为分析纯.
1.2 仪器与设备
层析柱(Φ1.6 cm×15 cm),上海锦华层析设备厂;FPLC蛋白纯化仪,AKTAprime;垂直板电泳槽(仪),上海六一仪器有限公司;HPLC色谱仪,Agilent.
1.3 实验方法
1.3.1 样品采集
于2009年5月在四川省麦洼地区采集牦牛乳样品,用灭菌瓶(500 mL/瓶)封装,样品速冻后空运回实验室.从四川到哈尔滨的运输过程中样品一直处于冷冻状态,回实验室后放于-20℃冰柜保存,测定时流水解冻.
1.3.2 牦牛乳酪蛋白和乳清蛋白的分离
采用等电点沉淀的方法分离牦牛乳酪蛋白和乳清蛋白.牦牛乳500 mL在2 500×g,20℃条件下离心30 min,去除上层脂肪后得牦牛脱脂乳.10%醋酸调脱脂乳的pH为4.6,室温静置30 min后,混合液在500×g条件下离心20 min,得沉淀为酪蛋白,上清液为乳清蛋白.乳清蛋白于-20℃保存备用.酪蛋白用蒸馏水洗3次后再分散到蒸馏水中,并用0.5 mol/L NaOH调pH7.0,酪蛋白溶解后再用10%醋酸调pH为4.6,重新沉淀酪蛋白.此步骤重复3次后,酪蛋白于-20℃保存备用.
1.3.3 化学方法分离牦牛乳酪蛋白和乳清蛋白
1)α-酪蛋白和β-酪蛋白的分离.酪蛋白在不同浓度尿素溶液中的溶解度不同,本实验将全酪蛋白15 g溶于6.6 mol/L尿素中,再将溶液稀释到尿素的终浓度为4.6 mol/L,4 000 r/min条件下离心15 min,得α-酪蛋白沉淀.上清液稀释到尿素终浓度为 1.7 mol/L,并调节 pH为 4.7,4 000 r/min离心 15 min,得 β-酪蛋白沉淀[1].
2)牦牛乳β-乳球蛋白(β-Lg)的分离.采用盐析的方法制备 β-Lg[4].在乳清蛋白中加 NaC(柠檬酸钠),并调节 NaC浓度为 0.15 mol/L,用6 mol/L柠檬酸调 pH3.9,35℃恒温45 min后,5 000×g、4℃条件下低温离心30 min.得到的上清液用7%NaCl溶液清洗2次,在10 000×g、4℃条件下低温离心20 min.沉淀废弃,上清液4℃透析24 h后,-40℃冻干48 h,得β-Lg.
1.3.4 牦牛乳酪蛋白和乳清蛋白的FPLC Cellulose DE-52层析纯化
蛋白质快速纯化系统(FPLC)包括AKTA exporer Air 100、填充 20 mL Cellulose DE-52(Pharmacia)介质的层析柱(Φ1.6 cm×15 cm),紫外检测波长λ=280 nm.缓冲液A为pH7.0的咪唑-盐酸缓冲液,含0.01 mol/L咪唑、3.3 mol/L尿素、0.2%(体积分数)2-巯基乙醇.缓冲液B为在缓冲液A中加0.4%(质量分数)的NaCl.洗脱液流速为80 mL/h,线性洗脱.样品制备:粗分离得到的酪蛋白和β-乳球蛋白分别溶于起始缓冲液中,0.45 μm滤膜过滤后上样,上样量为0.5 mL.FPLC得到的酪蛋白和乳清蛋白经超纯水透析去盐、去尿素并经聚乙二醇2000浓缩后备用,SDSPAGE鉴定酪蛋白和β-乳球蛋白.
1.3.5 凝胶过滤色谱纯化牦牛乳酪蛋白
凝胶过滤层析的填料为Sephadex G100凝胶.用pH8.0的0.02 mol/L磷酸盐(含3.3 mol/L的尿素)缓冲液平衡柱子(Φ1.6 cm×65 cm).500 μL的样品(300 μL由FPLC离子交换色谱得到的 αs-酪蛋白加200 μL pH8.0的0.02 mol/L磷酸盐)0.45 μm滤膜过滤后上样.洗脱速度为1 mL/min,检测器于280 nm波长处紫外检测.得到的目标蛋白经超纯水透析、脱盐,并经聚乙二醇2000浓缩后冻干,用RP-HPLC检验其纯度.
2 结果与讨论
2.1 化学方法分离牦牛乳αs-酪蛋白、β-酪蛋白和β-乳球蛋白
2.1.1 化学方法分离牦牛乳αs-和β-酪蛋白
等电点沉淀(pH4.6)是分离乳中酪蛋白和乳清蛋白的传统方法[1].用10%的醋酸调整脱脂乳的pH4.6,在室温下静置 30 min.然后溶液在3 000×g、4℃条件下离心15 min,得到酪蛋白胶束沉淀.酪蛋白胶束主要由αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和 κ-酪蛋白组成[14].在酪蛋白胶束中,各酪蛋白间的结合非常紧密,很难分开.而尿素作为一种蛋白质分散剂能够使酪蛋白胶束解聚[15].将酪蛋白沉淀分散到6 mol/L尿素溶液中,4℃条件下静置1 h.用去离子水稀释溶液,使尿素的最终浓度为4.63 mol/L,再将其置于4℃条件下静置1 h.然后溶液在3 000×g、4℃条件下离心15 min,得到 α-酪蛋白沉淀(主要含有αs1-酪蛋白、αs2-酪蛋白、κ-酪蛋白和 λ-酪蛋白).继续用去离子水稀释上清液,使尿素的终浓度为1.7 mol/L,并调整其pH为4.7,即得到β-酪蛋白沉淀,将其透析浓缩后,在-70℃条件下保存备用.
在酪蛋白胶束中αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白是钙敏感性蛋白,而κ-酪蛋白是钙不敏性蛋白并对维持酪蛋白胶束的稳定性起重要作用[16-17].不同的酪蛋白对钙的敏感性不同,其在钙溶液中的溶解度也不同,将α-酪蛋白分散到0.4 mol/L pH7的CaCl2溶液中,在4℃下放置过夜得到 αs-酪蛋白沉淀(主要包含 αs1-酪蛋白、αs2-酪蛋白).得到的αs-酪蛋白沉淀透析浓缩后-70℃保存备用.化学分离方法得到的αs-酪蛋白和β-酪蛋白仍是混合蛋白,还需要对其进行纯化.
2.1.2 化学方法分离β-乳球蛋白
将酸乳清作为分离β-乳球蛋白的原料.酸乳清经螯合剂柠檬酸钠处理后其SDS-PAGE如图1所示.可以看出,样品中主要含有β-乳球蛋白,但还有少量的BSA.乳清中的Ca2+对α-乳白蛋白和β-乳球蛋白的稳定性起着重要的作用[18-21].α-乳白蛋白是钙结合蛋白,每摩尔α-乳白蛋白中含有1 mol的Ca2+,Ca2+对稳定α-乳白蛋白的空间结构起着重要的作用[22-23].但是当溶液的pH低于3.9,在有盐存在的条件下会降低钙与α-乳白蛋白的结合能力,使用钙螯合剂柠檬酸钠很容易使钙螯合,并生成α-乳白蛋白沉淀,从而使α-乳白蛋白和β-乳球蛋白分离[4].从图 1可以看出,在pH3.9、柠檬酸钠为螯合剂的条件下α-乳白蛋白和β-乳球蛋白得到了很好的分离.
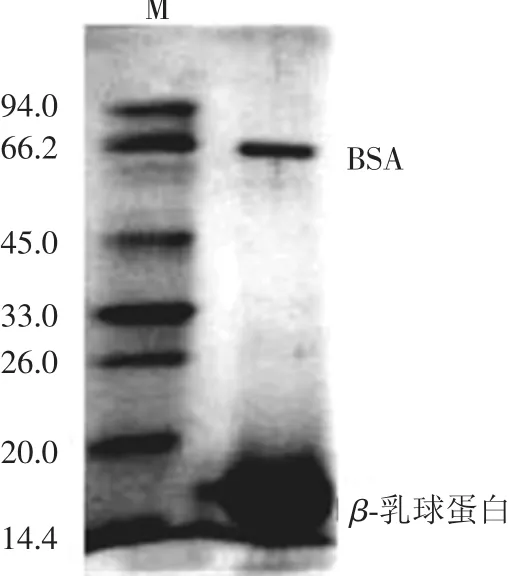
图1 柠檬酸钠螯合剂沉淀酸乳清中的β-乳球蛋白SDS-PAGE电泳图
2.2 牦牛乳αs-酪蛋白纯化
2.2.1 FPLC纯化牦牛乳αs-酪蛋白
在不同的pH条件下αs-酪蛋白和β-酪蛋白的等电点和所携带的静电荷是不同的[24],根据该特点可应用离子交换层析的方法分离αs-酪蛋白和β-酪蛋白.采用阴离子交换色谱、Cellulose DE-52为填料、含有尿素的咪唑盐酸缓冲液在线性条件下进行洗脱、纯化经化学分离得到的αs-酪蛋白.αs-酪蛋白在快速蛋白纯化系统中被Cellulose DE-52介质吸附,经含有NaCl(0~0.4%)的洗脱液线性洗脱分两个组分(图2),洗脱峰A和B.由于洗脱峰A中含有的蛋白质的量较少,没有收集其洗脱峰.SDS-PAGE检测洗脱峰B如图2所示,洗脱峰B的主要成分为αs-酪蛋白,并含一部分β-酪蛋白 (图3).收集洗脱峰B,冻干后备用.
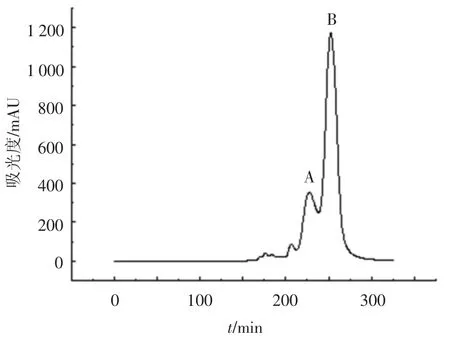
图2 Cellulose DE-52阴离子交换色谱快速纯化牦牛乳αs-酪蛋白结果
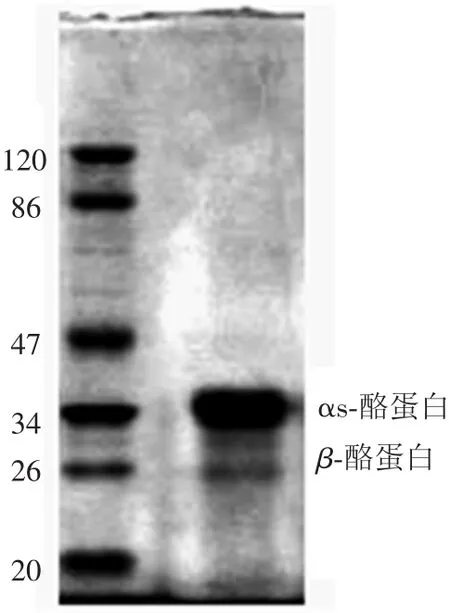
图3 FPLC纯化得到的αs-酪蛋白SDS-PAGE电泳图
2.2.2 Sephadex G100纯化牦牛乳αs-酪蛋白
相对αs-酪蛋白经FPLC系统得到了很好的分离,但其组分中仍含有一部分β-酪蛋白.根据酪蛋白之间相对分子质量上的差别,应用葡聚糖凝胶Sephadex G100对αs-酪蛋白进一步纯化.由上步纯化得到的组分B用Sephadex G100进一步纯化,色谱图如图4所示.收集洗脱峰C,并应用RP-HPLC检测,结果如图5所示.根据色谱峰面积比计算αs-酪蛋白的纯度为87.13%.
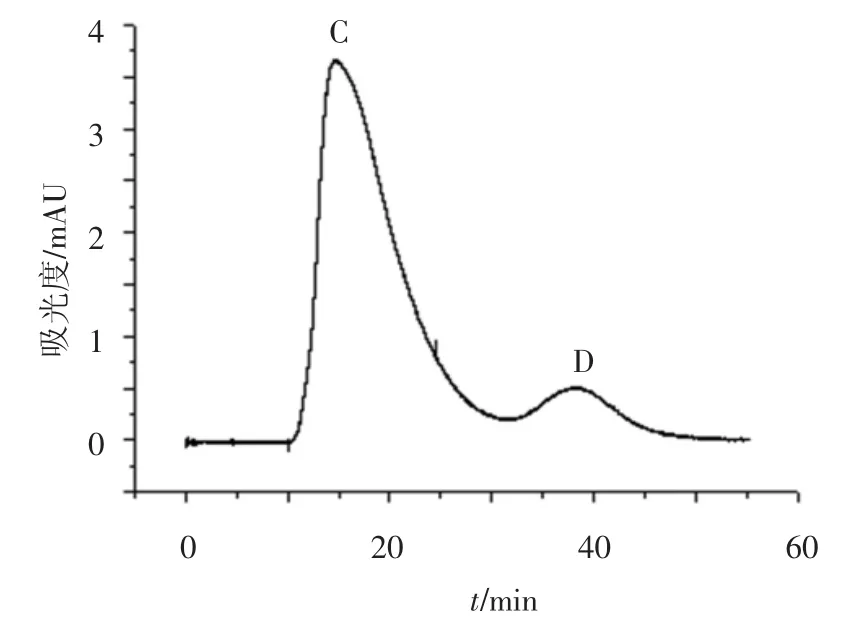
图4 Sephadex G100纯化FPLC得到的αs-酪蛋白色谱图
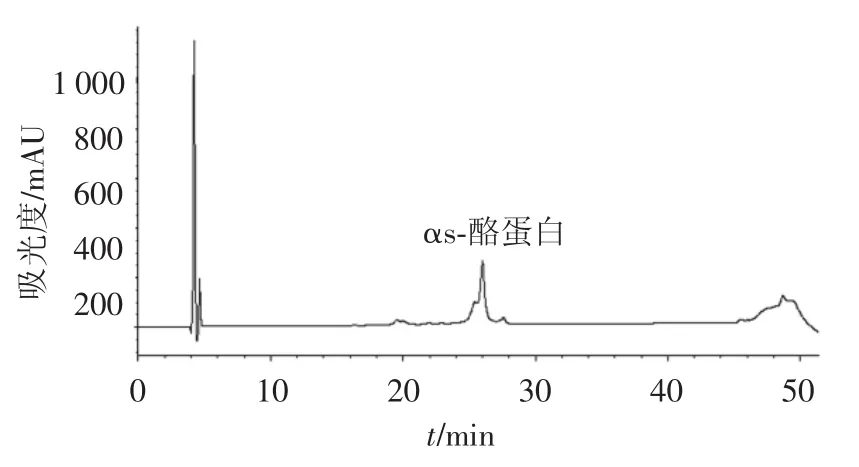
图5 RP-HPLC分离αs-酪蛋白结果
2.3 牦牛乳β-酪蛋白的纯化
2.3.1 FPLC纯化牦牛乳β-酪蛋白
采用FPLC对化学分离方法得到的β-酪蛋白进一步纯化.β-酪蛋白在快速蛋白纯化系统中被Cellulose DE-52介质吸附并经线性洗脱后分离出来(图6).接收β-酪蛋白洗脱峰的中间段,并用SDS-PAGE检测,结果如图7所示.洗脱峰B的主要成分为 β-酪蛋白,并含一部分 αs-酪蛋白(图3).收集β-酪蛋白洗脱峰,冻干后备用.
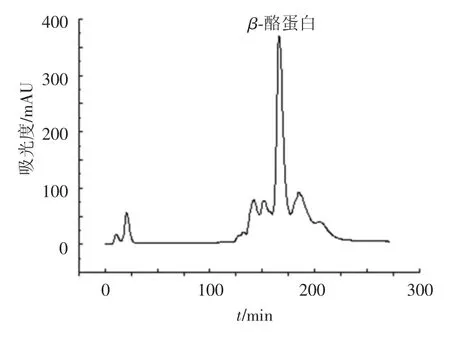
图6 Cellulose DE-52阴离子交换色谱快速纯化牦牛乳β-酪蛋白结果
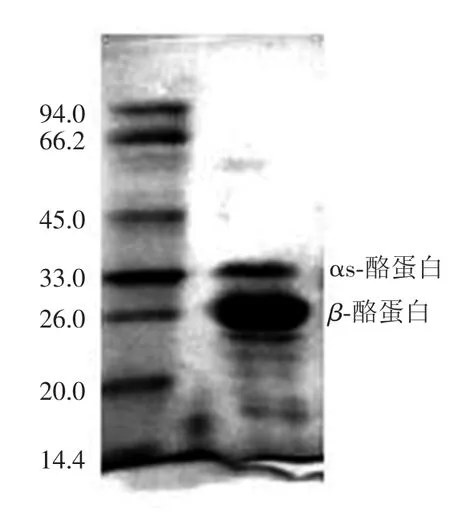
图7 FPLC得到的β-酪蛋白SDS-PAGE电泳图
2.3.2 Sephadex G100纯化牦牛乳β-酪蛋白
由上步纯化得到的 β-酪蛋白用 Sephadex G100进一步纯化,色谱图如图8所示.收集β-酪蛋白洗脱峰,并应用RP-HPLC鉴定,结果如图9所示.根据色谱峰面积比计算β-酪蛋白的纯度为88.58%.
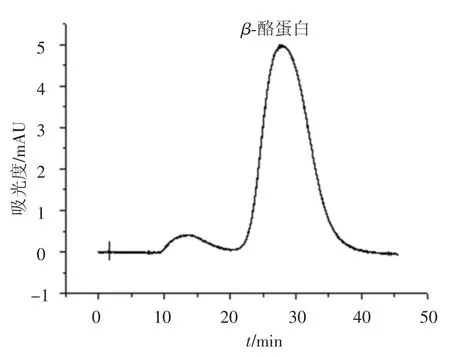
图8 Sephadex G-100纯化FPLC得到的β-酪蛋白色谱图
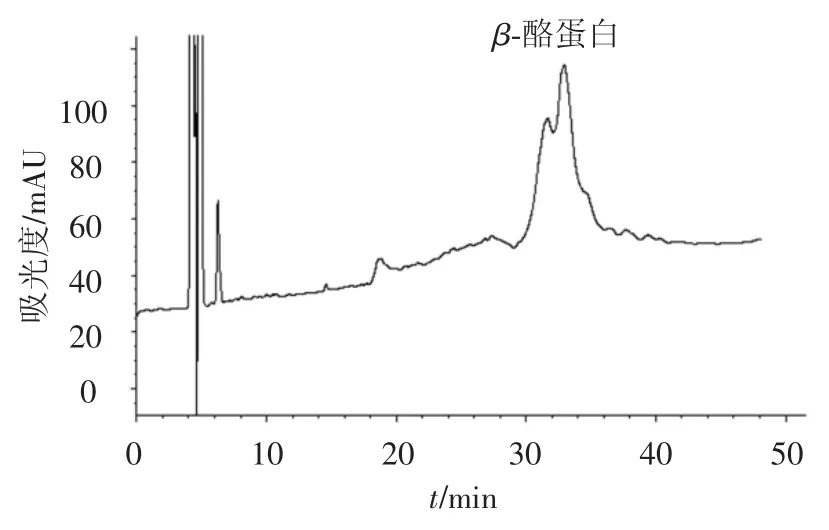
图9 RP-HPLC分离β-酪蛋白结果
2.4 FPLC纯化牦牛乳β-乳球蛋白
采用FPLC对化学分离方法得到的β-乳球蛋白进一步纯化.β-乳球蛋白在快速蛋白纯化系统中分出3个峰,其中洗脱峰A为BSA,洗脱峰B和C为β-乳球蛋白(图10).因为β-乳球蛋白为二聚体,在FPLC系统中被分成了两个峰.接收β-乳球蛋白洗脱峰B和C,并用RP-HPLC检测,如图11所示,其纯度为80.00%.收集β-乳球蛋白洗脱峰,冻干后备用.
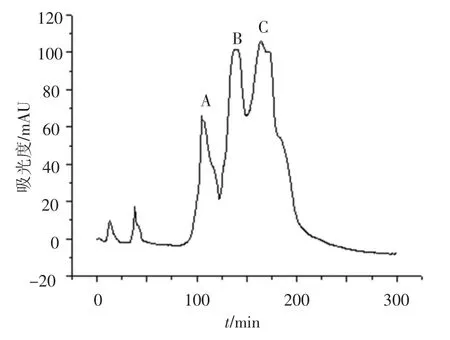
图10 Cellulose DE-52阴离子交换色谱快速纯化牦牛乳β-乳球蛋白结果
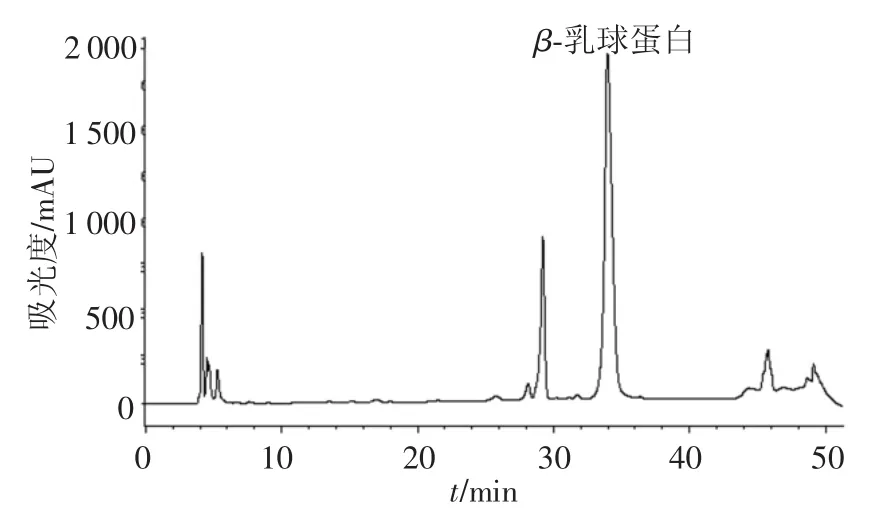
图11 RP-HPLC分离β-乳球蛋白结果
3 结语
根据酪蛋白对钙的敏感性不同和不同pH条件下酪蛋白在不同浓度尿素溶液中的溶解度不同,将酪蛋白粗分级为α-酪蛋白和β-酪蛋白.又利用FPLC阴离子交换层析技术和Sephadex G100凝胶层析技术对粗分级的α-酪蛋白和β-酪蛋白进行纯化,得到纯度分别为87.13%和88.58%的α-酪蛋白和β-酪蛋白.以柠檬酸钠为螯合剂,在低pH3.9条件下分离出了β-乳球蛋白,并经FPLC纯化后得到纯度为80.00%的β-乳球蛋白.
[1]KAMINOGAVA S,TOSUKA M.Allergenicity of milk proteins[M].New York:Academic/Plenum,2003.
[2]LI Haimei,MA Ying,DONG Aijun,et al.Protein composition of yak milk[J].Dairy Sci Technol,2010,90:111-117.
[3]DIJK van J A P P,SMIT J A M.Size-exclusion chromatography-multiangle laser light scattering analysis of βlactoglobulin and bovine serum albumin in aqueous solution with added salt[J].Journal of Chromatography A,2000,867(1/2):105-112.
[4]ALOMIRAH H F,ALLI I.Separation and characterization of β-lactoglobulin and α-lactalbumin from whey and whey protein preparations[J].International Dairy Journal,2004,14(5):411 -419.
[5]JOSÉ M L,GLORIA I G,CARMEN M R.An improved method for isolation of β-lobulin[J].International Dairy Journal,2008,18(1):55 -63.
[6]ANA C A V,NATÉRCIA T,ISABEL M P L V O F.Separation and quantification of the major casein fractions by reverse-phase high-performance liquid chromatography and urea-polyacrylamide gel electrophoresis:detection of milk adulterations[J].Journal of Chromatography A,2002,967(2):209-218.
[7]EMILIA B,FABRIZIO F,GIORGIO R,et al.New method for separation and determination of denatured caseins by hydrophobic interaction chromatography[J].Talanta,2001,54(2):343-349.
[8]ORTEGA N,ALBILLOS S M,BUSTO M D.Application of factorial design and response surface methodology to the analysis of bovine caseins by capillary zone electrophoresis[J].Food Control,2003,14(5):307 -315.
[9]HAM J S,JEONG S G,LEE S G,et al.Irradiation effect on α-and β-caseins of milk and Queso Blanco cheese determined by capillary electrophoresis[J].Radiation Physics and Chemistry,2009,78(2):158 -163.
[10]JOHANN P,PHILIP R A,INGOLF K,et al.Gram scale separation of casein proteins from whole casein on a Source 30Q anion-exchange resin column utilizing fast protein liquid chromatography[J].(FPLC)Protein Expression and Purification,2008,60(2):176-181.
[11]HOLLAR C M,LAW A J R,DALGLEISH D G,et al.Separation of major casein fractions using cation-exchange fast protein liquid chromatography[J].Journal of Dairy Science,1991,74(8):2403-2409.
[12]SANOGO T,PAQUET D,AUBERT F,et al.Purification of αS1-Casein by fast protein liquid chromatography[J].Journal of Dairy Science,1989,72(9):2242 -2246.
[13]DAVID S H.Casein micelle structure:models and muddles[J].Current Opinion in Colloid & Interface Science,2006,11(2/3):148-153.
[14]MORR C V.Effect of oxalate and urea upon ultracentrifugation properties of raw and heated skimmilk casein micelles[J].Journal of Dairy Science,1967,50(11):1744-1751.
[15]PARRY R M J,CARROLL R J.Location of κ-casein in milk micelles[J].Biochimica et Biophysica Acta(BBA)-Protein Structure,1969,194(1):138-150.
[16]DALGLEISH D G.Casein micelles as colloids:surface structures and stabilities[J].Journal of Dairy Science,1998,81(11):3013-3018.
[17]BRAMAUD C,AIMAR P,DAUFIN G.Thermal isoelectric precipitation of α-lactalbumin from whey protein concentrate:influence of protein calcium complexation[J].Biotechnol Bioeng,1995,47:121 -130.
[18]EUGENIA L M,SILVIA A,CARLOS M,et al.α-Lactalbumin precipitation from commercial whey protein concentrates[J].Separation and Purification Technology,2007,52(3):446-453.
[19]JOHAN D,IGNACE H,FRANS V C,et al.Comparison of the binding of Na+and Ca2+to bovine α-lactalbumin[J].Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,1987,912(2):211-219.
[20]OWUSU R K.Thermodynamic analysis of the effect of calcium on bovine alpha-lactalbumin conformational stability[J].Food Chemistry,1992,44(3):189 -194.
[21]TONYA H,YURI V G,PETER L P.A calorimetric study of the influence of calcium on the stability of bovine α-lactalbumin[J].Biophysical Chemistry,2000,84(1):27-34.
[22]WOJCIECH D,MINORU K,AKIO S,et al.Fouriertransform infrared spectroscopy study of the pressure-induced changes in the structure of the bovine α-lactalbumin:the stabilizing role of the calcium ion[J].Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,1999,1433(1/2):45 -55.
[23]CORDESCHI M,PAOLA L D,MARRELLI L,et al.Net proton charge of β-and κ-casein in concentrated aqueous electrolyte solutions[J].Biophysical Chemistry,2003,103(1):77-88.
[24]ASIMA C,SOUMEN B.pH-induced structural transitions of caseins[J].Journal of Photochemistry and Photobiology B:Biology,2007,87(3):191-199.
Separation and purification of major allergens in yak milk
LI Hai-mei1,MA Ying1,CUI Yan-hua1,WANG Jia-qi2,LI Qi-ming2,HE Sheng-hua1
(1.School of Food Science and Engineering,Harbin Institute of Technology,150090 Harbin,China;2.Research and Development Central of New Hope Dairy Company,610041 Chengdu,China)
The major allergens in yak milk were obtained by chemical methods,and purified by a fast protein liquid chromatography(FPLC)combined gel chromatography in order to analyze allergenicity of protein in yak milk.Casein and whey were isolated after adjusting isoelectric precipitating of skimmed milk to 4.6 by adding 10%acetic acid.Based on differential solubility in urea solutions and differential sensitivity of calcium,αscasein and β-casein were separated from whole casein.And then,the crude fractions of αs-casein,β-casein were further separated using anion-exchange FPLC and Sephadex G100 column.β-lactoglobulin was separated from acid whey using chelating of citrate sodium at low pH in the presence of salt and purified by FPLC.The results of RP-HPLC showed that the purities of αs-,β-casein,and β-lactoglobulin were 87.13% ,88.58% ,and 80.00%,respectively.
yak milk;casein separation;β-lactoglobulin separation;fast protein liquid chromatography(FPLC)
TS252
A
0367-6234(2012)04-0080-06
2011-04-15.
国家自然科学基金资助项目(30871953).
李海梅(1974—),女,博士研究生,讲师;
马 莺(1961—),女,教授,博士生导师.
李海梅,haimeili@hit.edu.cn.
(编辑 刘 彤)

