梭曼抗毒剂及其生物标志物检测方法的研究进展
闫珑,谢剑炜
梭曼抗毒剂及其生物标志物检测方法的研究进展
闫珑,谢剑炜
神经毒剂;梭曼;抗毒剂;检测方法
R 99
神经性毒剂是一类具有速效致死性的有机磷酸酯类化合物,也称为有机磷毒剂(OP)。美军按化学结构和战术使用特点将之分为两大类:一类为G类毒剂,以呼吸道吸入为主要中毒途径,如塔崩(GA)、沙林(GB)、梭曼(GD)和环基沙林(GF)等;另一类为V类毒剂,以皮肤染毒吸收为主要中毒途径,如维埃克斯(VX)和俄罗斯维埃克斯(RVX)等。梭曼因其具有难防难治的特点,一直是国内外防化医学工作者研究的重点之一。
梭曼在常温下为液态,有弱水果味,在G类毒剂中挥发度最低、水溶性好但水解速度很慢,遇碱时水解加速,作为化学战剂具有稳定、隐蔽、速杀等特点。
梭曼急性中毒可依据全血胆碱酯酶活性判断其中毒程度。
轻度中毒时,胆碱酯酶活性低于正常的70%(50%~70%),此时主要影响外周M受体,出现M样症状,即腺体分泌增加,如汗腺分泌增加引起出汗多、唾液腺分泌增加引起流涎、泪腺分泌增多引起流泪、鼻黏膜腺体分泌增加引起流涕、支气管腺体分泌增加引起咳嗽;平滑肌活动增加表现在虹膜括约肌收缩引起瞳孔缩小、支气管收缩引起呼吸困难、胃肠道蠕动加快引起恶心、呕吐、膀胱逼尿肌运动增加引起尿频尿急等。
中度中毒时,胆碱酯酶活性低于正常的50%(30%~50%),此时上述M样症状加重,还会出现站立不稳等N样症状,以及反应能力下降等中枢样症状。
重度中毒时,胆碱酯酶活性低于正常的30%,此时M、N样症状都加重,中枢症状也加重,出现严重的缩瞳、流汗、流涎、肌颤、惊厥、昏迷等。
梭曼毒性强、作用快,必须采取有效的防护和急救措施。通常除一般的防毒面具外,还需使用皮肤防护器材。出现中毒症状时应立即进行自救互救,主要是注射神经毒剂急救针、防止继续中毒和进行人工呼吸。
现就梭曼中毒的生理毒理机制、梭曼抗毒剂及梭曼中毒体内生物标志物的检测方法,综述如下。
1 梭曼的中毒机制
梭曼的毒理作用机制普遍认为是其进入体内后能迅速作用于胆碱能神经的突触和神经末梢处的乙酰胆碱酯酶(AChE),与乙酰胆碱酯酶的结合部位和(或)催化酶解部位结合,阻止底物与酶接近且抑制酶活性,使其不能催化水解神经递质乙酰胆碱(ACh),导致乙酰胆碱的大量蓄积,使外周和中枢的胆碱能受体过度兴奋,引起神经系统功能亢进,出现一系列中毒症状。由于梭曼脂溶性大,易透过血脑屏障,对中枢神经系统的毒性作用较大,急性大剂量中毒常因惊厥和呼吸中枢抑制而死亡。
神经性毒剂进入体内后与AChE相互作用形成膦酰化乙酰胆碱酯酶,因此对AChE结构的认识将有助于阐明有机磷类化学毒剂的作用机制。AChE对底物的高催化效能以及其与有机磷毒剂的高反应性能均缘于其独特的反应活性中心。1991年,Sussmna等首次报道了电鳐AChE催化亚基的X射线晶体衍射图[1],从而确定了AChE的三维结构。在电鳐AChE球形分子的表面有一向内凹陷的峡谷,谷深达2 nm,几乎占到了酶分子的一半。谷底部逐渐拓宽,酶的活性中心就位于谷底部。活性中心由3个主要区域组成。(1)阴离子亚位点,识别底物乙酰胆碱的季铵盐基团。(2)催化三联体,由Ser200、Glu327及His440构成,负责底物乙酰胆碱的水解。(3)胆碱结合位点,Trp84、Glu199、Tyr330与Tyr442构成了与底物的结合部位,3个芳香族氨基酸残基中任何一个定点突变都能显著降低底物与AChE的亲和力以及酶的活性。在谷的入口处,有一个调节位点被称为外周阴离子位点(PAS),主要由一些带负电的氨基酸Tyr70、Asp72、Tyr121和Trp279组成。不同的配基结合于PAS的位置和方式不同,但均涉及Asp72和Trp279。结合配基后的PAS,通过变构调节,可以影响酶活性中心与底物或其他配基的亲和性。
乙酰胆碱或梭曼作用于AChE时,都与AChE活性中心催化部位的丝氨酸羟基的氧原子共价结合。但AChE-ACh复合体中ACh酯键催化水解断裂以及酶活力恢复的过程只有几个毫秒,因此能保持突触传递的灵活性。而梭曼与AChE相互作用形成的膦酰化胆碱酯酶却很难被水解而使酶重活化[2],随着中毒时间延长,膦酸化胆碱酯酶失去重活化的能力,成为“老化酶”。老化是指中毒酶从可以重活化状态到不能重活化状态,其实质是一种自动催化的脱烷基反应[3]。梭曼膦酰化AChE老化非常迅速[4],而老化酶的性质稳定,目前已知的所有药物均不能使梭曼老化酶重活化[5],这是梭曼仍为目前神经性毒剂防治的重点和难点的主要原因。另一方面,被梭曼抑制的未老化酶也难被双复磷(LüH6)、氯磷定(2PAM·Cl)、双磷定(TMB4)等重活化剂重活化。
2 梭曼抗毒剂研究进展
在梭曼中毒防治的各类抗毒剂中,胆碱酯酶保护剂主要用作中毒的预防,抗胆碱能药物可用于对症治疗和中毒的急救,而重活化剂才是治疗梭曼中毒的根本措施。
2.1 季铵类重活化剂吡啶甲醛肟类(PAM类)化合物为第一代经典重活化剂。1959年,Wi lson报道了吡啶醛肟季铵盐类化合物对膦酰化AChE有重活化作用,并提出了几何互补假说机制[6]。此后的十年内,先后出现了碘磷定(2PAM·I)、甲磺磷定(P2S)等不同盐的PAM类化合物。其中,第一代重活化剂的代表化合物氯磷定(2PAM·Cl)具有稳定性高、溶解度好及毒副作用小等优点。
双季铵吡啶醛肟类化合物为第二代经典重活化剂。代表化合物有双磷定(TMB4)和双复磷(LüH6),它们与阿托品伍用对大多数神经性毒剂中毒的治疗效果良好[7]。但是,以上药物在治疗梭曼中毒时仍然无效或效果很差。
H系列化合物和双吡啶双肟类化合物为第三代经典重活化剂[8-10],HI-6、HLö-7为其中的代表化合物。HI-6主要具有下列特点:(1)疗效显著,对沙林、维埃克斯中毒具有良好的效果,对梭曼中毒也具有明显的效果:(2)具有良好的重活化作用,在多种动物体内对梭曼中毒的膦酰化AChE有显著的重活化作用;(3)毒性低,安全范围大。HLö-7属于双吡啶双肟类化合物。HLö-7对塔崩、沙林、梭曼和环基沙林中毒救治的有效剂量安全比大于HI-6,但水溶液或缓冲液的稳定性比HI-6差。HLö-7对梭曼和塔崩抑制的AChE均具有较好的重活化作用,这一特点是以往任何重活化剂都不具备的[11]。
以上季铵类化合物均属于经典重活化剂,这类化合物主要有两点缺陷:一是,难以透过血脑屏障;二是,在水溶液或缓冲液中的溶解性差。这就严重限制了这类药物的治疗效果和可作为注射液使用的方便性。
2.2 叔铵类重活化剂我国军事医学科学院毒物药物研究所的科研人员经过多年研究,发现了一类与国外文献报道的各种抗毒药物具有完全不同结构的新型叔铵类重活化剂,开创了可进入中枢的重活化剂药物的研究时代[12]。最初研制的药物对梭曼的抗毒效价较低,而且药物在水溶液中的稳定性较差。近年来,经过计算机辅助药物设计、筛选、合成了一系列新型的叔铵类重活化剂。动物实验证明,这类化合物不仅对塔崩、沙林和维埃克斯中毒动物脑AChE有较好的重活化作用,而且对梭曼中毒脑AChE也有部分重活化作用。这一新型重活化剂药物的发现在国际上率先开辟了新的神经性毒剂抗毒药物的研究思路和方向。
3 梭曼中毒体内生物标志物的检测方法
神经性毒剂的分析检测方法依样品来源不同而不同,其基质主要包括水、土壤、空气等环境样品、食品和生物医学样品等。由于生物医学样品的分析检测可以提供生物体接触神经性毒剂的暴露水平,具有较强溯源性,因此近年来受到世界各国科学家的关注。
3.1 毒剂原型的分析检测这类方法的突出特点是可以快速、直接确定毒剂的类型和结构[13-14],如冯翠玲[13]采用气相色谱法(GC)对血浆中沙林、梭曼、环基沙林、维埃克斯、俄罗斯维埃克斯等5种毒剂进行分析检测研究。但由于部分神经性毒剂自身降解速率较快,或是若体内仅存在少量毒剂原型或样品久置后,这类方法由于灵敏度所限,则不能满足事发后毒剂的痕量检测及溯源性检测的要求。
3.2 毒剂代谢产物的分析检测毒剂原型在体内很不稳定且毒剂蛋白加合物存在自然老化过程,因此容易产生对应的一级降解产物烷基甲基膦酸酯(AMPAs)和二级降解产物甲基膦酸(MPA),大量生物医学样品的分析检测研究即是围绕毒剂降解产物来建立的。梭曼的一级降解产物甲基膦酸频哪酯(PMPA)即是梭曼中毒的特征性生物标志物。见图1。
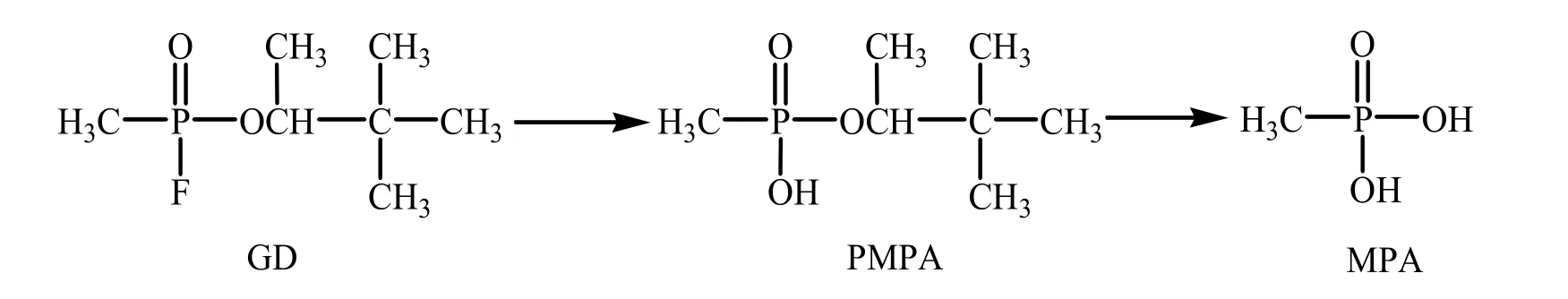
图1 梭曼水解的主要代谢产物
3.2.1 气相色谱及其联用技术尿液中毒剂降解产物的检测为确证接触神经性毒剂提供了最简单的分析途径。大多数代谢产物是小分子量的极性分子,可以在衍生化后用气相色谱(GC)、气相色谱-质谱(GC-MS)或气相色谱-串联质谱(GC-MS/MS)等进行分析。对于神经性毒剂代谢产物的气相色谱分析,常用的衍生化方法有甲基化、硅烷化和五氟苄基化[15]等。Driskel l等[16]用重氮甲烷为甲基化试剂,测定尿液中的AMPAs代谢物。衍生化反应只需在常温进行10min。这是一种高通量的方法,检测限为20 ng/mL。
最为常用的衍生化方法是将烷基膦酸酯类化合物转化为它们的三甲基硅烷酯或者叔丁基二甲基硅烷酯。N,O-二(三甲基硅烷)三氟乙酰胺(BSTFA)或者三甲基氯硅烷(TMCS)是常用的三甲基硅烷化衍生化试剂。国际禁止化学武器组织(OPCW)曾推荐该反应的条件为60℃反应30min[17]。Wang等[18]报道了人血浆中6种神经性毒剂降解产物三甲基硅烷衍生物的定量检测方法。他们首先将去除蛋白质后的血浆中用阴离子交换柱固相萃取,再用95:5(V/V)BSTFA-TMCS衍生化,然后加入内标(IS)正十四烷,经气相色谱-质谱法同时测定6种衍生化产物。见图2。选择离子(SIM)模式下,6种降解产物在0.05~5.0 ng/mL范围内线性良好。该方法对MPA的回收率可达50.2%,对PMPA的回收率可达79.7%。
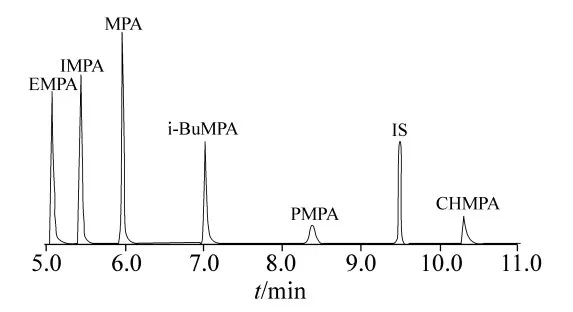
图2 人血浆中6种毒剂降解产物-TMCS衍生物的GC/MS 选择离子检测图
当对方法检测限有较高的要求时,可以将AMPAs衍生化为五氟苄基酯。这对于经长时间、远距离转移的中毒伤员生物样品溯源性研究和确证化学武器施用具有重要的意义。常用的衍生化试剂为五氟苄基溴。Palit等[19]用负离子化学电离模式(NCI)对经五氟苄基溴衍生化的AMPAs进行GC-MS分析,检测限可达100 pg/mL。Riches等[20]对尿液采用酸化、固相萃取(SPE)、五氟苄基衍生化等前处理步骤,最后进行GC-MS分析,其中PMPA、异丙基甲基膦酸(IMPA)、异丁基甲基膦酸(i-BuMPA)和环己基甲基膦酸(CHMPA)的LOD均达到了100 pg/mL。
3.2.2 液相色谱-质谱联用技术近十余年来,液相色谱-质谱联用技术随着接口技术的发展已成为现代分析手段中必不可少的组成部分,越来越多的文献报道神经性毒剂水解产物的LC-MS检测方法。Read等[21]建立了水溶液或土壤提取液中神经性毒剂、芥子气和失能剂水解产物的液相色谱-大气压化学电离质谱(LC-APCI-MS)和液相色谱-电喷雾质谱(LC-ESI-MS)定量检测方法,检测限均可达10~100 ng/mL。Creasy[26]用氢氧化三甲基苯胺进行柱后衍生化,提高了LC-APCI-MS对MPA等化合物的检测灵敏度。D'Agostino等[23]报道了LC-ESI-MS同时检测神经性毒剂的原型和水解产物的方法,并用于土壤提取液中的沙林、梭曼、IMPA和PMPA的测定。Katagi等[24]应用液相色谱-快原子轰击质谱联用(LC-FAB-MS/MS)技术分析AMPAs。但除了需要SPE提取外,此方法需要用溴苯甲酰溴对AMPAs进行衍生化,样品处理耗时较长,但检测限达1~5 ng/mL。
3.3 胆碱酯酶加合物的检测神经性毒剂是具有亲电性的化学物质,进入体内后迅速与AChE活性中心的丝氨酸羟基氧原子作用形成磷酰化酶,同时还与血浆中的丁酰胆碱酯酶(BuChE)以及白蛋白等结合,形成各种毒剂-蛋白质(酶)加合物。如前所述,神经毒剂与AChE的加合是其发挥毒理作用的主要反应。中毒的BuChE在体内半衰期为5~16天,另外BuChE在血浆中浓度达80 nmol/L,是AChE的26倍[25],是确证接触神经性毒剂的最佳生物标志物之一。
Fidder等[26]分别用胰蛋白酶、嗜热菌蛋白酶、链霉蛋白酶和胃蛋白酶对梭曼-人BuChE加合物酶解,得到不同的含有膦酸基团的肽段,再经液相色谱-串级质谱(ESI)测定多肽序列。结果显示,经胃蛋白酶解得到的膦酸化九肽[FGES(MPA)AGAAS]以其酶解操作简便、检测灵敏度高等优点成为理想的检测肽段。Tsuge[27]利用普鲁卡因亲和层析法将BuChE-毒剂加合物从血清中分离得到,再经SDS-PAGE凝胶电泳分离纯化,以胰蛋白酶酶切,产生的十一肽混合物GEXAGAASVSL(X代表膦酰化的丝氨酸)进行液相色谱-电喷雾-飞行时间串级质谱(LC-ESI-Q-TOFMS)分析,染毒BuChE的分子量较未染毒的BuChE多出120Da、106Da和162Da,分别代表和丝氨酸活性中心结合的IMPA、EMPA和PMPA。这种方法对老化的BuChE同样有效。Elhanany[28]用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF)测定不同神经毒剂与人和电鳐AChE加合物的胰蛋白酶酶解后的肽段,确定毒剂与人AChE结合位点为203位的丝氨酸而与电鳐AChE结合位点为200的丝氨酸,并研究阐述了毒剂及有机磷农药与AChE的作用机制。
氟离子置换法的原理是神经性毒剂在体内和AChE及BuChE的丝氨酸羟基结合后生成了膦酰化的胆碱酯酶,与孵育后,神经性毒剂的膦酸基部分可以从胆碱酯酶中释放出来,再生生成有机氟膦酸酯。此方法样品制备简单,可以追溯染毒毒剂的结构原型,同时也可以满足微量中毒检测和溯源性检测的要求。白海红等[29]采用了氟离子重活化-气相色谱质谱方法检测染毒人血清中的神经性毒剂沙林。向C18柱净化后的染毒血清中加入终浓度为0.2mol/L的氟化钾,于37℃、pH 5.5重活化2min,反应混合物经C18柱及二氯甲烷洗脱后得到GB毒剂原型,浓缩洗脱液进行GC-MS分析,检出限为4%的酶活性抑制率。氟离子置换法亦被扩展到5种神经性毒剂(塔崩、沙林、环基沙林、梭曼和维埃克斯)的分析,可定量检测到血浆样品中仅0.01%的Bu-ChE活性被抑制的情况[25]。值得说明的是,梭曼与AChE加合后难以重活化,但梭曼与其他蛋白质的加合物可被氟离子置换,因此可以通过此法测定梭曼中毒样品。
3.4 白蛋白加合物近年来,神经性毒剂与白蛋白(411位的酪氨酸)的加合物亦受到重视。虽然血清白蛋白和毒剂的结合常数远小于胆碱酯酶,但是在血清中,白蛋白是高丰度蛋白,其浓度是胆碱酯酶的1000倍之多,同时白蛋白-毒剂加合物目前未发现存在老化现象[30],发展白蛋白-毒剂加合物为生物标志物的毒剂检测方法对于确证毒剂接触,实现高灵敏检测具有很好的应用前景。由于该方法检测的对象同样是生物大分子,所以多数研究人员选择90年代以来飞速发展的生物质谱如电喷雾电离质谱(ESI/MS)、MALDI-TOF/MS等仪器作为研究的工具。
Wi l l iams等[30]将神经毒剂与血浆孵育后,用链霉蛋白酶酶解血浆样品中的白蛋白(pH 9.4),再经C8固相萃取柱提取富集梭曼-酪氨酸加合物,最后用LC-MS/MS(ESI)进行样品分析,该方法的线性范围为0.5~250 ng/mL。Li等[31]用胃蛋白酶酶解孵育后的血浆样品,经MALDI-TOF/MS分析,发现神经毒剂结合的两条特异肽段(VRYTKKVPQVSTPTL和LVRYTKKVPQVSTPTL)。当用胰蛋白酶酶解时,可得到与毒剂结合的三肽YTK。Read等[32]通过染毒动物实验发现,不同于梭曼-BuChE加合物,梭曼-白蛋白加合物不会发生老化,且不受重活化药物HI-6的影响。
Bao等[33]建立了血浆中神经性毒剂-白蛋白加合物的液相色谱-同位素稀释串联质谱定量检测方法。样品处理方法为亲和柱提取血浆中的白蛋白,再经链霉蛋白酶酶解消化,最后通过固相萃取净化、富集目标物。该方法对于梭曼加合物的线性范围可达0.5~1000 ng/mL。将此方法应用于沙林、梭曼、维埃克斯3种神经性毒剂染毒大鼠,测定出不同染毒剂量下动物血液中酪氨酸加合物的浓度。
随着仪器分析技术方法的快速发展,色谱(GC、LC)及其质谱联用技术由于具有高选择性、高灵敏度和可进行化合物确证等优点已成为OPCW核查缔约国是否履约的有力工具。通常由于中毒的生物样品都是在几天或是数周之后才能得到,且大多数神经性毒剂的半数致死量低,因此建立的溯源性检测方法必须具有较高灵敏度和专属性。近年来,神经性毒剂与大分子加合物以其在灵敏度、溯源性、专属性等方面的优势已成为生物标志物的研究热点,并且建立针对梭曼及其代谢产物以及梭曼中毒酶、老化酶的定量分析方法,也将为梭曼中毒后体内代谢过程及组织分布等毒理机制的研究,探索重活化剂作用机制以及开发新的解毒药物提供重要的研究手段。
[1]Sussman JL,Harel M,Frolow F,et al.Atomic structure of acetylcholinesterase f rom Torpedo californica:a prototypic acetylcholine-binding protein[J].Science,1991,253(5022):872-879.
[2]Mi leson BE,Chmabers JE,Chen WL,et al.Common mechanism of toxicity:a case study of organophosphours pesticides[J].Toxicol Sci,1998,41(1):8-20.
[3]吴加金.梭曼等毒剂中毒酶老化速度的分子轨道理论分析[J].军事医学科学院院刊,1982,1:71-78.
[4]RadićZ,Gibney G,Kawamoto S,et al.Expression of recombinant acetylchol inesterase in a baculovirus system:kinetic proper ties of glutamate 199 mutants[J].Biochemist ry,1992,31(40):9760-9767.
[5]罗春元.胆碱酯酶结构与功能及磷酰化酶重活化机理[J].生物化学与生物物理进展,1996,23(4):329-333.
[6]Wi lson IB.Molecular complementarity and antidotes for alkylphosphate poisoning[J].Fed Porc,1959,18(2,Par t 1):752-758.
[7]Hagedorn I,Stark I,Schoene K,et al.Reactivation of phosphorylated acetylchol inesterase isomeric bisquaternary sal ts of pyridine aldoximes[J].Arzneimit tel forschung,1978,28(11):2055-2057.
[8]JovanovićD.The ef fect of bis-pyridinium oximes on neuromuscular blockade induced by highly toxic organophosphates in rat[J].Arch Int Pharmacodyn Ther,1983,262(2):231-241.
[9]Kepner LA,Wol thuis OL.A comparison of the oximes HS-6 and HI-6 in the therapy of soman intoxication in rodents[J].Eur J Pharmacol,1978,48(4):377-382.
[10]Hauser W,Weger N.Therapeutic ef fects of the bis-pyridinium sal ts HGG-12,HGG-42,and at ropine,benzctzyine in organophosphate poisoning of dogs[J].Arch Toxicol Suppl,1979,2:393-396.
[11]Clement JG,Hansen AS,Bouler CA.Ef ficacy of Hlö-7 and Pyrimidoxime as antidotes of nerve agent poisoning in mice[J].Arch Toxicol,1992,66(3):216-219.
[12]卜志洁.新型叔胺型重活化剂的研制及其意义[J].解放军医学情报,1994,8(15):258.
[13]冯翠玲,谢剑炜.染毒血浆中五种神经性毒剂的气相色谱法分析[J].色谱,2005,23(1):108.
[14]McGuire JM,Byers CE,Hulet SW,et al.A rapid and sensitive technique for assessing exposure to VX via GC-MS-MS analysis[J].J Anal Toxicol,2008,32(1):63-67.
[15]Black RM,Muir B.Derivatisation reactions in the chromatographic analysis of chemical warfare agents and their degradation products [J].J Chromatogr A,2003,1000(1-2):253-281.
[16]Driskel l WJ,Shih M,Needham LL,et al.Quantitation of organophosphorus nerve agent metabol ites in human urine using isotope dilution gas chromatography-tandem mass spect rometry [J].J Anal Toxicol,2002,26(1):6-10.
[17]Rautio M.Recommended operating procedures for sampl ing and analysis in the veri fication of chemical disarmament[M].The Minist ry for Foreign Af fairs of Finland:Helsinki,1994.
[18]Wang QQ,Xie JW,Gu MS,et al.Gas chromatographic-mass spect romet ric method for quantitation of trimethylsi lyl derivatives of nerve agent degradation products in human plasma,using strong anion-exchange solid-phase ext raction [J].Chromatographia,2005,62(3-4):167-173.
[19]Pal it M,Gupta AK,Jain R,et al.Determination of pentaf luorobenzyl derivatives of phosphonic and phosphonothioic acids by gas chromatography-mass spect romet ry[J].J Chromatogr A,2004,1043(2):275-284.
[20]Riches J,Mor ton I,Read RW,et al.The t race analysis of alkyl alkylphosphonic acids in urine using gas chromatography-ion t rap negative ion tandem mass spect rometry[J].J Chromatogr B,2005,816(1-2):251-258.
[21]Read RW,Black RM.Rapid screening procedures for the hydrolysis products of chemical warfare agents using positive and negative ion l iquid chromatography mass spect romet ry with atmospheric pressure chemical ionization[J]. J Chromatogr A,1999,862(2):169-177.
[22]Creasy WR.Postcolumn derivatization l iquid chromatography/mass spectrometry for detection of chemical-weapons-related compounds[J].J Am Soc Mass Spectrom,1999,10(5):440-447.
[23]D'Agostino PA,Chenier CL,Hancock JR.Packed capi l lary l iquid chromatography-elect rospray mass spect romet ry of snow contaminated with sarin[J].J Chromatogr A,2002,950(1-2):149-156.
[24]Katagi M,Tatsuno M,Nishikawa M,et al.On-line sol id-phase ext raction liquid chromatography-continuous f low f rit fast atom bombardment mass spect rometric and tandem mass spectromet ric determination of hydrolysis products of nerve agents alkyl methylphosphonic acids by p-bromophenacyl derivatization[J].J Chromatogr A,1999,833(2):169-179.
[25]Van Der Schans MJ,Polhui js M,Van Di jk C,et al.Ret rospective detection of exposure to nerve agents:analysis of phosphof luoridates originating f rom f luoride-induced reactivation of phosphylated BuChE[J].Arch Toxicol,2004,78(9):508-524.
[26]Fidder A,Hulst AG,Noor t D,et al.Retrospective detection of exposure to organophosphorus anti-cholinesterases:mass spect romet ric analysis of phosphylated human butyrylchol inesterase[J].Chem Res Toxicol,2002,15(4):582-590.
[27]Tsuge K,Seto Y.Detection of human butyrylchol inesterase-nerve gas adducts by l iquid chromatography–mass spect romet ric analysis af ter in gel chymot ryptic digestion[J].J Chromatogr B,2006,838(1):21-30.
[28]Elhanany E,Ordent lich A,Dgany O,et al.Resolving pathways of interaction of covalent inhibitors with the active site of acetylcholinesterases:MALDI-TOF/MS analysis of various nerve agent phosphyl adducts[J].Chem Res Toxicol,2001,14(7):912-918.
[29]白海红,郭磊,冯建林,等.氟离子重活化-气相色谱质谱法检测染毒人血清中的神经性毒剂沙林[J].分析化学,2008,36(9):1269-1272.
[30]Wi l l iams NH,Har rison JM,Read RW,et al.Phosphylated tyrosine in albumin as a biomarker of exposure to organophosphorus nerve agents [J].Arch Toxicol,2007,81(9):627-639.
[31]Li B,Schopfer LM,Hinrichs SH,et al.Matrix-assisted laser desorption/ionization time-of-f light mass spect romet ry assay for organophosphorus toxicants bound to human albumin at Tyr411[J].Anal Biochem,2007,361(2):263-272.
[32]Read RW,Riches JR,Stevens JA,et al.Biomarkers of organophosphorus nerve agent exposure:comparison of phosphylated butyrylchol inesterase and phosphylated albumin af ter oxime therapy[J]. Arch Toxicol,2010,84(1):25-36.
[33]Bao Y,Liu Q,Chen J,et al.Quantification of nerve agent adducts with albumin in rat plasma using liquid chromatography–isotope dilution tandem mass spectrometry[J].J Chromatogr A,2012,1229:164-171.
全军医学科技“十二五”重大项目(AWS11C004-1)
100850北京,军事医学科学院六所(闫珑,谢剑炜)
谢剑炜,E-mai l:xiejw@bmi.ac.cn
2012-08-28)

