马尾松花粉中植物甾醇成分分析
孙阳恩,钤莉妍,张 含,杨长军,王 桐,石丽花,耿 越*
1山东师范大学生命科学学院,济南 250014;2烟台新时代健康产业有限公司,烟台 264006
松花粉药名松黄,是松科植物马尾松、油松或同属种植物的干燥花粉,是传统的食药兼用的花粉品种,具有抗衰老、调节免疫功能、抗疲劳、降血糖、美容、减肥等多种药理作用[1]。植物甾醇作为一种天然成分因为其具有降低人体血清胆固醇从而预防心脑血管疾病的作用,而受到广泛的关注[2,3]。在欧洲早已有相关的产品畅销,例如知名的Bencol®[4]。国内在2010年植物甾醇获得新资源食品批准之后(中华人民共和国卫生部.关于批准DHA藻油、棉籽低聚糖等7种物品为新资源食品及其他相关规定的公告.2010年第3号),也有植物甾醇玉米油等产品上市,市场潜力巨大,开发前景广阔。但关于花粉中植物甾醇的报道为数不多[5-8],马尾松花粉中植物甾醇的种类目前尚未有详细报道。
1 材料与方法
1.1 材料与试剂
胆固醇(纯度99%)(美国Sigma公司);Sylon BFT(BSTFA+TMCS,99∶1)(美国 Sigma 公司);吡啶(色谱纯)(天津科密欧公司);正己烷、醋酐、浓硫酸、冰醋酸(分析纯)(国药集团)。
1.2 仪器与设备
6890-5973气相色谱-质谱联用仪(美国Agilent公司);TU-1810 PC紫外可见分光光度计(北京普析通用公司);5804R台式高速冷冻离心机(德国Eppendorf公司)。
1.3 实验方法
1.3.1 松花粉中粗甾醇的提取
称取10 g破壁马尾松花粉,加150 mL正己烷超声浸提30 min,离心。上清液40℃旋蒸浓缩至剩余2 mL左右,氮气吹干,得蒸发残渣。加50 mL无水乙醇,10 mL KOH溶液(500 g/L),沸水浴冷凝回流30 min。反应完之后,立即流水冷却至室温。将样品转移至500 mL分液漏斗中,用20 mL去离子水冲洗锥形瓶,洗液并入分液漏斗,然后分别用100、100和60 mL石油醚萃取3次,合并3次有机相。用蒸馏水洗至中性。萃取液经无水硫酸钠脱水,旋蒸浓缩至2 mL,氮气吹干,得不皂化物。冰醋酸溶解定容至10 mL。
1.3.2 显色液配制
将醋酐和浓硫酸预先在冰箱中冷藏,取干燥的烧杯,置于冰水浴中。加入60 mL醋酐,30 mL冰醋酸,10 mL浓硫酸,混合均匀。然后加入2 mg无水硫酸钠,4 ℃保存备用[9]。
1.3.3 L-B比色法测定波长的选择
取5 mL显色液于干燥洁净的试管中,加入200 μL样品溶液,于23℃水浴中显色后在190~900 nm波长范围内进行扫描。
1.3.4 L-B比色法反应时间的选择
取5 mL显色液加入洁净干燥的试管中,加200 μL样品溶液,振荡混匀,转移至比色皿中,在室温(23℃)下进行时间-吸光值曲线扫描。
1.3.5 胆固醇标准溶液曲线制作
准确称取胆固醇标准品,通过逐级稀释的方法配成标准系列液。溶剂为冰醋酸,浓度分别为0.1、0.5、1.0、1.5、2.0、2.5 mg/mL,分别测定吸光值,绘制标准曲线。
1.3.6 GC-MS定性分析
植物甾醇衍生化:取10 mg干燥的不皂化物于玻璃反应瓶中,加入200 μL 吡啶和Sylon BFT(1∶1),溶解样品,振荡混匀,封口后置于70℃水浴中反应30 min。
色谱柱:Agilent HP-5石英毛细管柱(30 m ×0.25 mm,0.5 μm);升温程序:200 ℃保持 5 min,以2℃/min升至230℃,保持10 min,再以1℃/min升至240℃,保持10 min,2℃/min升至250℃,保持20 min,2℃/min升至300℃,保持15 min;载气为氦气,流速1.0 mL/min,恒流模式;进样量1 μL;分流比:1∶50;进样口温度为280℃;电子轰击(EI)离子源,电子能量70 eV;传输线温度290℃;离子源温度230℃;EM电压1447.1 V;质量扫描范围m/z 29~800;溶剂延迟6 min。
2 结果与分析
以浓硫酸-醋酐为显色剂,植物甾醇会产生红→紫→蓝→绿→污绿等颜色变化,最后褪色。因此可以通过测定反应产物的吸光度对甾醇总含量进行定量分析。但L-B比色法的具体实验条件却不尽相同,包括反应温度,反应时间,酸试剂与样品的比例等。实验参照改进的L-B比色法[9],利用可见分光光度法以胆固醇为标准品绘制标准曲线,对马尾松花粉植物甾醇粗提物中的总甾醇含量进行测定。
植物甾醇显色后光谱扫描结果显示,在280 nm和620 nm处有两个较强吸收峰,与梁博等人的光谱扫描结果相一致[10]。因此实验选用可见光区的620 nm为L-B比色法测定马尾松花粉中植物甾醇含量的检测波长。
植物甾醇显色过程中吸光值在0~12 min内迅速上升,16~32 min内在最大吸光值附近保持稳定,之后缓慢下降。吸光值可以在较长时间内保持相对稳定,反应温和,因此实验选择在23℃水浴中反应20 min后进行测定,比色测定操作时间充足。
最后确定L-B比色法实验条件为:以醋酐∶冰醋酸∶浓硫酸(6∶3∶1)为显色剂,采用冰醋酸溶解样品,取200 μL样品溶液加入到5 mL显色液中,23℃水浴反应20 min后测定吸光值。以吸光值为纵坐标,胆固醇浓度为横坐标绘制标准曲线。标准曲线方程为:Y=0.17224x+0.00012,R2=0.99992,线性关系良好。测得马尾松花粉中总甾醇含量为1.680 mg/g。


马尾松花粉中植物甾醇TMS衍生物总离子流色谱图见图1。对比NIST08质谱库,以及相关研究中植物甾醇TMS衍生物的离子碎片数据[11-13],发现8种可鉴别的甾醇成分。峰1鉴定为Δ5-菜油甾醇;峰2为豆甾醇;峰3与峰1(Δ5-菜油甾醇)相比,m/z M-129和m/z 129碎片离子丰度较低,鉴定为Δ7-菜油甾醇[14];峰4 为 β-谷甾醇;峰5 鉴定为 Δ5-燕麦甾醇,峰5之前与之相邻的杂质峰为三十烷醇。峰6与干扰杂质分离度较差,与质谱库的匹配度不高,结合文献初步鉴定为禾本甾醇(质谱图见图2)[15];峰7质谱图中的m/z 69基峰,充分说明了C24上有双键存在[14],鉴定为环阿屯醇;峰8鉴定为24-亚甲基环木菠萝烷醇,结果见表1和图3。

表1 马尾松花粉中植物甾醇GC-MS分析鉴定组分表Table 1 The identified phytosterol compositions of P.massoniana pollen
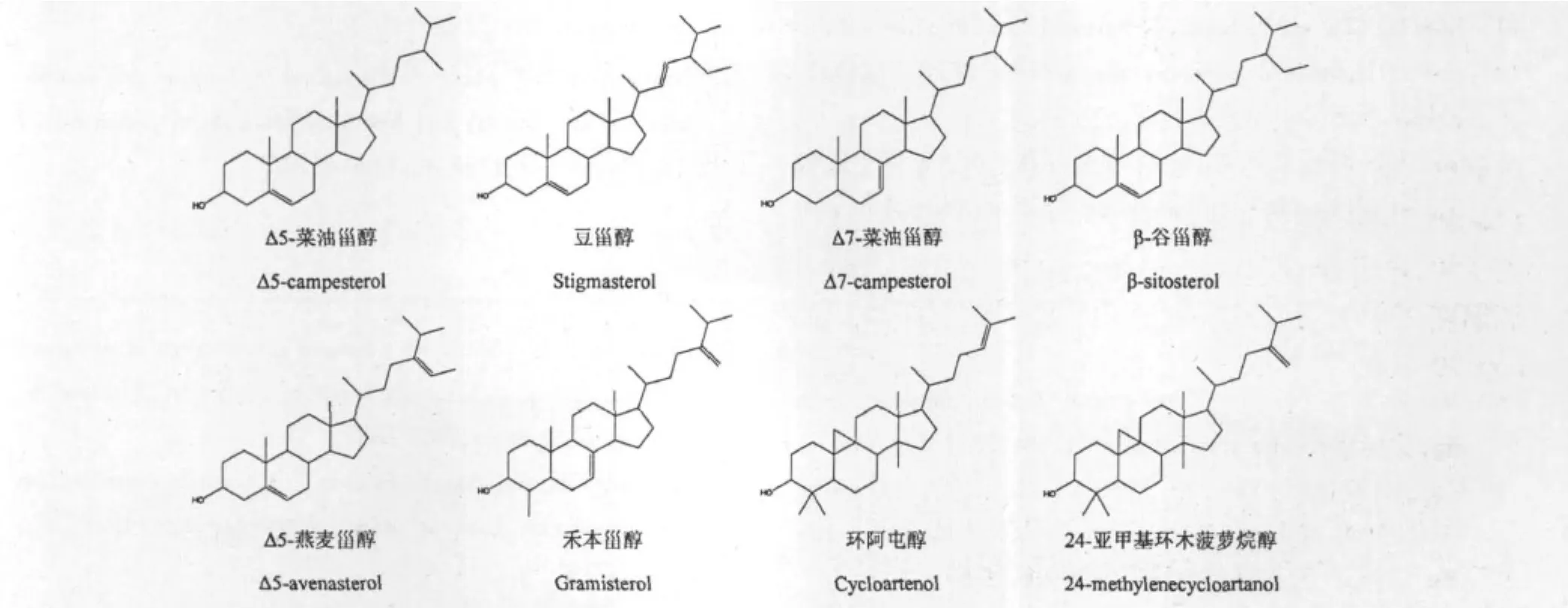
图3 马尾松花粉中植物甾醇结构式Fig.3 Chemical structures of phytosterols in P.massoniana pollen
3 结论
为准确分析马尾松花粉不皂化物中植物甾醇组成,实验直接对不皂化物衍生化,并进样分析,但马尾松花粉不皂化物中高级烷醇等干扰杂质较多,气相分析中个别甾醇与杂质峰重叠,难以进一步分离,给甾醇的定量分析带来困难,因此实验采用改进的L-B比色法,以胆固醇为标准品绘制标准曲线对马尾松花粉中植物甾醇总含量进行定量分析,快速、经济、简便,测得破壁马尾松花粉中总甾醇含量为1.680 mg/g。实验探索建立了适合于马尾松花粉中植物甾醇总含量快速检测的L-B比色法实验条件,且并通过GC-MS分析鉴定出8种植物甾醇成分,其中以β-谷甾醇含量最多,Δ7-菜油甾醇、Δ5-燕麦甾醇、禾本甾醇、环阿屯醇、24-亚甲基环木菠萝烷醇皆为在马尾松花粉中首次检出。
1 Wang M(王敏).Research advances on pharmacological effect of Pinus massoniana pollen.Anhui Med Pharm J(安徽医药),2008,12:357-359.
2 Hicks KB,Moreau RA.Phytosterols and phytostanols:functional food cholesterol busters.Food Technol,2001,55:63-67.
3 Jones PJ,MacDougall DE,Ntanios F,et al.Dietary phytosterols as cholesterol-lowering agents in humans.Can J Physiol Pharm,1997,75:217-227.
4 Kate W.Configuring users of cholesterol lowering foods:A review of biomedical discourse.Soc Sci Med,2010,71:1541-1547.
5 Gao AX(高爱新),Wang ZL(王舟莲),Wang JW(王敬文),et al.Research on the extraction of phytosterol in pine pollen by supercritical CO2extraction technology.Food Sci Technol(食品科技),2010,35:208-210.
6 Zhang HC(张红城),Dong J(董捷),Ren XN(任向楠),et al.GC-MS analysis of phytosterol from four kinds of bee pollen.Food Sci(食品科学),2008,29:522-524.
7 Miyake S.Chemical studies of corn pollen.J Biochem,1922,2:27-32.
8 Svoboda JA,Herbert EW,Lusby WR,et al.Comparison of sterols of pollens,honeybee workers,and prepupae from field sites.Arch Insect Biochem,1983,1:25-31.
9 Huang TC,Chen CP,Wefler V,et al.A stable reagent for the Liebermann-Burchard reaction.Application to rapid serum cholesterol determination.Anal Chem,1961,33:1405-1407.
10 Liang B(梁博),Guo XH(郭璇华).Spectrophotometry determination of phytosterol content of stems of pitaya.Chin J Anal Lab(分析试验室),2008,27:279-281.
11 Li TSC,Beveridge THJ,Drover JCG.Phytosterol content of sea buckthorn(Hippophae rhamnoides L.)seed oil:Extraction and identification.Food Chem,2007,101:1633-1639.
12 Kamal Eldin A,Appelqvist L,Yousif G,et al.Seed lipids of Sesamum indicum and related wild species in Sudan.The sterols.J Sci Food Agr,1992,59:327-334.
13 Beveridge THJ,Li TSC,Drover JCG.Phytosterol content in American ginseng seed oil.J Agr Food Chem,2002,50:744-750.
14 Miu M(缪妙),Xu JL(徐继林),Yan XJ(严小军),et al.Study of the regular pattern of mass spectrometry of TMS derivatives of sterols.J Instrum Anal(分析测试学报),2008,27:59-62.
15 Van Boven M,Daenens P,Maes K,et al.Content and composition of free sterols and free fatty alcohols in jojoba oil.J Agr Food Chem,1997,45:1180-1184.

