Satb2和Cbfα1基因在人牙龈成纤维细胞中的表达
吕春旭,陈晓霞,张 瑾,孙钦峰
(山东大学口腔医院牙周科,山东省口腔生物医学重点实验室,山东济南250012)
牙周病是一种慢性感染性疾病,是成年人牙齿丧失的首要原因[1]。牙周治疗的最终目的是实现牙周组织的完全功能性再生,但传统的治疗方法和引导组织再生技术尚不能完全达到该目的。随着组织工程学理论和技术的发展,牙周组织工程的研究也在不断深入,目前其研究热点主要集中在寻找高效的生长因子、理想的种子细胞和具有良好生物相容性的支架材料上[2]。特殊富含AT序列结合蛋白(special AT-rich sequence binding protein,SATB)-2是一种核基质蛋白,在颅面部的发育和成骨细胞的分化中起关键性作用,可通过招募其他转录因子,直接或间接地调控主要骨基因的表达[3-4]。最近研究发现,Satb2 在牙胚中也有表达[5],提示Satb2在牙及牙周组织发育中起着一定作用。核心结合因子 α1(core binding factor α1,CBFα1)是成骨特异性转录因子和成骨细胞分化的关键因子,Cbfα1-/-基因敲除小鼠表现为完全的骨组织丧失和牙胚发育阻滞[6],表明Cbfα1对于骨诱导及牙周组织的发育是必不可少的。人牙龈成纤维细胞(human gingival fibroblast cells,HGFs)具有取材方便、容易培养的特点,并且在某些因子的诱导下表现出成骨特性[7-8],使得 HGFs有望成为牙周组织工程的种子细胞。而Satb2和Cbfα1基因在HGFs中的表达情况目前尚未有报道。本研究通过组织块法培养HGFs,采用 RT-PCR和Western blot方法研究 HGFs中 hSatb2、hCbfα1 的表达,为进一步研究Satb2和Cbfα1基因在牙周组织再生中的作用奠定基础。
1 材料和方法
1.1 主要试剂和仪器
α-MEM、DMEM 培养液(Hyclone,美国);胰蛋白酶(Sigma,美国 );青霉素、链霉素(penicillium,streptomycine);胎牛血清、四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)(Gibco,美国);TRIZOL(invitrogen公司);PrimeScript® RT reagent Kit With gDNA Eraser(宝生物有限公司);2×Power Taq PCR MasterMix(百泰克生物技术有限公司);BCA蛋白检测试剂盒(凯基生物有限公司);蛋白质相对分子量Marker、6×SDS上样缓冲液(fermentas,美国);PVDF膜 (millipore,美国);HERA cell恒温CO2细胞培养箱(Heraeus公司,德国);Multiskan MK3型酶标仪(Thermo Labsystems公司,芬兰);IXZ-ILL100型倒置相差显微镜(OLMPUS公司,日本);TGL-16G型高速台式离心机(上海安亭科学仪器厂);Gene Quant pro紫外/可见光分光光度仪(Biochrom,美国);梯度PCR仪(Biometra,德国);Biofuge Stratos台式冷冻高速离心机(Heraeus公司,德国);蛋白垂直平板型电泳槽、电泳仪、水平电泳槽、PAC-300型电泳仪(BIO-RAD科技公司)。
1.2 方法
1.2.1 人牙龈成纤维细胞(HGFs)原代培养和传代
收集18~30岁患者因手术而切除的健康牙龈组织,用含50 g/L青链霉素的PBS反复冲洗后,剪除上皮层,将余留的结缔组织剪成1 mm×1 mm×1 mm组织块,铺于培养瓶底,在50 mL/L CO2、37℃ 标准环境下倒置培养2 h后,翻转培养瓶继续培养并观察细胞游出情况。当细胞从组织块边缘爬出并长满瓶底80% ~90%时,胰蛋白酶2.5 g/L+1 g/L EDTA消化传代,取3~6代细胞用于后续试验。
1.2.2 HGFs形态学观察
取生长良好的第4代HGFs胰蛋白酶消化后,以2×105的细胞密度接种于预置有无菌盖玻片的培养皿(36 mm×36 mm)中,标准环境下进行培养。待细胞生长成单层时,取出盖玻片,PBS反复浸洗,950 mL/L乙醇固定,苏木精染色5 min;自来水浸洗,稀盐酸乙醇液分色(数秒即可);自来水再浸洗,用淡氨水使细胞核蓝化3 min;自来水浸洗,伊红染液5 min;自来水浸洗,依次浸入梯度乙醇各1 min;二甲苯透明3次,每次1 min,树胶封片,镜下观察细胞形态。
1.2.3 MTT法检测细胞生长情况
取生长良好的第4代HGFs,以5×103/孔的细胞密度接种于96孔板,同时每孔加入200 μL DMEM培养液标准环境下进行培养。分别于细胞贴壁生长后1、2、3、4、5、6、7 d 各取出一组细胞,每孔加MTT液(5 mg/mL)20 μL,继续4 h后终止培养,吸尽培养液,每孔加 150 μL DMSO,震荡10 min,使结晶物充分溶解后,在酶标仪上测各孔492 nm波长吸光值(OD),并绘制细胞生长曲线。
1.2.4 RT-PCR 检测 HGFs中 hSatb2 和 hCbfα1 mRNA的表达
采用Trizol法提取细胞总RNA。按照takara公司PrimeScript® RT reagent Kit with gDNA Eraser逆转录试剂盒将总RNA逆转录成cDNA。以GAPDH为内参照,根据Genebank中hCbfα1和hSatb2的基因序列,采用primer premier 5.0计算机软件设计引物,并由上海博尚生物公司合成(表1)。RT-PCR反应条件参照2×EasyTaq PCR SuperMix试剂盒(全式金生物公司)说明书。反应结束后,配制20 g/L琼脂糖凝胶,将PCR产物加入上样孔中(此PCR产物含有染料,不用额外加Loading buffer),同时在旁边的孔中加入DNA Marker,然后在100 V电压下进行电泳。当指示剂迁移至凝胶的2/3时,终止电泳,凝胶成像系统上观察电泳结果并拍照。
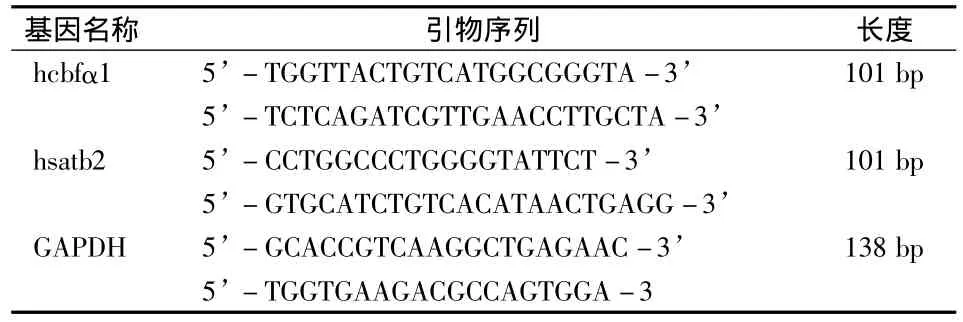
表1 引物序列和长度
1.2.5 Western blot检测 HGFs中 hSatb2 和hCbfα1 蛋白表达
采用Trizol法提取细胞蛋白,按照BCA蛋白测定试剂盒说明检测蛋白浓度后,SDS-PAGE电泳、转膜、封闭、免疫反应,最后进行化学发光反应,分析hSatb2和hCbfα1蛋白的表达情况。
2 结果
2.1 HGFs的分离、培养及形态学观察
采用组织块法培养HGFs,共培养10瓶,其中有7瓶在一周左右可见少量细胞从组织块边缘爬出,成功率为70%。生长出来的细胞呈贴壁生长,起初形态不规则多呈短梭型,也可见多边形,菱形,细胞核呈圆形、椭圆形,位于胞体中央,核仁清晰,有1~4个。随着传代培养,细胞排列呈束状、平行状或杂乱无章,形态变成细长梭形,并有2~4个胞浆突。传6代后细胞形态保持良好,与原代细胞相比形态更规则。HE染色可见细胞胞浆呈粉红色,胞核呈蓝色(图1~3)。

图1 HGFs原代细胞(×100)
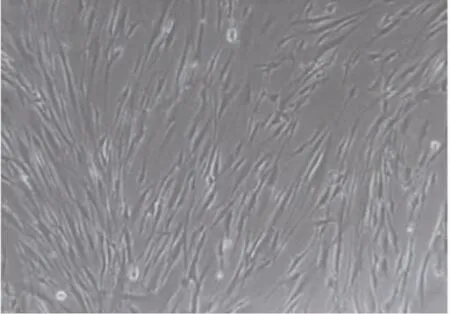
图2 第6代HGFs细胞(×100)

图3 HE染色(×100)
2.2 细胞生长曲线
细胞生长曲线呈不规则的S型,开始前2 d细胞增殖缓慢,从第3天开始细胞增殖加快,到第5天细胞生长速度又变平缓(图4)。
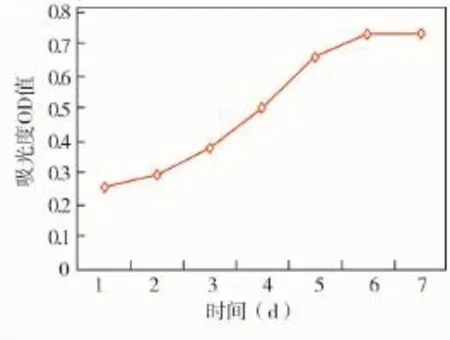
图4 HGFs增殖情况
2.3 细胞hSatb2和hCbfα1 mRNA表达
RT-PCR 检测发现,hSatb2和 hCbfα1 mRNA在HGFs中均呈阳性表达(图5)。

图5 HGFs中 hsatb2、hcbfα1 mRNA 表达
2.4 细胞hSatb2和hCbfα1蛋白的表达
Western blot检测发现,HGFs中有hSatb2蛋白表达,但未发现hCbfα1蛋白的表达(图6)。
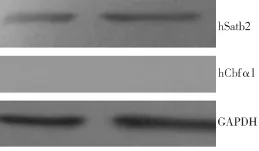
图6 HGFs中hSatb2和hCbfα1蛋白表达
3 讨论
HGFs来源于中胚层,是牙龈结缔组织中的主要细胞类型,也是牙周组织中最丰富的细胞,具有活跃的自我更新能力,在牙周组织的形成、再生、保护、修复、维持完整性和功能的实施中起重要的作用[9],本实验采用原代组织块法体外培养了HGFs,通过MTT法观察细胞的生长曲线,发现细胞在前2 d增殖比较缓慢,从第3天开始增殖加快,一直到第6天才减慢下来,细胞生长曲线近似“S”型。HGFs的体外培养由于来源丰富、取材方便、创伤小且体外培养成活率高,因此HGFs的体外培养将有助于进行牙周组织再生工程的研究。
Satb2和Cbfα1作为成骨细胞分化和骨形成的重要调控因子,对骨的发育起重要作用。目前关于Satb2在牙周组织中表达情况的研究尚少,张瑾等[5]采用原位杂交的方法检测了胚胎14.5 d时野生小鼠头部Satb2的表达情况,发现Satb2在切牙牙胚的间充质中高表达,在上皮成分中不表达,同时在发育的颚骨和下颌骨基质中也有高水平表达,说明Satb2可能在颌骨和牙周组织发育过程中起重要作用。Cbfα1在牙囊和牙乳头中也都有表达而且随着牙齿的进一步发育和牙根、牙周组织的形成,Cbfα1 的表达更为明显[10],这说明 Cbfα1 可能参与牙周组织的发育。
本实验采用RT-PCR及Western Blot方法分别检测了Satb2和Cbfα1在HGFs中的表达情况,结果显示,Satb2和Cbfα1在mRNA水平上都有表达,只是Cbfα1 mRNA的表达较Satb2弱;而在蛋白水平上,只检测到了Satb2蛋白的表达。提示Satb2和Cbfα1可能在HGFs的骨向分化上作用程度不同,进一步研究Satb2和Cbfα1对HGFs生物学特性的影响,将有利于我们为牙周组织工程寻找更佳的生长因子和种子细胞。
[1]曹采方.牙周病学[M].2版.北京:人民卫生出版社,2003:83-84.
[2]尹晓华,周潞,李杨.牙周组织工程研究进展[J].中国修复重建外科杂志,2007,21(2):165-170.
[3]Britanova O,Akopov S,Lukyanov S,et al.Novel transcription factor Satb2 interacts with matrix attachment region DNA elements in a tissue-specific manner and demonstrates cell-type-dependent expression in the developing mouse CNS[J].Eur J Neurosci,2005,21(3):658-668.
[4]Dobreva G,Dambacher J,Grosschedl R.SUMO modification of a novel MAR-binding protein,SATB2,modulates immunoglobulin mu gene expression.[J].Genes Dev,2003,17(24):3048-3061.
[5]张谨,杨丕山,陈锦坤.转录因子Satb2和Runx2在牙囊细胞和骨髓基质细胞分化过程中的调控功能及其在骨与牙周创伤修复过程中的作用研究[D].济南:山东大学博士学位论文,2008.
[6]Komori T,Yagi H,Nomura S,et al.Targeted disruption of Cbfα1 results in a complete lack of bone formation owing to maturational arrest of osteoblasts[J].Cell,1997,89(5):755 -764.
[7]Zhang Q,Shi S,Liu Y,et al.Mesenchymal stem cells derived from human gingival are capable of immunomodulatory functions and ameliorate inflammation-related tissue destruction in experimental colitis[J].J Immunol,2010,183:7787 -7798.
[8]Tomar GB,Srivastava RK,Gupta N,et al.Human gingival-derived mesenehymal stem cells are superior to bone marrow-derived mesenehymal stem cells for cell therapy in regenerative medicine[J].Biochem BioDhys Res Commun,2010,393(3):377-383.
[9]Kikuno R,Nagase T,Ishikawa K,et al.Prediction of the coding sequences of unidentified human genes.XIV.The complete sequences of 100 new cDNA clones from brain which code for large proteins in vitro[J].DNA Res,1999,6(3):197 -205.
[10]Javed A,Guo B,Hiebert S,et al.Groucho/TLE/R-esp proteins associate with the nuclear matrix and repress RUNX(CBFα/AML/PEBP2α)dependent activation of tissue-specific gene transcription[J].J Cell Sci,2000,113(12):2221 -2231.

