HPD-700型大孔树脂对野生越橘花色苷分离的研究
吕春茂,包 静,孟宪军,董文轩*,王新现
(1.沈阳农业大学园艺学院,辽宁 沈阳 110866;2.沈阳农业大学食品学院,辽宁 沈阳 110866)
HPD-700型大孔树脂对野生越橘花色苷分离的研究
吕春茂1,2,包 静2,孟宪军2,董文轩1,*,王新现2
(1.沈阳农业大学园艺学院,辽宁 沈阳 110866;2.沈阳农业大学食品学院,辽宁 沈阳 110866)
采用柱层析法对野生越橘花色苷分离纯化进行研究。结果表明:HPD-700型大孔树脂对野生越橘花色苷的分离效果最佳,其适宜的分离条件为样品液pH2.0、花色苷质量浓度0.75mg/mL、最大上样量22BV、上样流速0.5mL/min,样品洗脱最佳乙醇体积分数60%、以流速1.5mL/min速度洗脱时、洗脱液量5BV为洗脱终点。该工艺生产的花色苷产品为紫黑色粉末,色价为62.40,回收率为86.20%。
野生越橘;HPD-700大孔树脂;花色苷;吸附;解吸
越橘为杜鹃花科(Ericaceae)越橘属(Vaccinium)植物,是多年生落叶或常绿小灌木树种[1],小型浆果,成熟果实蓝紫色或蓝黑色,又名蓝浆果,果肉淡绿色,半透明,皮薄,有独特的果香味[2]。越橘果实含有丰富的花色苷色素,花色苷类物质对人体健康非常有益,具有多种生物活性,如抗氧化及清除自由基、抗突变活性、抗炎症及抗病毒作用[3]、增强关节和软组织功能[4]、延缓脑神经衰老[5],增强心脏功能和抗癌的独特功效[6],被联合国粮农组织列为人类五大健康食品之一[7]。国内外对蓝莓花色苷的研究主要集中在其生理功能方面,而对野生越橘花色苷纯化方面研究较少[8]。由于越橘果实醇溶性花色苷提取物中含有胶质、淀粉、糖类、蛋白质、脂肪、有机酸碱、无机盐、重金属离子等,严重影响花色苷的应用范围,因此花色苷的纯化精制是天然花色苷生产加工的一个重要环节。
在花色苷分离纯化方面主要有层析法(包括纸层析、薄层层析、柱层析)、毛细管电泳、高效液相色谱等方法。目前国内花色苷类色素的纯化主要采用大孔树脂柱层析法,大孔吸附树脂是近10年发展起来的一类有机高分子聚合物吸附剂[9]。大孔树脂吸附纯化法以效率高、质量稳定、成本低且操作简单易行等特点而成为当前分离纯化天然产物的主要方法[10-11],已广泛应用于天然色素的分离纯化中[12]。本实验采用柱层析的方法对野生越橘花色苷分离进行研究,筛选出适于越橘果中花色苷分离纯化的树脂类型,并对其吸附和解吸性能进行研究,以期为野生越橘花色苷在食品、药品领域的开发利用提供一定的理论依据,为工业化生产花色苷提供参考。
1 材料与方法
1.1 材料与仪器
野生笃斯越橘(Vaccinium unliginosumL.),采自长白山,冰袋冷藏运输,-2 0℃冷冻贮藏。
无水乙醇、盐酸、氢氧化钠、柠檬酸、柠檬酸钠:均为分析纯试剂;AB-8、X-5型大孔树脂 天津南开大学化工厂产品;D101、HPD-100、HPD-400、HPD-600、HPD-700型大孔树脂 河北沧州宝恩化工有限公司产品;S-8、NKA-9 上海宝曼生物科技有限公司;WD-6阴离子树脂 安徽皖东化工有限公司。
UV-2100型可见分光光度计 上海尤尼柯仪器有限公司;TU-1810型紫外-可见分光光度计 北京普析通用仪器有限责任公司;JY92-Ⅱ超声波细胞破碎机 宁波新芝生物科技股份有限公司;pHS-25型酸度计 上海日岛科学仪器有限公司;电热恒温水浴锅 常州国华电器有限公司;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂;SHB-IIIA 型循环水真空泵 郑州长城科工贸有限公司;SHA-C恒温振荡器 常州国华电器有限公司;DZF-6050型真空干燥箱 上海精宏仪器设备有限公司;玻璃层析柱(1.6cm×60cm) 上海青浦沪西仪器厂。
1.2 方法
1.2.1 野生越橘花色苷吸收光谱的测定和工作曲线的制作
用pH3.0的柠檬酸-柠檬酸钠缓冲液配制少量花色苷溶液,在400~750nm范围内对其进行波长扫描,得到花色苷的吸收光谱图。准确称取越橘花色苷粉末,用pH3.0的柠檬酸-柠檬酸钠缓冲液定容,根据比耳定律制作花色苷的工作曲线。
1.2.2 野生越橘花色苷粗提物制备
将贮藏于冰箱冷冻室的野生越橘果实用打浆机打成糊状,冷冻过夜后进行真空冷冻干燥,收集干燥后粉末备用。取1g花色苷冻干粉用盐酸体积分数1%、浓度60%的酸性乙醇溶液溶解,经超声波细胞破碎机辅助处理,每次50mL、重复提取3次,收集粗提液后经旋转蒸发得浓缩液,再经真空干燥得野生越橘花色苷粗提物粉末,呈紫黑色。
1.2.3 树脂活化
对选定的树脂进行预处理,先用无水乙醇浸泡24h→蒸馏水洗至中性→5%盐酸浸泡12h→蒸馏水洗至中性→5%氢氧化钠浸泡12h→蒸馏水洗至中性,备用。
1.2.4 最适树脂的筛选
准确称取1.00g野生越橘花色苷粉状粗提物用提取液溶解,然后用pH3的柠檬酸﹣柠檬酸钠缓冲液定容至1000mL,备用。分别称取2.00g树脂于250mL锥形瓶中,然后分别加入50mL已经配制好的野生越橘花色苷溶液,于30℃,110r/min,24h恒温振荡。取上清液在520nm最大吸收波长测量吸光度,按照公式测定各吸附率与解吸率。
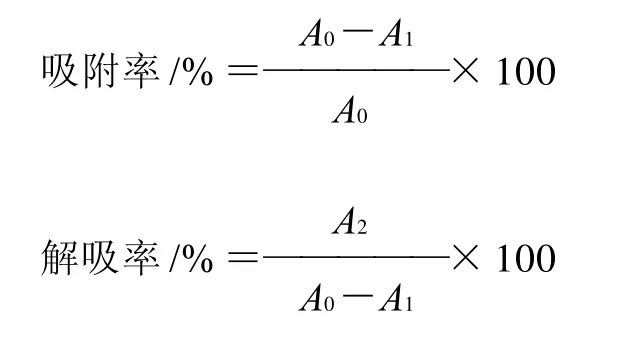
其中:A0为原液的吸光度值;A1为树脂吸附后上清液的吸光度值;A2为吸附饱和的树脂经乙醇解吸后上清液的吸光度值。
通过对不同树脂吸附率和解吸率的测定,筛选出最适树脂。
1.2.5 洗脱剂的选择
分别准确称取已经吸附花色苷饱和的树脂各0.40g,用蒸馏水冲洗一次,分别使用5mL甲醇、乙醇、丙酮、乙酸乙酯解吸花色苷,室温静止解吸12h,间歇摇动。测定解吸液的吸光度A。
1.2.6 不同流速的动态吸附曲线
准确称取10mL预处理过的HPD-700型大孔树脂装柱,配制pH2.0质量浓度1mg/mL的越橘花色苷样液,在室温条件下进行吸附,分别设定0.5、1.0、1.5、2.0mL/min这4个不同的流速,每10mL接一个样。测定不同流速对吸附的影响。
1.2.7 野生越橘花色苷浓度对动态吸附的影响
分别设定2.00、1.00、0.50、0.25mg/mL四个不同花色苷样液质量浓度,调整其pH2,用预处理过的HPD-700大孔树脂装柱,采用1.0mL/min流速,在室温条件下进行吸附,每10mL接一个样。测定不同浓度对吸附的影响。
1.2.8 pH值对动态吸附的影响
准确称取10mL预处理过的HPD-700型大孔树脂装柱,采用1.00mg/mL的样液质量浓度,1.0mL/min流速,在室温条件下进行吸附,分别设定1.0、2.0、3.0、4.0、5.0、6.0六个不同的pH值,每10mL接一个样。测定不同pH值对吸附的影响。
1.2.9 不同洗脱剂流速的动态解吸曲线
准确称取10mL已经吸附饱和的HPD-700型大孔树脂装柱,采用pH2.0体积分数70%乙醇溶液,在室温条件下解吸,分别设定0.5、1.0、1.5、2.0mL/min四个流速,每10mL接一个样。测定不同流速对解吸的影响。
1.2.10 洗脱剂体积分数对动态解吸的影响
准确称取10mL已经吸附饱和的HPD-700型大孔树脂装柱,分别设定30%、40%、50%、60%、70%、80%、90%、100%八个洗脱剂体积分数,调整所有洗脱剂pH2.0,在1.0mL/min流速及室温条件下进行解吸,每10mL接一个样。测定洗脱剂体积分数对解吸的影响。1.2.11 pH值对动态解吸的影响
准确称取10mL已经吸附饱和的HPD-700型大孔树脂装柱,采用体积分数50%乙醇溶液,在1.0mL/min流速及室温条件下进行解吸,分别设定1.0、2.0、3.0、4.0、5.0这5个不同的pH值,每10mL接一个样。测定pH值对解吸的影响。
1.2.12 越橘花色苷回收率和色价的测定
精确称取自制的花色苷产品0.05g,用pH3.0的柠檬酸缓冲液定容至100mL容量瓶中,稀释至一定倍数,在波长520nm处测定其吸光度,计算色价。
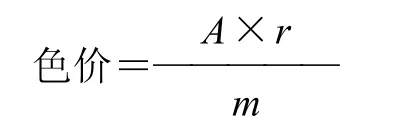
式中:A为吸光度:m为样品的质量/g;r为测定吸光度时所吸取样品的稀释倍数[13]。

2 结果与分析
2.1 野生越橘花色苷吸收光谱
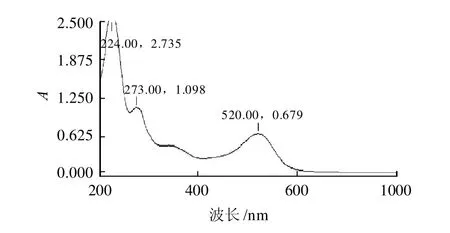
图1 越橘果实花色苷色素缓冲液pH3.0全波长扫描图Fig.1 Ultraviolet spectrum of bilberry extraction solution at pH 3.0
由图1可知,越橘花色苷在pH3.0柠檬酸-柠檬酸钠缓冲液中,在520nm处有一最大吸收峰,该吸收峰
是花色苷的特征峰465~560nm[15]。由图2可知,在pH3.0的柠檬酸-柠檬酸钠缓冲液中吸光度与花色苷质量浓度成线性关系,标准曲线方程:A=0.4311C+0.0019,R2=0.9972,式中,A为吸光度,C为花色苷质量浓度/(mg/mL)。
2.2 大孔树脂的筛选
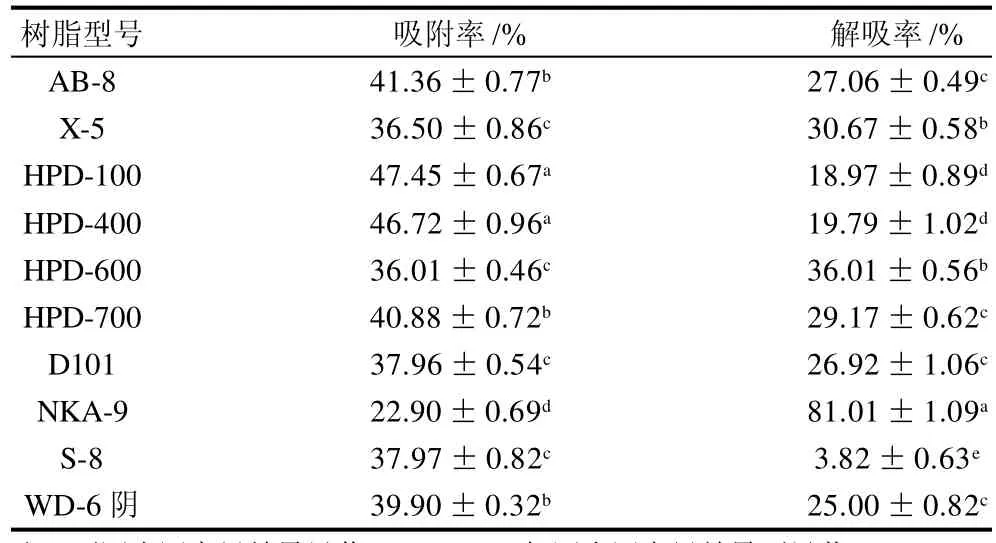
表1 不同大孔吸附树脂对越橘花色苷静态吸附和解吸的比较Table 1 Comparison of adsorption and desorption efficiencies using different resins
从表1可以看出,在30℃、110r/min、恒温振荡24h情况下,不同类型的树脂对花色苷的吸附程度不同,吸附率最好的依次是HPD-100、HPD-400、AB-8、HPD-700,而解吸率最好的依次是NKA-9、HPD-600、X-5、HPD-700,综合考虑吸附率和解吸率,后续实验选用HPD-700型作为纯化野生越橘花色苷的大孔吸附树脂。
2.3 洗脱剂的选择
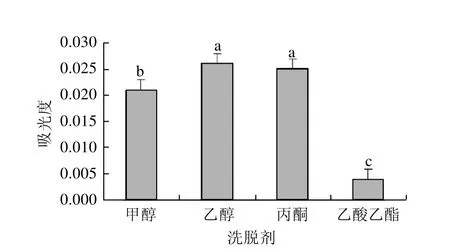
图2 不同洗脱剂对洗脱效果影响Fig.2 Effects of different elution agents on desorption efficiency
由图2可知,不同洗脱剂对吸附饱和的HPD-700型大孔树脂上花色苷的解吸能力依次为:乙醇>丙酮>甲醇>乙酸乙酯,且差异显著,因此选用乙醇作为HPD-700型大孔吸附树脂的洗脱剂。
2.4 动态吸附
2.4.1 不同流速的动态吸附曲线
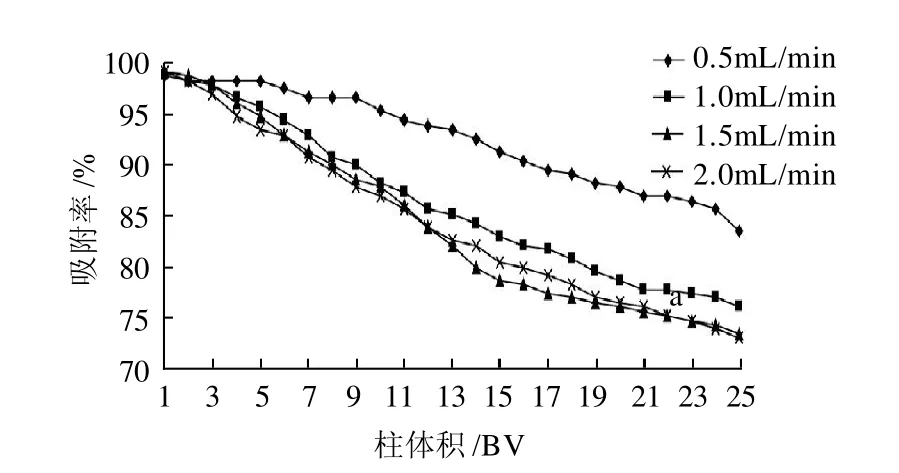
图3 不同流速的动态吸附曲线Fig.3 Dynamic adsorption curves at the conditions of absorption rates
在0.5、1.0、1.5、2.0mL/min这4个不同的流速情况下,HPD-700型大孔树脂对1mg/mL越橘花色苷样液pH2.0的吸附曲线见图3。随着上样液体积的增加,流出液中花色苷含量逐渐增加。当流出液中花色苷吸光度达到上样液花色苷吸光度的1/10时,被认为已经出现泄漏[16]。由图3可知,上样液体积达到220mL时出现泄漏。随流出液体积的增大,其花色苷的吸光度也逐渐增加,树脂对花色苷的吸附百分比逐渐下降。上样液流速低,花色苷的泄漏率也比较低。本实验上样流速0.5mL/min时HPD-700型树脂对花色苷有较好的吸收。
2.4.2 越橘花色苷质量对动态吸附的影响
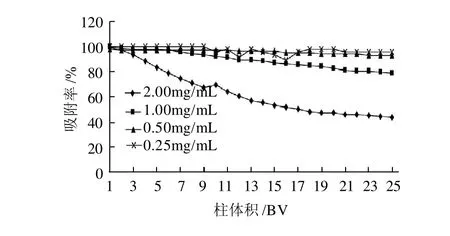
图4 花色苷质量浓度对动态吸附的影响Fig.4 Effect of anthocyanins concentration on adsorption efficiency
由图4可见,HPD-700型大孔吸附树脂对野生越橘花色苷的吸附能力随着花色苷质量浓度的降低而增加,但花色苷质量浓度为1.00mg/mL时与质量浓度0.50、0.25mg/mL的差异不大。根据实际效率和经济效益考虑,选择1.00mg/mL作为动态吸附中花色苷质量浓度。
2.4.3 pH值对动态吸附的影响
由图5可知,不同pH值对HPD-700型大孔吸附树脂动态吸附的影响并不显著,但是对花色苷的显色有很大的影响,在pH小于3时影响最小,而pH值过低又会影响花色苷的结构,故本实验选择pH2。
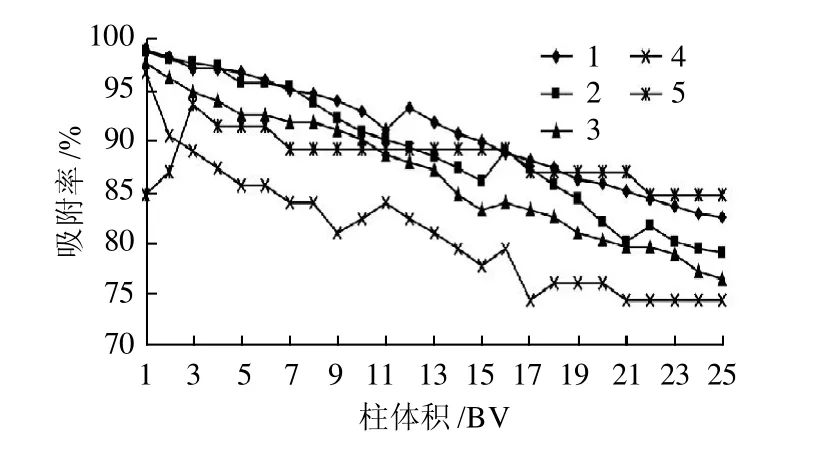
图5 pH值对动态吸附的影响Fig.5 Effect of pH on adsorption efficiency
2.4.4 正交试验结果
根据单因素结果设计三因素三水平正交试验。正交试验因素及水平见表2,正交试验设计及结果见表3。可以看出,各因素对HPD-700型大孔吸附树脂吸附率影响的主次顺序是B>A>C,即花色苷质量浓度>流速>pH值。确定的最佳提取条件为A1B1C2,即流速0.5mL/min、花色苷质量浓度0.75mg/mL、pH2.0。
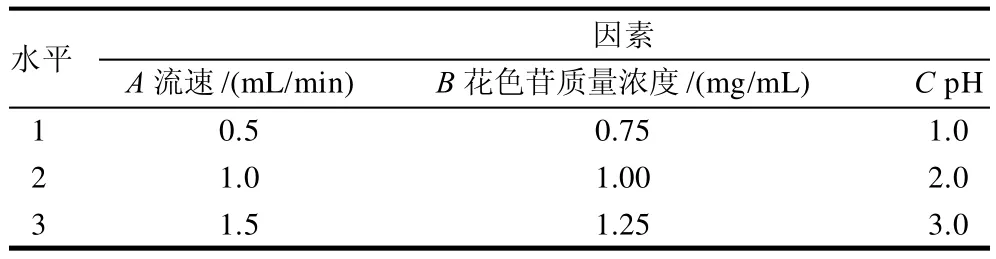
表2 HPD-700型大孔吸附树脂动态吸附L9(33)正交试验因素及水平Table 2 Factors and levels of orthogonal tests for optimizing the absorption of HPD-700
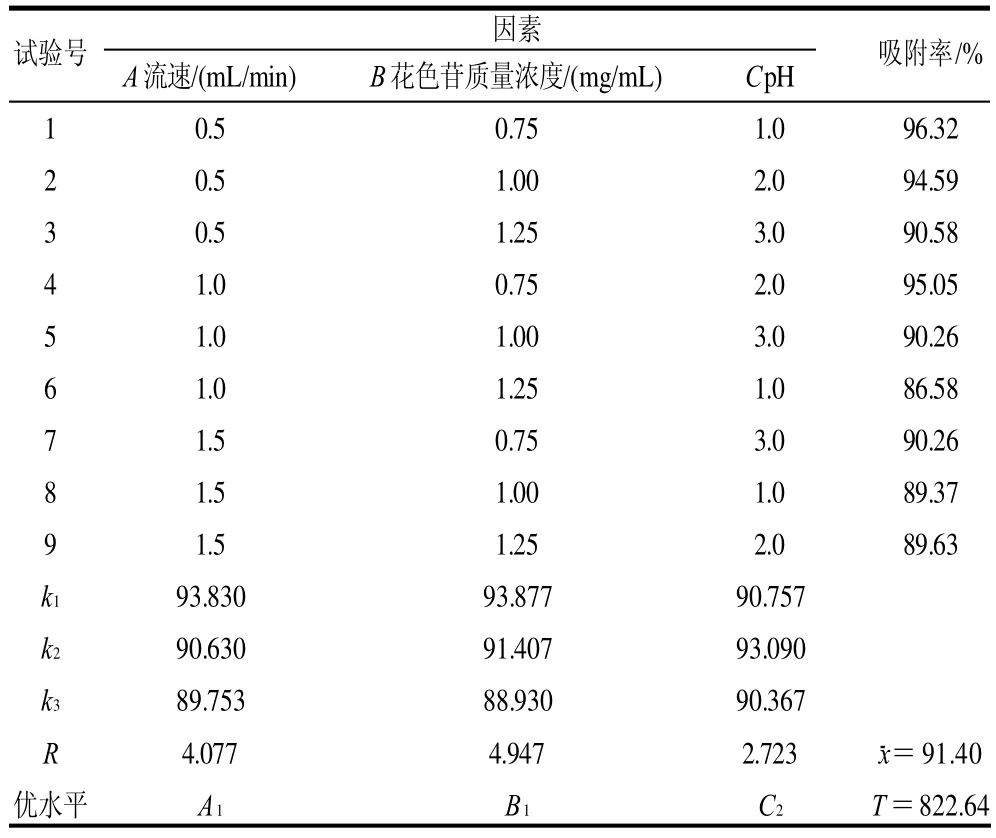
表3 HPD-700型大孔吸附树脂动态吸附L9(33)正交试验设计及结果Table 3 Design and results of orthogonal tests for optimizing the absorption of HPD-700
确定最佳吸附条件为流速0.5mL/min、花色苷质量浓度0.75mg/mL、pH2.0。在此条件下对HPD-700 型大孔吸附树脂的吸附率进行测定,求得吸附率为97.12%,说明吸附工艺得到优化。
2.5 动态解吸
2.5.1 不同流速的动态解吸曲线
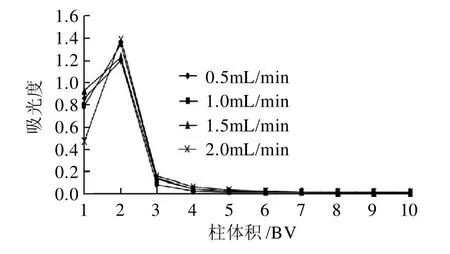
图6 不同流速的动态解吸曲线Fig.6 Dynamic desorption curves at the conditions of different desorption rates
由图6不同流速的动态解吸曲线可以看出,流速为1.0mL/min时具有最大的解吸能力;且四种流速处理中,3BV的70%乙醇均基本可将吸附在树脂上的花色苷洗脱下来,当洗脱液达到5BV时,已解吸下来超过99%的花色苷。曲线的出峰快,洗脱峰集中,无明显拖尾现象。2.5.2 洗脱剂体积分数对动态解吸的影响
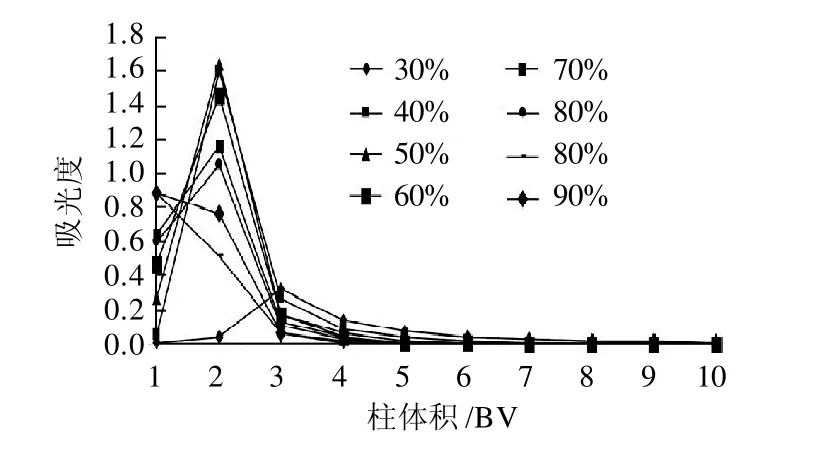
图7 乙醇体积分数对动态解吸的影响Fig.7 Effect of ethanol concentration on desorption efficiency
由图7可知,不同洗脱剂体积分数对花色苷的解吸能力影响较大,当乙醇体积分数50%时,具有最大的解吸能力。
2.5.3 pH值对动态解吸的影响
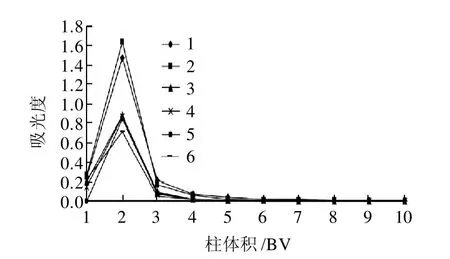
图8 pH值对动态解吸的影响Fig.8 Effect of pH on desorption efficiency
由图8可知,在洗脱液达到3个柱体积时,绝大部分的花色苷被解吸下来,且pH2时具有最大的解吸能力。
2.5.4 HPD-700型大孔吸附树脂解吸正交试验
根据单因素结果设计三因素三水平正交试验。正交试验因素及水平见表4,试验设计及结果见表5。由表5可以看出,通过极差的大小确定各因素对HPD-700型大孔吸附树脂解吸率影响的主次顺序是C>B>A,即pH值>乙醇体积分数>流速。确定的最佳提取条件为A3B3C1,即流速1.5mL/min、乙醇体积分数为60%、pH1.0。在此条件下对HPD-700 型大孔吸附树脂的解吸率进行测定,求得解吸率为80.37%,说明解吸工艺得到优化。

表4 HPD-700型大孔吸附树脂解吸L9(33)正交试验因素及水平Table 4 Factors and levels of orthogonal tests for optimizing the desorption of HPD-700
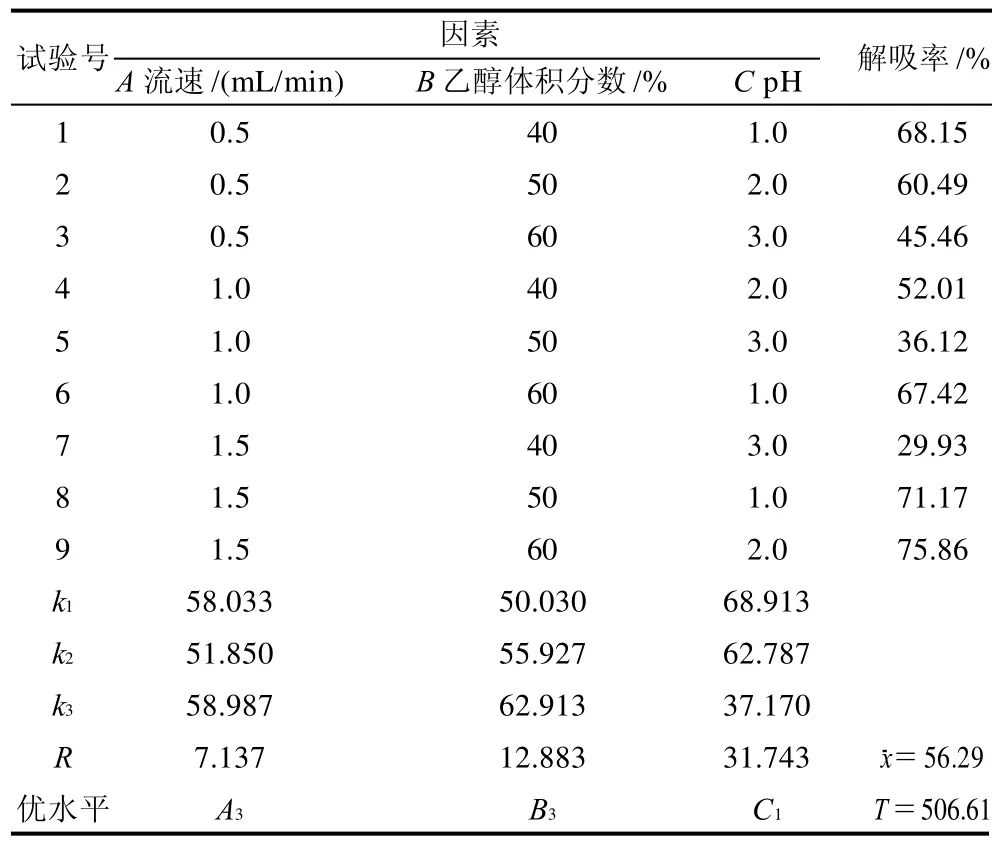
表5 HPD-700型大孔吸附树脂解吸L9(33)正交试验设计及结果Table 5 Design and results of orthogonal tests for optimizing the desorption of HPD-700
2.6 野生越橘花色苷色价和回收率的测定
纯化后的野生越橘花色苷为紫黑色粉末,其色价为64.20,回收率为86.20%。
3 结 论
通过对10种大孔树脂的静态吸附研究,HPD-700型是一种较好的纯化野生越橘花色苷的大孔树脂;野生越橘花色苷在HPD-700型上的吸附平衡条件为22BV,解吸平衡条件为5BV,在上样流速0.5mL/min,花色苷质量浓度0.75mg/mL,pH2.0的条件下吸附效果最好;采用pH1.0体积分数60%的乙醇溶液,在流速1.5mL/min的条件下洗脱效果好。该工艺生产的花色苷产品为紫黑色粉末,色价为64.20,回收率为86.20%。
[1] 李亚东. 越橘栽培与加工利用[M]. 长春: 吉林科学技术出版社 , 2001.[2] 孙延玲, 阎瑞香, 李宁, 等. 不同保鲜包装对越橘果实贮藏生理和效果的影响[J]. 保鲜与加工, 2008, 47(4): 27-30.
[3] 徐渊金, 杜琪珍. 花色苷分离鉴定方法及其生物活性[J]. 食品与发酵工业, 2006, 32(3): 67-72.
[4] SKUPIEN K, OSZMIANSKI J, DOROTA K N, et al.In vitroantileukaemic actity of extracts from berry plant leaves against sensitive and multidrug restant HL60 cells[J]. Cancer Lett, 2006, 236(2): 282-291.
[5] FRANCIS C L, SHUKITT-HALE B, JAMES A J. The beneficial effects of fruit polyphenols on brain aging[J]. Neuto Aging, 2005, 26(1): 128-132.
[6] YI Weiguang, FISCHER J, KREWER G, et al. Phenolic compounds from blueberrise can inhibit colon cancer cell proliferation and induce apoptosis[J]. J Agric Food Chem, 2005, 53(18): 7320-7329.
[7] 李亚东, 吴林, 张志东. 越橘(蓝莓)栽培与加工利用[M]. 长春: 吉林科学技术出版社, 2000.
[8] YI Weiguang, C A, SIMIR C A, FISCHER J, et al. Effects of phenolic compounds in blueberries and muscadine grapes on Hep G2 cell viability and apoptosis[J]. Food Research International, 2006, 39(5): 628-638.
[9] 王萍, 苗雨. 大孔树脂对黑加仑果渣花色苷的纯化研究[J]. 哈尔滨商业大学学报: 自然科学版, 2008, 24(6): 701-704.
[10] 陈阳, 王军华, 滕利荣, 等. 大孔树脂法纯化红花芸豆色素及初步鉴定[J]. 农业工程学报, 2007, 23(6): 237-241.
[11] El-MEKKAWY S, MESELHY M R, NAKAMURA N, et al. Anti-HIV-1 and anti-H IV-1-protease substances fromGanoderma lucidum[J].Phytochemistry, 1998, 49(6): 1651-1657.
[12] FU Boqiang, LIU Jie, LI Huan, et al. The application of macroporous resinsin the separation of licorice flavonoids and glycyrrhizic acid[J].Journal of Chromatography A, 2005, 1089(12): 18-24.
[13] QUAN Qingzhuan, DANG Ruiye, LI Tongsheng. Adsorbing and separating radish red pigment by X-5 resin[J]. Acta Botanica Boreal-Occiden-talia Sinica, 2001, 21(6): 1218-1222.
[14] MA Y H, LI W L, PENG Y F, et al. The extractive technique of red pigment ofBougainvillea spectabiliswild[J]. Food Sciences, 2003, 24(1): 78-80.
[15] 马卡姆 K R. 黄酮类化合物结构鉴定技术[M]. 张宝琛, 译. 北京: 科学出版社, 1990.
[16] 李颖畅, 郑凤娥, 孟宪军. 大孔树脂纯化蓝莓果中花色苷的研究[J].食品与生物技术学报, 2009, 28(4): 496-500.
Separation of Anthocyanins from Wild Bilberry by HPD-700 Macroporous Resin
LU.. Chun-mao1,2,BAO Jing2,MENG Xian-jun2,DONG Wen-xuan1,*,WANG Xin-xian2(1. College of Horticultural Science, Shenyang Agricultural University, Shenyang 110866, China;
2. College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
In this study, the separation methods of anthocyanins from wild bilberry were investigated. The results showed that the macroporous resin HPD-7 was the optimal absorption material. The optimum conditions of adsorption and desorption were pH 2.0, anthocyanins concentration of 0.75 mg/mL, sample loading volume of 22 BV (resin bed volume) the adsorption speed of 0.5 mL/min, the 60% ethanol volume as the eluent of 5 BV, and the desorption speed of 1.5 mL/min. Under the optimal separation and purification conditions, a purplish dark powder with color value of 62.40 was achieved at the recovery rate of 86.20%.
wild bilberry;HPD-700 macroporous resin;anthocyanins;adsorption;desorption
TS255.1
A
1002-6630(2012)10-0078-06
2011-07-01
沈阳农业大学博士后基金项目;沈阳市青年人才基金项目(1081240-1-02)
吕春茂(1970—),男,副教授,博士,研究方向为食品生物技术。E-mail:Bt_lcm@126.com
*通信作者:董文轩(1963—),男,教授,博士,研究方向为果树种子资源。E-mail:wxdong63@126.com

