超声波提取花椒皮总黄酮工艺及其抗氧化性研究
高亚妮,田呈瑞*,康宇新,郝 果,周 瑞
(陕西师范大学食品工程与营养科学学院,陕西 西安 710062)
超声波提取花椒皮总黄酮工艺及其抗氧化性研究
高亚妮,田呈瑞*,康宇新,郝 果,周 瑞
(陕西师范大学食品工程与营养科学学院,陕西 西安 710062)
以花椒为原料,采用超声波辅助法提取花椒果皮中的总黄酮,在单因素试验基础上设计正交试验研究提取最佳工艺条件。结果表明:花椒果皮总黄酮超声提取的最佳工艺条件为料液比1:30(g/mL)、提取时间50min、乙醇体积分数45%。采用紫外分光光度法测定其总黄酮含量,得率可达到3.56%。花椒皮总黄酮清除DPPH自由基和·OH的IC50分别为0.855μg/mL和132.18μg/mL;同时可以看出花椒皮总黄酮也具有很强的还原能力,且高于BHT。
超声波提取;花椒果皮;黄酮;正交试验;抗氧化
花椒(Zanthoxylum bungeanumMaxim,ZBM)为芸香科花椒属植物,其果皮是我国特有的药食两用香料,具有驱虫麻醉、防腐、保健、增加食欲等作用[1]。我国花椒主产于四川汉源、陕西韩城、凤县、河南辉县、河北陟县等地。花椒果皮中的主要成分有花椒挥发油、生物碱、酰胺类、香豆素、黄酮类等,此外还有少量的氨基酸和矿物质[2-3]。花椒的深加工产品主要有花椒精油、花椒油树脂、微胶囊等[4]。目前,对花椒的研究中主要集中在花椒油的提取,酰胺类等研究,然而,对花椒中的多酚、香豆素、黄酮等活性物质的相关研究,目前尚未见报道。黄酮类物质具有抗氧化抗衰老、抗炎镇痛、抗癌防癌等方面有显著性的作用[5-6]。超声波辅助法可以通过空化作用快速地提取植物细胞内的有效成分,具有省时、高效、操作简单等作用[7]。因此,本实验研究超声波技术提取花椒皮总黄酮的影响因素,并通过二次回归试验优化提取工艺条件;并研究花椒皮总黄酮的抗氧化性,为花椒的进一步综合开发利用提供参考。
1 材料与方法
1.1 材料、试剂与仪器
花椒:陕西省韩城市西庄镇花椒交易市场;选取颗粒饱满而有光泽的干花椒果皮,用粉碎机进行粉碎成细分,5 0℃烘干过6 0目筛,入袋保存,备用。
乙醚(沸点30~60℃;分析纯)、无水乙醇(分析纯)天津市天力化学试剂有限公司;亚硝酸钠(分析纯)、硝酸铝(分析纯) 西安化学试剂有限公司;氢氧化钠(分析纯) 上海山海工学团实验二厂;芦丁(色谱级) 西安东瑞科教实验仪器有限公司;DPPH(分析纯) 美国Sigma公司;BHT(食品级) 天津市福晨化学试剂有限公司;其他试剂为分析纯。
722型分光光度计 上海光谱仪器有限公司;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂;KQ-200KDE型超声波清洗器 昆山市超声仪器有限公司。
1.2 方法
1.2.1 超声波提取花椒皮总黄酮工艺流程
花椒干果皮粉→索氏抽提(脱脂及除脂溶性色素)→烘干→超声波提取→冷却→定容→测定
1.2.2 提取溶剂的选择
采用超声波辅助提取法对花椒中的总黄酮进行提取时,可以选择不同的有机溶剂作为溶剂,但是考虑到成本的高低,毒性的大小和回收的难易性,本实验中选用无水乙醇作为花椒黄酮的提取溶剂。
1.2.3 芦丁标准曲线的绘制
准确称取芦丁标品40mg,用30%乙醇溶液溶解并定容至100mL,即为芦丁的标准溶液(0.4mg/mL)。分别取上述芦丁标品0、0.5、1、1.5、2mL于10mL容量瓶中,用80%乙醇溶液补至5mL,加入0.3mL 5%亚硝酸钠溶液,摇匀静置6min,接着加入0.3mL 10%硝酸铝溶液,静置6min后再加入4mL 4%氢氧化钠溶液,摇匀,用蒸馏水稀释至刻度线,15min后在波长510nm处测定吸光度[8-9]。以芦丁标品质量浓度为横坐标,吸光度为纵坐标绘制标准曲线。线性方程为y=11.74x-0.0058,R2=0.9991。
1.2.4 样品中总黄酮的测定
移取0.5mL提取液于10mL容量瓶中,用80%乙醇溶液补至5mL,加入0.3mL 5%亚硝酸钠溶液,摇匀静置6min,接着加入0.3mL 10%硝酸铝溶液,静置6min后再加入4mL 4%氢氧化钠溶液,摇匀,用蒸馏水稀释至刻度线,15min后在波长510nm处测定吸光度。计算总黄酮得率:
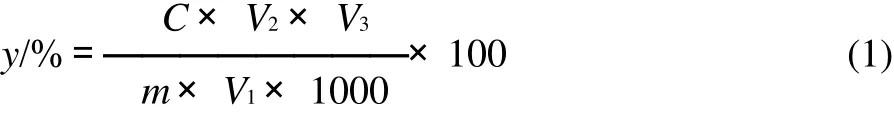
式中:y为样品中总黄酮得率/%;c为依据标准曲线计算出的待测液中黄酮的质量浓度/(mg/mL);m为样品的质量/g;V1为样品提取液测定时用的体积/ 0.5mL;V2为样品提取液的总体积/50mL;V3为测定样品时定容的体积/10mL。
1.2.5 花椒总黄提取参数的确定
单因素试验条件:料液比(1:10、1:15、1:20、1:25、1:30、1:35);提取时间(20、30、40、50、60、70min);提取温度(30、40、50、60、70、80℃);超声功率(80、100、120、140、160、180W);乙醇体积分数(40%、50%、60%、70%、80%)。
在单因素试验基础上进行正交试验,得出最佳提取工艺条件。
1.2.6 DPPH自由基清除率的测定
称取10mg DPPH,用无水乙醇溶解并定容于250mL容量瓶中,配制成浓度1×10-4mol/L的溶液备用。将花椒皮总黄酮提取液稀释成不同浓度梯度,各取2mL不同浓度的稀释液于试管中,再加入2mL配制好的DPPH溶液,混合均匀,反应30min后,于波长517nm处测定其吸光度(Ai);以2mL无水乙醇代替2mL DPPH的吸光度(Aj);以2mL无水乙醇代替2mL待测溶液的吸光度(A0)[10-11]。计算DPPH自由基清除率(Y):
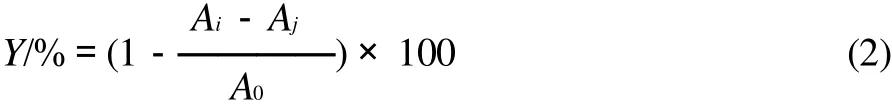
1.2.7 对·OH清除率的测定
将花椒皮总黄酮提取液用蒸馏水配制成不同浓度,各取1mL不同浓度的稀释液于试管中,依次地加入1mL 6mmol/L FeSO4和1mL 6mmol/L H2O2,混合均匀后静置10min;再加入1mL 6mmol/L水杨酸,混匀静置30min,在波长510nm处测定其吸光度(Ai);以蒸馏水代替水杨酸的吸光度(Aj);以蒸馏水代替总黄酮溶液的吸光度(A0)[12-13]。计算·OH清除率(Y):
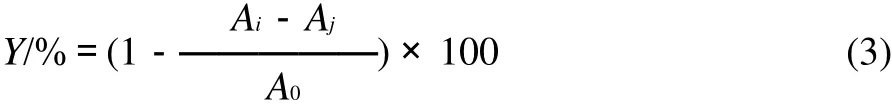
1.2.8 花椒皮总黄酮还原力的测定[14-15]
取2.5mL不同浓度总黄酮溶液,加入2.5mL 0.2mol/L磷酸缓冲液(pH6.6)和2.5mL 1%铁氰化钾溶液,50℃水浴20min后急速冷却,加入含2.5mL 10%三氯乙酸溶液,再取5mL混合液,加入4mL蒸馏水及1mL 0.1%三氯化铁水溶液,混合10min于波长700nm处测定吸光度。吸光度越大则还原力越强。
2 结果与分析
2.1 单因素试验结果
2.1.1 提取时间对花椒皮总黄酮得率的影响
称取6份脱脂花椒粉(每份1g)于锥形瓶中,按照料液比1:25在每份中加入50%乙醇溶液25mL,设置提取温度45℃,提取功率100W,采用超声波震荡分别提取20、30、40、50、60、70min,过滤并定容至50mL,在510nm处测定提取液的吸光度。考察提取时间对花椒皮总黄酮得率的影响。
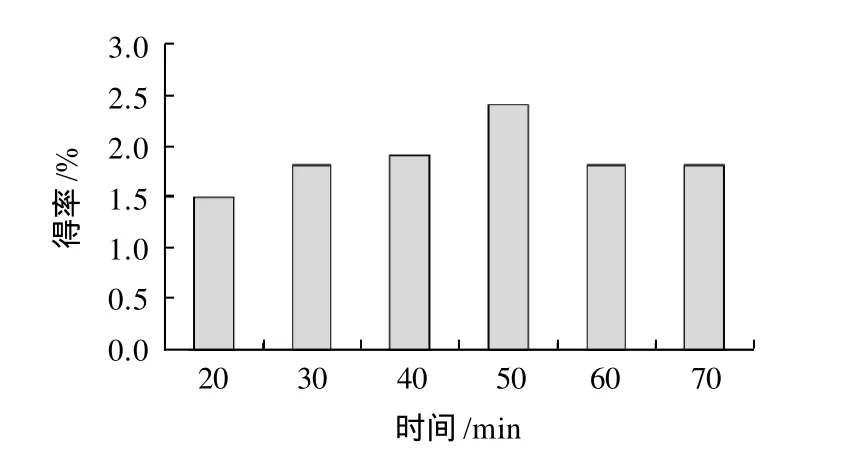
图1 提取时间对总黄酮得率的影响Fig.1 Effect of extraction time on extraction rate of total flavonoids
由图1可知,总黄酮得率随着提取时间的延长呈上升的趋势,50min达到最大,之后得率有所下降。原因可能是由Fick定理可知,提取时间与得率呈正比,在一定条件下,得率随超声提取时间的延长而增大[16]。但是长时间地进行超声波提取,改变了超声作用的环境,造成黄酮类物质的氧化,致使总黄酮得率反而有所下降[17-18]。综合考虑选择50min为最佳提取时间。
2.1.2 提取温度对花椒皮总黄酮得率的影响
设置提取温度20、30、40、50、60、70℃,其他操作条件同2.1.1节,考察提取温度对花椒皮总黄酮得率的影响。
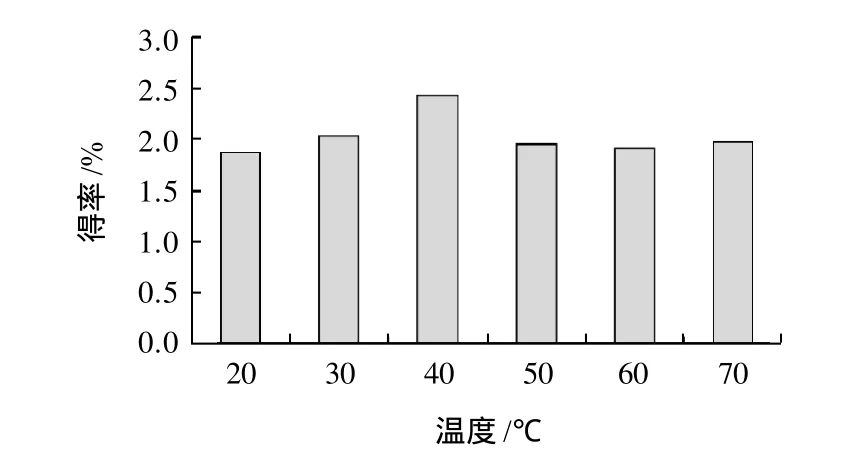
图2 提取温度对总黄酮得率的影响Fig.2 Effect of extraction temperature on extraction rate of total flavonoids
由图2可知,在40℃时,花椒皮总黄酮得率达到了最大值,其之前和之后的得率都有所下降,并且得率都基本一致,差异不明显。可能是在超声波过程中,温度受到外部因素的影响,不易控制,导致40℃前后得率差异不大。
2.1.3 提取功率对超声波提取效果的影响
设置超声波功率80、100、120、140、160、180W,其他操作条件同2.1.1节,考察提取功率对花椒皮总黄酮得率的影响。
由图3可知,花椒皮总黄酮得率随着提取功率的增大,140W时得率达到最大值,但之后得率明显下降,并且在高功率提取时对仪器的损耗较大,因此选择140W为最佳提取功率。
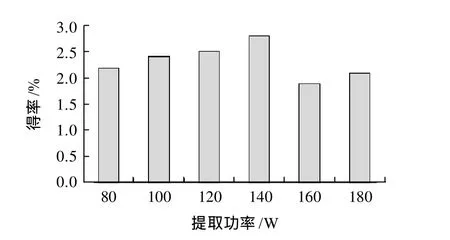
图3 超声功率对总黄酮得率的影响Fig.3 Effect of ultrasonic treatment power on extraction rate of total flavonoids
2.1.4 乙醇体积分数对超声波提取效果的影响
设置乙醇体积分数40%、50%、60%、70%、80%、90%,其他操作条件同2.1.1节,考察乙醇体积分数对花椒皮总黄酮得率的影响。
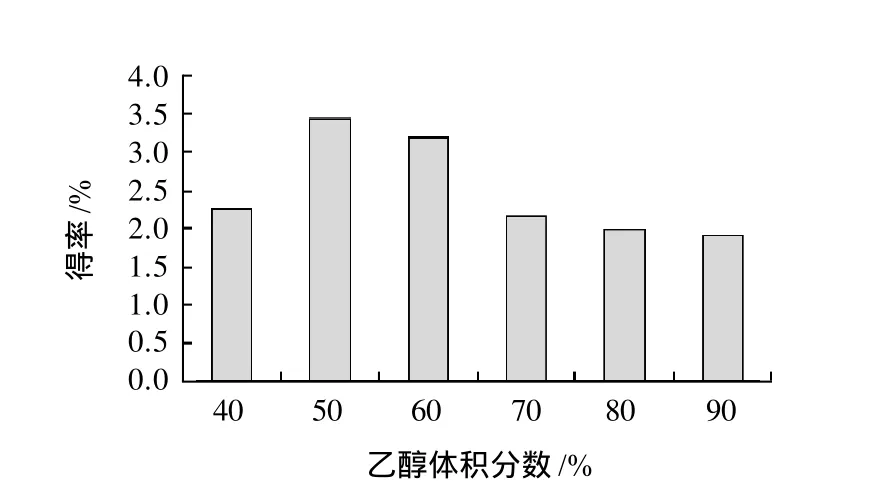
图4 乙醇体积分数对总黄酮得率的影响Fig.4 Effect of ethanol concentration on extraction rate of total flavonoids
由图4可知,在50%和60%乙醇体积分数下,花椒皮总黄酮得率比较高,之后得率明显下降,在90%时又有所上升,但低于50%时的得率。其原因可能是花椒中含有的脂溶性黄酮较少,而醇溶性杂质的含量随着乙醇体积分数的增加而增加,减少了黄酮与溶剂结合的机会,从而导致得率的下降[19]。综合考虑黄酮的得率和乙醇的成本,选择50%的乙醇最佳。
2.1.5 料液比对超声波提取效果的影响
设置料液比1:10、1:15、1:20、1:25、1:30、1:35 (g/mL),其他操作条件同2.1.1节,考察料液比对花椒皮总黄酮得率的影响。
由图5可知,随着提取剂用量的增大,花椒皮总黄酮得率逐渐增加,在1:25时得率达到最大值,其后再增加溶剂的量,得率反而有所下降。其原因可能是开始时随着溶剂的增加,加大了有效成分从细胞壁内扩散出来,但溶剂用量增大到一定程度,减少了细胞壁对于超声波能量的吸收。综合考虑对乙醇的节省,选1:25为最佳提取料液比。
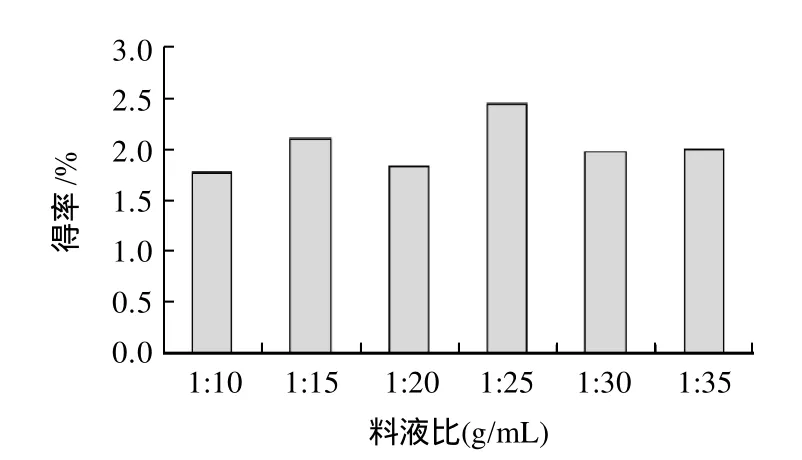
图5 料液比对总黄酮得率的影响Fig.5 Effect of solid-to-solvent on extraction rate of total flavonoids
2.2 超声波提取花椒皮总黄酮工艺二次旋转回归正交试验优化
2.2.1 试验因素与水平选取
由单因素试验结果可知,提取功率各水平对总黄酮得率的影响不大,利用超声波提取时温度不是很稳定,所以固定提取温度和提取功率,选用料液比、提取时间、乙醇体积分数3个因素,进行三因素二次回归旋转组合试验,因素及编码水平见表1。

表1 超声波提取花椒皮总黄酮工艺优化二次旋转回归正交试验因素和编码水平表Table 1 Factors and their coded levels for quadratic regression orthogonal rotary combination design
2.2.2 二次旋转回归组合设计及结果
2.2.2.1 回归方程的建立与检验
根据表2结果,建立花椒皮总黄酮得率与料液比、提取时间、乙醇体积分数3因素的数学回归模型:Y=3.28949+0.30883X1-0.01990X2+0.05705X3----0.03750X1X2-0.17000X1X3-0.06500X2X3。由表3方差分析可知,回归方程的失拟性检验F1>F0.05(5,8),差异显著;回归性检验F2>F0.01(9,13),差异极显著,说明建立的二次旋转回归模型适当。在α=0.10显著水平剔除不显著项后,简化后的回归方程为:Y=3.28949+0.30883X1---0.17000X1X3。
各因素对花椒皮总黄酮得率影响程度的大小为料液比>乙醇体积分数>提取时间。
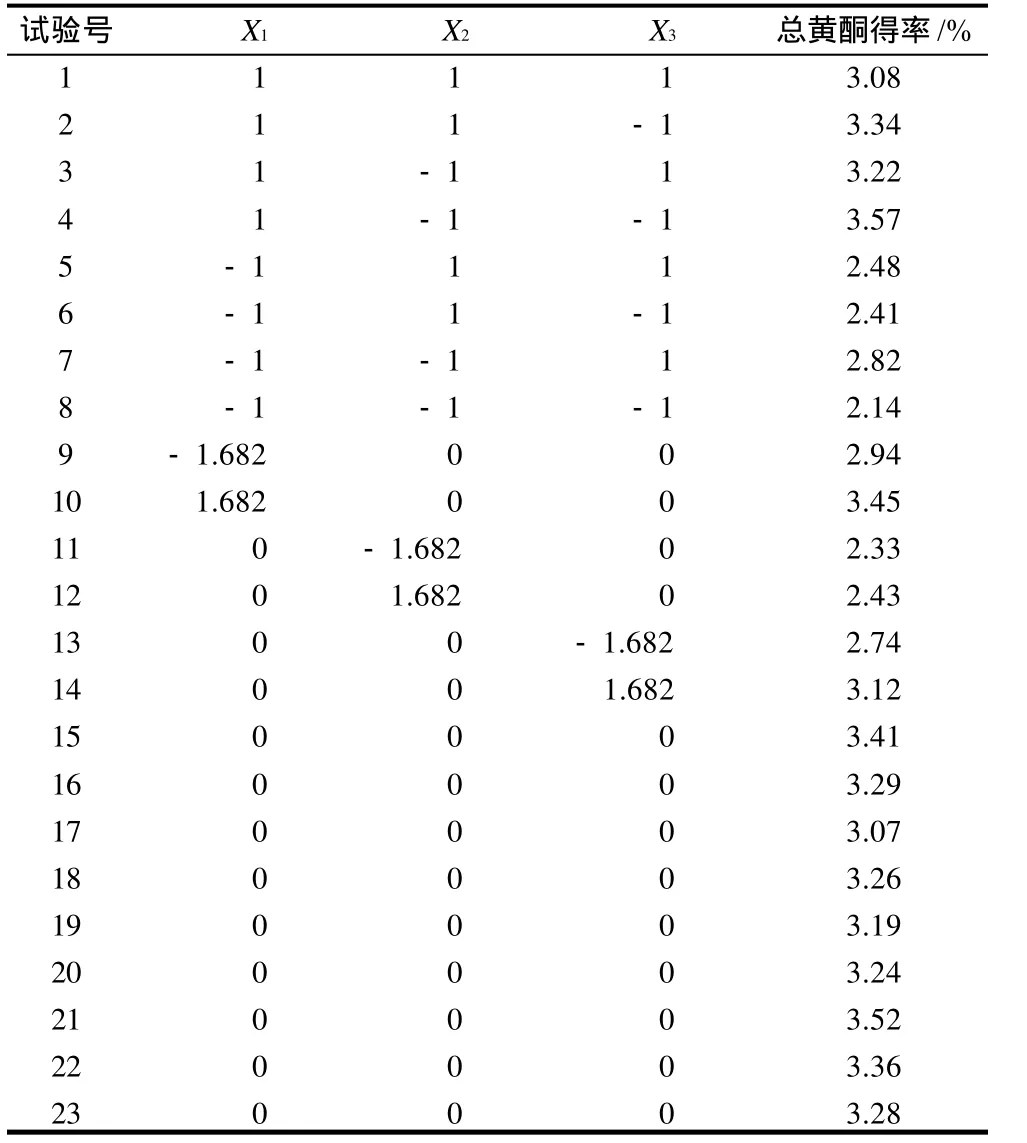
表2 超声波提取花椒皮总黄酮工艺优化二次旋转回归正交试验设计及结果Table 2 Quadratic regression orthogonal rotary combination design protocol and corresponding results
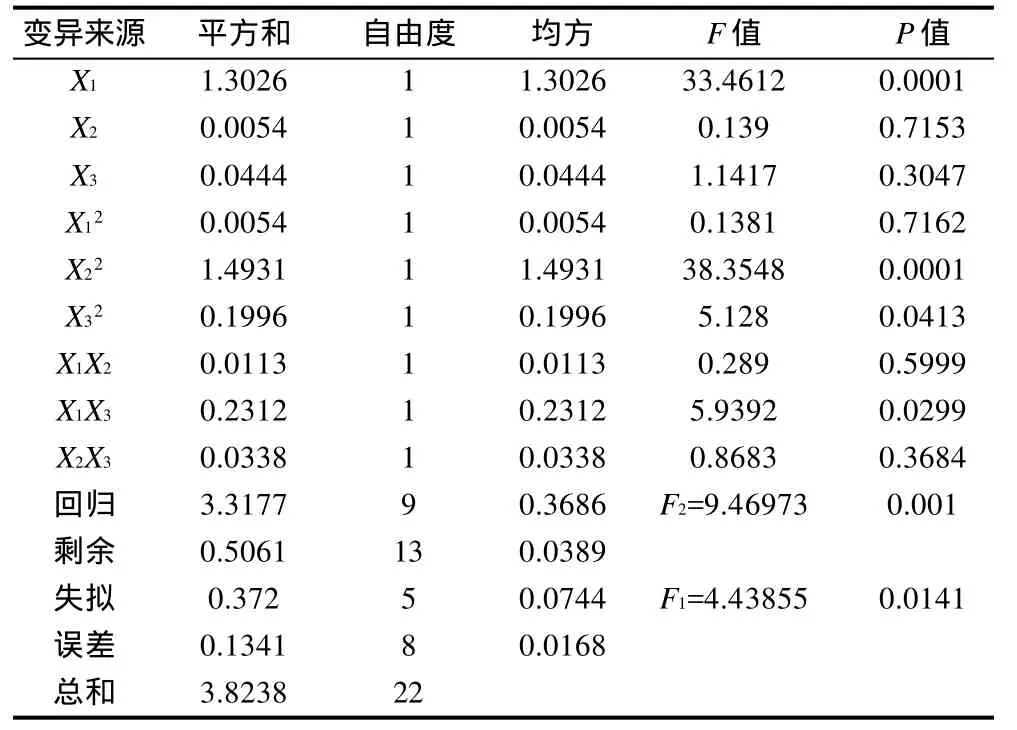
表3 试验结果方差分析表Table 3 Analysis of variance for the experimental results of quadratic regression orthogonal rotary combination design
2.2.2.2 单因素效应分析
由图6可知,在所选因素水平内,提取时间和乙醇体积分数对花椒皮总黄酮得率的影响趋势为先增大后减少;总黄酮得率随着料液比的增大一直处于上升的趋势,到达一定程度时,得率趋于稳定。但是随着料液比的增大,对于乙醇的用量很大,因此提取时应控制其料液比在一定的范围内。
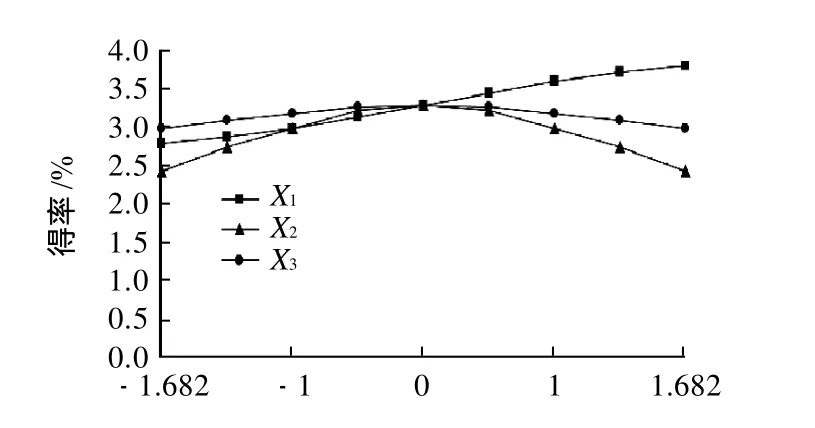
图6 单因素效应分析图Fig.6 Single-factor analysis of the effects of three extraction conditions on extraction rate of total flavonoids
2.2.2.3 双因素交互作用分析
由方差分析可知,本实验所建立的回归模型中,在α=0.10水平下,X1X2、X2X3交互作用均不显著,X1X3因素交互作用较显著,即料液比和乙醇体积分数交互作用对花椒皮总黄酮得率有显著影响,因此,确定提取时间为零水平,得到料液比和乙醇体积分数交互作用的响应曲面图。
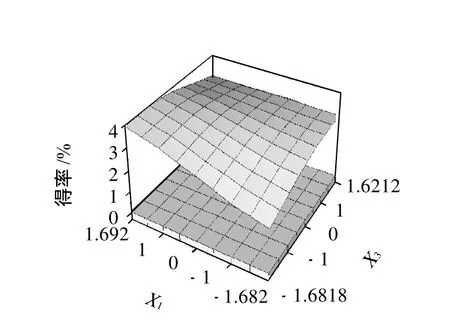
图7 料液比和乙醇体积分数对花椒皮总黄酮得率的交互作用Fig.7 Response surface plot showing the interaction effect of solid-tosolvent ratio and ethanol concentration on extraction rate of total flavonoids
由图7可知,花椒黄酮得率随料液比和乙醇体积分数的变化而变化。随着二因素编码水平的升高,花椒皮总黄酮得率呈明显的增加趋势,当二因素编码值达到一定交互组合后,总黄酮得率缓慢下降。可能的原因是虽然较大的料液比有利于溶质的分散,但高浓度的乙醇不一定就利于花椒粉中黄酮类物质的溶出。因此,只有当料液比和乙醇体积分数合理搭配时才能获得很好的提取效果。
2.2.3 提取工艺参数的优化和验证实验
通过DPS软件分析,采用频率分析方法寻找最优提取条件,总黄酮得率高于3.03%的方案有30个,频率分析结果见表4。由表4可知,在95%置信区间内花椒皮总黄酮得率高于3.03%的优化提取方案为料液比1:29.795~1:32.175(g/mL),提取时间46.71~53.29min,乙醇体积分数41.02%~48.11%,取优化后提取条件的平均值方案X1=1:1.198,X2=0,X3=-0.548,即料液比1:30.985(g/mL)、提取时间50min、乙醇体积分数45.48%。为了方便用于指导实际生产,将最佳提取条件定为料液比1:30、提取时间50min、乙醇体积分数45%。按照最佳提取条件进行验证实验,重复3次,取平均值,得到花椒皮总黄酮得率为3.56%,与理论值(3.98%)比较接近,进一步说明所用的数学回归模型是较合适的。

表4 大于3.03%的30个方案中各变量取值的频率分布Table 4 Frequency distribution of three variables from 30 programs resulting in > 3.03% extraction rate of total flavonoids
2.3 花椒皮总黄酮抗氧化能力的分析
2.3.1 花椒皮总黄酮对DPPH自由基的清除效果
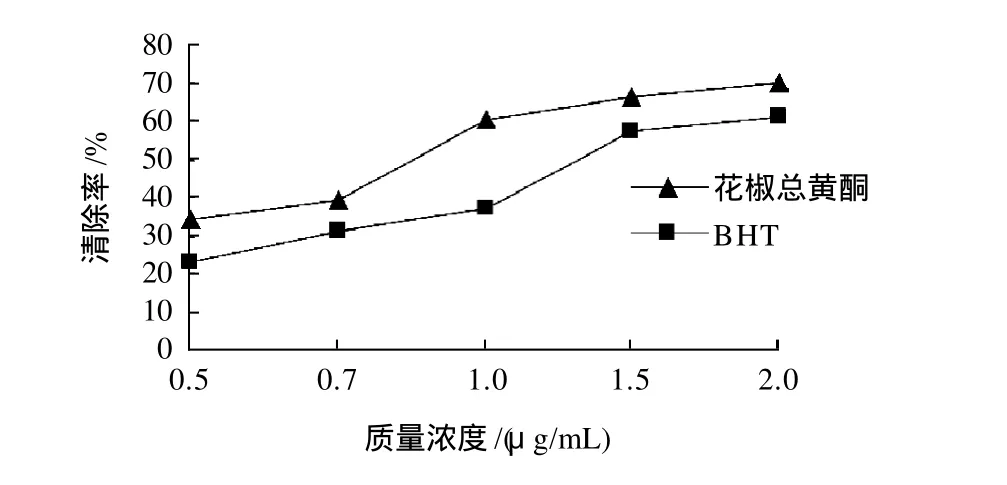
图8 不同质量浓度总黄酮对DPPH自由基清除效果Fig.8 Comparison of scavenging effects of total flavonoids and BHT at various concentrations on DPPH free radicals
由图8可以看出,在0.5~2μg/mL质量浓度范围内,花椒皮总黄酮质量浓度与DDPH自由基清除率表现了良好的量效关系,清除率随总黄酮质量浓度的增大表现了逐步上升的趋势。花椒皮总黄酮清除DPPH自由基的IC50为0.855μg/mL,BHT清除DPPH自由基的IC50为1.32μg/mL,BHT的IC50大约是花椒皮总黄酮IC50的1.5倍,花椒皮总黄酮表现出优于BHT的清除自由基的能力。2.3.2 花椒皮总黄酮对·OH清除效果
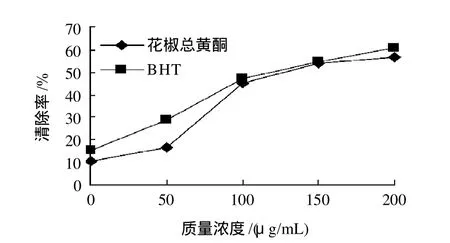
图9 不同质量浓度总黄酮对·OH清除效果Fig.9 Comparison of scavenging effects of total flavonoids and BHT at various concentrations on hydroxyl free radicals
由图9可知,在40~200μg/mL范围内,花椒皮总黄酮对·OH的清除作用随质量浓度的增大而增强,但低于BHT对·OH的清除作用。在40~160μg/mL的质量浓度内,BHT的清除作用明显高于花椒皮总黄酮,在随后的质量浓度中,花椒皮总黄酮对·OH的清除能力迅速加强,基本与BHT的清除作用趋于一致。通过数学模拟曲线方程可知:花椒皮总黄酮清除·OH的IC50为132.18μg/mL,BHT清除·OH的IC50为127.95μg/mL,在高质量浓度时,两者的清除能力差异不大。
2.3.3 花椒皮总黄酮还原力分析
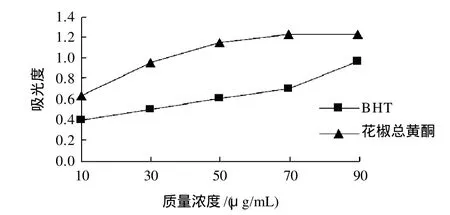
图10 花椒皮总黄酮的还原力Fig.10 Comparison of reducing power of total flavonoids and BHT at various concentrations
由图10可看出,花椒皮总黄酮和BHT吸光度都随质量浓度的增大而逐渐增加,其中花椒皮总黄酮吸光度明显地比BHT的大,增加趋势也比较快,说明花椒皮总黄酮还原力显著高于BHT的还原力。一般抗氧化剂是通过自身的还原作用给出电子而清除自由基,还原力越强,花椒皮总黄酮在某些方面表现出越强的抗氧化性。
3 结 论
3.1 通过单因素和二次旋转回归正交设计试验,得到超声波法提取花椒皮总黄酮的最佳条件为料液比1:30、提取时间50min、乙醇体积分数45%。确定了影响因素的主次顺序为料液比>乙醇体积分数>提取时间。
3.2 通过清除自由基多体系的研究,花椒皮总黄酮具有极强的清除自由基的能力。其抑制DPPH自由基和·OH的IC50分别为0.855μg/mL和132.18μg/mL,花椒皮总黄酮对自由基的抑制能力大小为DPPH自由基>·OH;同时可以看出花椒皮总黄酮也具有很强的还原能力,且高于BHT。说明花椒皮总黄酮具有很好的抗氧化作用。
[1] 李建红, 张水华, 孔令会. 花椒研究进展[J]. 中国调味品, 2009, 34 (2): 28-31.
[2] 付陈梅, 阔建全, 陈宗道, 等. 花椒的成分研究及其应用[J]. 中国食品添加剂, 2003(4): 83-85.
[3] 袁娟丽, 王四旺. 花椒的化学成分及其药效学研究[J]. 现代生物医学进展, 2010, 3(10): 552-554.
[4] 吴素蕊, 阚建全, 刘春芬. 花椒的活性成分与应用研究[J]. 中国食品添加剂, 2004(2): 75-78.
[5] 张如意, 朱静. 生姜总黄酮提取工艺研究[J]. 食品与发酵科技, 2010, 46(1): 89-92.
[6] 丁利君, 周圳辉, 林燕如. 芒萁中黄酮物质的提取及其抗氧化研究[J]. 食品科学, 2005, 26(8): 77-82.
[7] 黄锁义, 阳文辉, 李卫彬, 等. 超声波提取九里香总黄酮及其鉴别[J].时珍国医国药, 2006(3): 395-396.
[8] 王卫东, 赵志鸿, 张小俊, 等. 陈皮提取物中黄酮类化合物及抗氧化的研究[J]. 食品工业科技, 2007(9): 98-100.
[9] 郎娜, 罗红霞. 黄花菜中黄酮类物质抗氧化性的研究[J]. 食品研究与开发, 2007(3): 74-77.
[10] HAZRA B, SARKAR R, BISWAS S. Cesoeamrchp artaicrleative study of the antioxidant and reactive oxygen species scavenging properties in the extracts of the fruits ofTerminalia chebula,Terminalia belericaandEmblica officinalis[J]. Complementary and Alternative Medicine, 2010 (10): 1472-1487.
[11] ARDESTANI A, YAZDANPARAST R. Antioxidant and free radical scavenging potential ofAchillea santolinaextracts[J]. Food Chemistry, 2007, 104(1): 21-29.
[12] 陈佳, 徐怀德, 米林峰, 等. 洋葱皮总黄酮纤维素酶法提取及抗氧化研究[J]. 食品科学, 2011, 32(4): 37-41.
[13] 雷明. 桂花果类黄酮分离纯化工艺及其抗氧化研究[J]. 西南大学学报, 2011, 33(4): 77-82.
[14] 莫开菊, 柳圣, 程超. 生姜黄酮的抗氧化活性研究[J]. 食品科学, 2006, 27(9): 110-114.
[15] 张悦, 苏智先, 罗明华, 等. 珙桐叶总黄酮提取工艺及体外抗氧化性[J]. 中国光谱实验室杂志, 2011, 28(3): 987-990.
[16] 杨冀艳, 胡磊, 许杨. Plackett-Burman设计和响应面法优化荷叶总黄酮的提取工艺[J]. 食品科学, 2009, 30(6): 29-33.
[17] 涂宗财, 江国忠, 陈钢, 等. 黄姜茎叶中总黄酮的提取工艺研究[J].食品工业科技, 2009(4): 236-238.
[18] 于浩, 阮美娟, 赵龙, 等. 响应面法优化荷叶黄酮超声提取条件的研究[J]. 食品研究与开发, 2010, 31(1): 55-60.
[19] 李春梅, 郁建平. 草珊瑚总黄酮的超声提取工艺研究[J]. 化学与生物工程, 2009, 26(7): 48-51.
Optimization of Ultrasonic-Assisted Extraction and Antioxidant Activity of Total Flavonoids fromZanthoxylum bungeanumMaxim Fruit Peel
GAO Ya-ni,TIAN Cheng-rui*,KANG Yu-xin,HAO Guo,ZHOU Rui
(College of Food Engineering and Nutritional Science, Shaanxi Normal University, Xi’an 710062, China)
With the aim of developing an ultrasonic-assisted procedure for the extraction of total flavonoids fromZanthoxylum bungeanumMaxim fruit peel, we performed an orthogonal array design based on one-factor-at-a-time experiments to determine optimal extraction conditions. A 45% ethanol/water solution was found to be the best solvent for total flavonoids and the optimal solid-to-solvent ratio was 1:30 (g/mL). An extraction duration of 50 min was found to be optimum. Under these conditions, the yield of total flavonoids was spectrometrically determined to be 3.56%. The IC50 values of the obtained extract for scavenging DPPH and hydroxyl free radicals were 0.855μg/mL and 132.18μg/mL, respectively. Moreover, the total flavonoids extracted fromZanthoxylum bungeanumMaxim fruit peel possessed stronger reducing power than BHT.
ultrasonic-assisted extraction;Zanthoxylum bungeanumMaxim fruit peel;total flavonoids;orthogonal array design;antioxidant activity
TS264
A
1002-6630(2012)18-0077-06
2011-07-25
高亚妮(1985—),女,硕士研究生,研究方向为食品资源开发利用。E-mail:kaixingaoyani@163.com
*通信作者:田呈瑞(1955—),男,教授,研究方向为食品新资源开发与利用。E-mail:chrtian@snnu.edu.cn

