高氧气调包装和真空包装对冷鲜肉贮藏过程中保水性和脂质氧化的影响
袁 璐,高 峰,周光宏*
(1.南京农业大学动物科技学院,江苏 南京 210095;2.南京农业大学 教育部肉品加工与质量控制重点实验室,农业部农畜产品加工与质量控制重点开放实验室,江苏 南京 210095)
高氧气调包装和真空包装对冷鲜肉贮藏过程中保水性和脂质氧化的影响
袁 璐1,2,高 峰1,2,周光宏2,*
(1.南京农业大学动物科技学院,江苏 南京 210095;2.南京农业大学 教育部肉品加工与质量控制重点实验室,农业部农畜产品加工与质量控制重点开放实验室,江苏 南京 210095)
研究高氧气调包装(80%氧气和20%二氧化碳)和真空包装对冷鲜猪肉保水性的影响。测定不同贮藏时间下的肉样汁液流失率、蒸煮损失、水分分布情况、MDA水平和磷脂酶A2活性,并对各指标之间进行相关性分析。结果表明:在贮藏前6d,高氧气调包装组的汁液流失率、蒸煮损失、MDA水平和磷脂酶A2活性均低于真空包装组;而在第9天时,高氧气调包装组的MDA水平和磷脂酶A2活性显著高于真空包装组(P<0.05);MDA水平与汁液流失率、蒸煮损失、T22面积比例以及磷脂酶A2活性之间的相关性分别为0.642、-0.521、-0.987、0.786,均达到极显著水平(P<0.01)。因此,在对冷鲜肉进行短时间贮藏时,高氧气调包装的冷鲜肉的保水性优于真空包装,不同的包装方式能够通过影响冷鲜肉的脂肪氧化水平和磷脂酶活性进而影响其保水性。
真空包装;高氧气调包装;保水性;脂质氧化;磷脂酶活性
气调包装是目前应用较广的肉类保鲜技术,该技术主要通过改变包装内的气体环境,以达到抑制微生物的生长和繁殖的目的,进而延长产品的保质期[1]。传统的调包装主要为低氧气调包装,由于其氧气含量过低,往往会导致肉品表面颜色黯淡,且厌氧菌大量繁殖会缩短商品的货架期。因此,该包装方式已无法满足消费者对冷鲜肉品质的要求。高氧气调包装是指以80% O2和20% CO2组合的方式对商品进行包装,一方面高浓度氧气的存在可以使冷鲜肉保持亮红色,另一方面二氧化碳的存在也可以抑制微生物的生长而延长货架期[2-3]。Seyfert等[4]研究发现高氧气调包装方式可以使牛肉保持亮红色因而受到消费的喜欢。但是,目前关于高氧气调包装方式的研究多集中在对肉色的影响研究,而对保水性的影响研究还较少。
保水性作为一项重要的肉质指标不仅影响肉的多汁性,更直接影响肉类行业的经济利益。因此,对于如何提高冷鲜肉的保水性在肉类零售业中有重要的意义[5]。更重要的是,新鲜肉类的保水性还影响肉表面水分的渗出并最终影响消费者在选购鲜肉时的购买欲望,如何保持新鲜肉在流通过程中颜色与持水稳定性之间的平衡成为各国学者研究的目标之一。虽然肉颜色和保水性之间存在很大的关联,但是,它们各自生物化学特性之间存在很大的区别[6-8]。影响肉保水性的因素很多,包括基因型[9]、成熟过程[10]、冷却速度[11]等。另外,由于高氧气调包装的氧气浓度很高,存在是否会导致冷鲜肉在贮藏过程脂肪氧化程度加剧进而对保水性产生影响的问题。肌肉中水分的存在位置主要是肌原纤维内部、肌原纤维和细胞膜之间,细胞膜结构与功能的正常与否会对肌肉的保水性产生重要的影响。细胞膜的主要结构主要是磷脂双分子层,同时存在脂肪氧化以及降解磷脂的磷脂酶活性是否会对细胞膜的结构和功能产生影响进而影响保水性的问题。
因此,本实验以真空包装为对照,研究高氧气调包装的冷鲜肉在冷藏过程中其保水性的变化,并通过测定脂肪氧化水平和磷脂酶活性,探讨其与肉的保水性之间的相关性,为高氧气调包装对肉的保水性的影响提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
冷鲜猪肉猪背长肌 江苏省南京市南京苏食物流中心。
乙醇、磷酸二氢钾、磷酸氢二钾、氯化钠、EDTA均为分析纯;PP热成型盒;PA/PE复合封口膜;PA/PE复合真空包装袋。
MAP-360型气调包装;丙二醛(MDA)含量测试盒 南京建成生物工程研究所;cPla2试剂盒 Cayman化学公司。
1.2 方法
1.2.1 冷鲜肉的处理
去除冷鲜肉表面肌膜和结缔组织,将肉样切成厚2.5cm、质量150g左右的肉块并称准确质量,记为m0,随机分为两组分别进行高氧气调包装包装和真空包装,取其中一块立即进行各项指标的测定,每组设置5个平行实验。
1.2.2 冷鲜肉的包装
高氧气调包装:首先将冷鲜肉放入PP热成型盒中,采用气调包装机进行包装(O2:CO2=4:1,V/V),170℃封口,氧气透过率<100cm3/(m2·24h·atm);真空包装:采用PA/PE材质的真空包装袋对肉样进行真空包装。将两种包装的冷鲜肉在4℃贮藏9d,分别在第1、3、6、9天取样进行各项指标的测定
1.2.3 汁液流失率的测定
分别在第1、3、6、9天打开包装袋,用滤纸吸干肉样表面的水分并称质量,记为m1,测定汁液流失率。
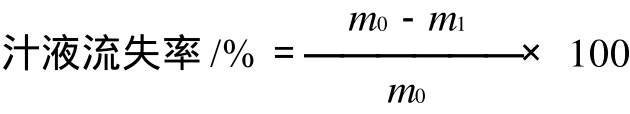
1.2.4 蒸煮损失的测定
取5cm×3cm×2cm大小的肉样,准确称质量记为m2,用塑封袋密封后放入80℃水浴加热至肉样中心温度为70℃,取出肉样,冷却至室温后再次称质量为m3,测定蒸煮损失。
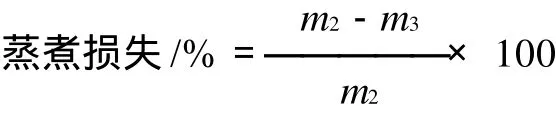
1.2.5 低场核磁共振分析冷鲜肉中的水分分布
样品制备:取1g左右体积约为1cm×1cm×1cm的肉块,放入检测管中进行核磁共振检测。
核磁共振实验:将检测管放入样品池中,打开核磁共振分析软件进行核磁测定。测定参数为:室温24℃,共振频率主频率为22MHz,回波时间τ值为300μs,共扫描1800个回波数,重复扫描16次。自旋-自旋弛豫时间T2用CPMG序列进行测量,每个样品重复测试3次。
1.2.6 硫代巴比妥酸(TBARS)值的测定
脂肪氧化产生的物质用MDA值的大小来衡量。取1g肉样,去除可见的肌间脂肪和结缔组织,放入离心管中,加入9mL 0.86%生理盐水,8000r/min匀浆3次,每次5s;在4℃条件下,2000r/min离心15min,取上清液待测。MDA值用丙二醛(MDA)含量测试盒进行测定,并用双缩脲法测定上清液的蛋白质含量。
1.2.7 磷脂酶活性的测定
磷脂酶活性用cPla2试剂盒测定,主要测定磷脂酶A2活性。取2g肉样,去除可见肌间脂肪和结缔组织,加入25mL 50mmol/L冰冷的磷酸盐缓冲液(包含1mmol/L EDTA,pH7.4),1700r/min匀浆,每次3s,匀3次;在4℃条件下,10000×g离心15min,取上清液待测。
1.3 数据统计分析
采用SPSS 17.0软件对试验所得的数据进行单因素方差分析,采用Duncan多重比较对数据进行差异显著性分析。
2 结果与分析
2.1 对冷鲜肉汁液流失率的影响
冷鲜肉在贮藏的过程中,水分从中渗出导致其质量减轻从而产生汁液流失。汁液流失不仅直接影响肉类行业的经济效益,并且,汁液流失也会导致很显著的蛋白质损失[12]。因此,降低冷鲜肉贮藏过程中的汁液流失率肉类零售业中有重要的意义。

图1 真空和高氧气调包装条件下贮藏冷鲜猪肉汁液流失率的变化Fig.1 Change of drip loss in chilled pork with vacuum and high-oxygen modified atmosphere packaging with storage time
冷鲜肉在贮藏过程中,水分的渗出导致其质量减轻从而产生汁液流失。由图1可见,在9d贮藏期内,两种包装的肉样的汁液流失率总体上呈上升趋势,而真空组的始终大于高氧气调包装组,且在第3、6、9天时差异显著(P<0.05)。
2.2 对冷却肉蒸煮损失的影响
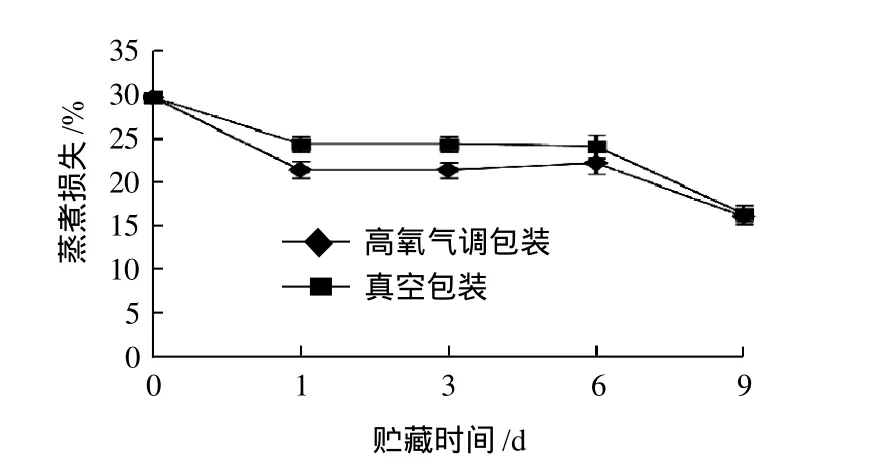
图2 真空和高氧气调包装条件下贮藏冷鲜猪肉蒸煮损失的变化Fig.2 Change of cooking loss in chilled pork with vacuum and high-oxygen modified atmosphere packaging with storage time
由图2可见,在9d贮藏期内,两种包装的肉样的蒸煮损失总体上呈下降趋势,而真空包装组的始终大于高氧气调包装组,且在第1、3天时差异显著(P<0.05)。
2.3 对贮藏期间冷鲜肉中不易流动水比例的影响

图3 真空和高氧气调包装条件下贮藏冷鲜猪肉T22峰面积的变化Fig.3 Change of T22 area ratio in chilled pork with vacuum and high-oxygen modified atmosphere packaging with storage time
冷鲜猪肉的T2弛豫共出现3个峰,在1~10ms内出现第一个峰,为T21,约占总水分的1%~2%;在10~100ms处出现一个较大的峰T22,占总水分的90%~97%,100~300ms之间出现T23峰,约占总水分的1%~5%。其中对保水性起作用的主要是T22。由图3可见,在冷藏过程中T22所表示的不易流动水有上升的趋势,在第1、3天时,高氧气调包装组的不易流动水的比例高于真空包装组,且在第3天差异显著(P<0.05);而在第6、9天时,真空组的较高氧气调包装组高,但未达到显著水平(P>0.05)。

图4 真空和高氧气调包装条件下贮藏冷鲜猪肉T23弛豫时间的变化Fig.4 Change of T23 relaxation time in chilled pork with vacuum and high-oxygen modified atmosphere packaging with storage time
由图4可见,冷藏期间两种包装方式的T23弛豫时间均有增加,且真空包装组的增幅大于高氧气调包装组;在第3、6、9天时真空包装组的T23弛豫时间大于高氧气调包装组,但均未达到显著水平(P>0.05)。
2.4 对冷鲜肉脂肪氧化的影响
由图5可见,冷藏期间两种包装方式的MDA值在前6d时变化不明显,但真空组的始终大于高氧组,但均未达到显著水平(P>0.05);第9天时两种包装方式的MDA值均显著增大,且高氧组的显著大于真空组(P<0.05)。

图5 真空和高氧气调包装条件下贮藏冷鲜猪肉MDA的变化Fig.5 Change of MDA content in chilled pork with vacuum and highoxygen modified atmosphere packaging with storage time
2.5 对冷却肉磷脂酶A2的影响
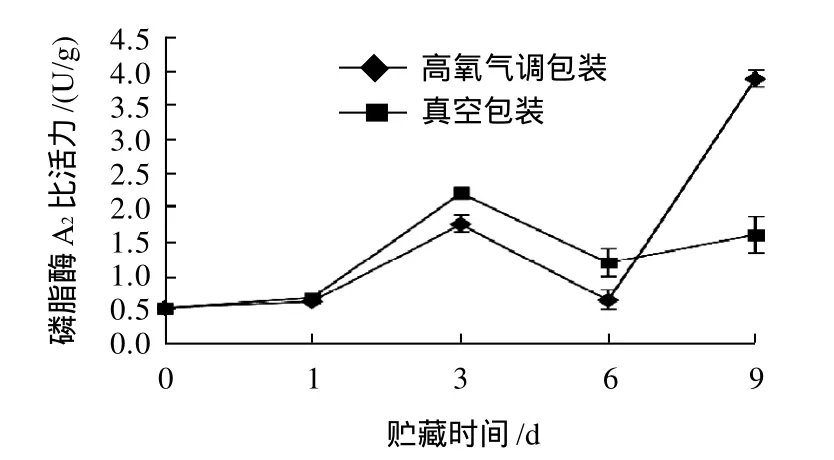
图6 真空和高氧气调包装条件下贮藏冷鲜猪肉磷脂酶A2的变化Fig.6 Change of phospholipase A2 in chilled pork with vacuum and high-oxygen modified atmosphere packaging with storage time
由图6可见,冷藏期间两种包装方式的磷脂酶A2活性有增加的趋势,在第1、3、6天时真空组的显著大于高氧气调包装组(P<0.05),第9天时显著小于高氧气调包装组(P<0.05)。
2.6 各指标间相关性分析
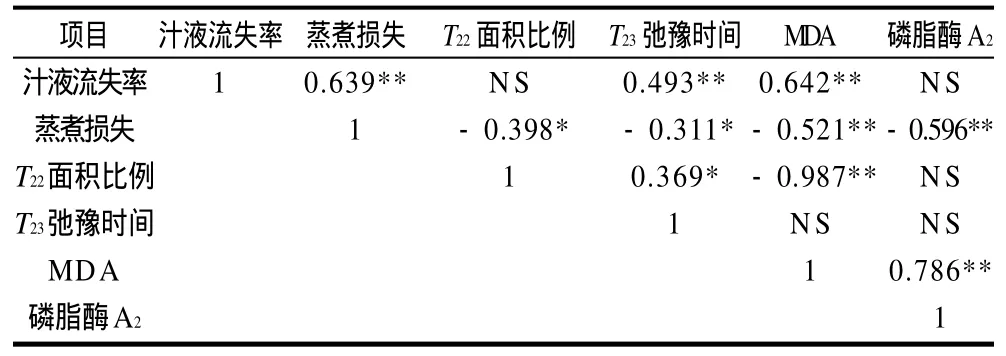
表1 各指标间相关性分析Table 1 Correlation analysis of physiochemical indices of chilled pork
由表1可知,使用传统的方法与使用低场核磁共振的方法所测得的冷鲜肉的保水性之间存在显著的相关性。汁液流失率与T23弛豫时间的相关性为0.439,蒸煮损失与T22面积比例、T23弛豫时间的相关性为-0.398、-0.311,呈显著负相关。MDA水平与汁液流失率、蒸煮损失以及T22面积比例之间均存在极显著的相关性,与磷脂酶A2之间的为0.786,达到极显著水平。
3 讨 论
目前,有很多关于使用低场核磁共振技术来分析肉尤其是猪肉中水分的分布与含量[13]的报道。研究肉品水分分布的核磁共振仪主要是氢质子的低场核磁共振成像分析仪;水是肉的组成成分,构成水的氢原子在有电荷存在的情况下绕核旋转并且同时不停的自转,与线圈通过电流会产生磁场一样,所以,可以把氢原子核看成是小磁铁,把生物组织的试样看成是由无数微小的氢原子核组成的[14]。这些微小的原子核磁铁在磁场中有的处于高能态,有的处于低能态,比较符合玻尔兹曼平衡[15]。对样品施加射频脉冲,使氢质子发生共振,低能态氢质子就可能跃迁到高能态。停止射频脉冲后,质子以非辐射的方式回到基态而达到玻尔兹曼平衡的时间就是弛豫时间。通过分析纵向弛豫时间T1和横向弛豫时间T2,可以得到很多样品内部的信息。肉品水分的研究主要利用横向弛豫时间T2[16-18]。一般地,T2可分为T21(0~10ms)、T22(10~100ms)、T23(>100ms)。所以弛豫时间可以间接的表明水分的自由度,从而可以用核磁共振研究肉品中水分的分布和流动,进而研究肉品品质变化的机理。根据宰后生鲜肉品中氢质子的弛豫时间的分布,可以表明肌肉组织中存在的多个水分群,而且可以探测宰后肌肉中水分的分配和移动。T1和T2能够提供与水分子的结合力和移动相关的信息,用CPMG序列测定生鲜肉品的横向弛豫时间,通过反演程序可以得到多个不同横向弛豫时间(T2s)。Hazlewood等[19]用核磁共振对肉品进行研究得出结论:肉品中至少含有3种不同的水分。一般认为,T2可以分为T21(0~10ms)、T22(10~100ms)、T23(100ms以上)分别可以对应肌肉中的结合水、不易流动水和自由水[20]。生鲜肉中氢质子的弛豫时间越短说明水分与底物的结合越紧密,弛豫时间越长说明水分越自由[21]。从本实验结果可以看出,汁液流失率与T23(自由水弛豫时间)的相关系数为0.439,说明了汁液流失率所流出的主要是自由水。主要原因可能是,随着宰后时间的延长,pH值下降,当pH值接近等电点时(5.0~5.4)时,净电荷数达到最近,这时蛋白质之间互相吸引,降低了对水分的吸引,导致肌原纤维之间的距离缩短,水分由细胞内流到细胞外,导致自由水的含量升高,水分从肌肉中流出。这与Bertram等[22]的研究结果一致。
以往的研究表明,高氧气调包装会导致贮藏过程中肉品脂肪氧化的加剧,进而导致肉的多汁性变差。例如Jayasingh等[23]研究发现高氧气调包装的碎牛肉在贮藏第10天时,脂肪氧化水平极显著大于托盘包装;O,Grady等[24]采用80%氧气和20%二氧化碳组合对牛肉块和碎牛肉进行包装,在10d贮藏期内,碎牛肉的TBARS值在前4 d时显著小于空气中贮藏的牛肉,而牛肉块的TBARS值在整个贮藏期内始终大于空气中贮藏的牛肉。本研究结果显示,高氧组的MDA值在前6d小于真空组,而在第9天显著大于真空组。这可能是由于高氧气调包装的氧分压高,激活了肉中一些抗氧化酶的活性,从而减慢了脂肪氧化的速度。酶作为细胞的组成成分,其催化活性和含量受到多方面的调控,例如,酶的生物合成的诱导和阻遏、激活物和抑制物的调节作用、代谢物对酶的反馈调节、酶的变构调节以及酶的化学修饰等[25]。随着反应时间的延长,抗氧化酶的活性逐渐降低,而环境中氧分压始终保持在较高水平[26],从而使得氧化作用不断增强,氧化产物迅速积累。从表1可以看出,MDA值与汁液流失率、蒸煮损失以及T22面积比例之间均存在极显著的相关性,尤其是与T22之间的相关性达到-0.987。究其原因,可能由于在冷藏过程中,脂肪的氧化破坏了细胞膜的完整性,使得细胞内的水分更易于向细胞膜外流失,从而降低了肉的保水性。
磷脂酶是一种存在于细胞膜上可降解磷脂的酶,共有4种,其中起主要作用的是磷脂酶A2。Lambert等[27]通过体外培养猪的成肌细胞发现,钙离子和氧可以调节磷脂酶A2的活性,如宰后动物肌肉组织缺氧以及肌桨中钙离子浓度升高均可以激活磷脂酶A2,且磷脂酶A2的活性与保水性之间有重要的作用。Cheah等[28]研究发现氟烷敏感猪的肌肉有较高的磷脂酶A2活性。另外,脂肪氧化产生的自由基也能激活磷脂酶A2,激活后的磷脂酶A2能够降解磷脂,从而使细胞膜的通透性发生改变,细胞内维持渗透压的钾离子、硫磺酸等流到细胞外,使细胞外形成高渗状态,导致细胞内水分大量的外流从而形成汁液流失[29]。本研究结果表明,MDA值与磷脂酶A2活性之间的存在极显著的正相关(0.786),与以往的研究结果相似。
4 结 论
在贮藏的前6d,高氧气调包装组的汁液流失率、蒸煮损失、MDA水平和磷脂酶A2活性均低于真空包装组;而在第9天时,高氧气调包装组的MDA水平和磷脂酶A2活性显著高于真空包装组(P<0.05);MDA值与汁液流失率、蒸煮损失、T22面积比例以及磷脂酶A2活性之间的相关性分别为0.642、-0.521、-0.987、0.786,均达到极显著水平;因此,在对冷鲜肉进行短时间贮藏时,高氧气调包装的冷鲜肉的保水性优于真空包装,不同的包装方式能够通过影响冷鲜肉的脂肪氧化水平和磷脂酶活性进而影响其保水性。
[1] 陈阳楼, 王院华. 气调包装用于冷鲜肉保鲜的机理及影响因素[J]. 包装与食品机械, 2009, 27(1): 9-13.
[2] DAUN H K, SOLBERG M, FRANKE W, et al. Effect of oxygenenriched atmospheres on storage quality of packaged fresh meat[J]. Journal of Food Science, 1971, 36(7): 1011-1014.
[3] EILERT S J. New packaging technologies for the 21stcentury[J]. Meat Science, 2005, 71(1): 122-127.
[4] SEYFERT M, HUNT M C, MANCINI R A, et al. Beef quadriceps hot boning and modified-atmosphere packaging influence properties of injection-enhanced beef round muscles[J]. Journal of Animal Science, 2005, 83(3): 686-693.
[5] MARIBO H, OLSEN E V, BARTON-GADE P, et al. Effect of early post-mortem cooling on temperature, pH fall and meat quality in pigs[J]. Meat Science, 1998, 50(1): 115-129.
[6] WARRISS P D, BROWN S N. The relationships between initial pH, reflectance and exudation in pig muscle[J]. Meat Science, 1987, 20(1): 65-74.
[7] Van LAACK R L J M, KAUFMAN R G, SYBESMA W, et al. Is colour brightness (L-value) a reliable indicator of water-holding capacity in porcine muscle?[J]. Meat Science, 1994, 38(2): 193-201.
[8] JOO S T, KAUFFMAN R G, KIM B C, et al. The relationship of sarcoplasmic and myofibrillar protein solubility to colour and waterholding capacity in porcine longissimus muscle[J]. Meat Science, 1999, 52(3): 291-297.
[9] HAMILTON D N, ELLIS M, MILLER K D, et al. The effect of the Halothane and Rendement Napole genes on carcass and meat quality characteristics of pigs[J]. Journal of Animal Science, 2000, 78(11): 2862-2867.
[10] KRISTENSEN L, PURSLOW P P. The effect of aging on the waterholding capacity of pork: role of cytoskeletal proteins[J]. Meat Science, 2001, 58(1): 17-23.
[11] MARIBO H, OLSEN E V, BARTON-GADE P, et al. Effect of early post-mortem cooling on temperature, pH fall and meat quality in pigs[J]. Meat Science, 1998, 50(1): 115-129.
[12] OFFER G, KNIGHT P. The structural basis of water-holding capacity in meat. Part 1: general principles and water uptake in meat processing [M]//LAWRIE R. Developments in Meat Science. New York: Elsevier Applied Science, 1988: 61-171.
[13] BRUNDUM J, MUNCK L, HENCKEL P, et al. Prediction of waterholding capacity and composition of porcine meat by comparative spectroscopy[J]. Meat Science, 2000, 55(2): 177-185.
[14] 姜晓文, 韩剑众. 生鲜肉品持水性的核磁共振研究[J]. 食品工业科技, 2009, 30(1): 322-324.
[15] 毛希安. NMR前沿领域的若干新进展[J]. 北京: 化学通报, 1997, 12 (2): 13-161.
[16] 夏佑林, 吴季辉, 刘琴, 等. 生物大分子多维核磁共振[M]. 合肥: 中国科学技术大学出版社, 1999: 33-371.
[17] 田建广, 夏照帆, 杜择涵. 生物核磁共振[M]. 上海: 第二军医大学出版社, 2001: 20-301.
[18] 赵喜平. 核磁共振成像[M]. 北京: 科学出版社, 2004: 158-176.
[19] HAZLEWOOD C B, CHANG D, NICHOLS B, et al. Nuclear Magnetic resonance transverse relaxation times of water protons in skeletal muscle [J]. Biophysical Journal, 1974, 14(8): 583-604.
[20] BERTRAM H C, DONSTRUP S, KARLSSON A H, et al. Continuous distribution analysis ofT2relaxation in meat-an approach in the determination of water-holding capacity[J]. Meat Science, 2002, 60(3): 279-285.
[21] 姜晓文, 韩剑众. 生鲜猪肉持水性的核磁共振研究[J]. 食品工业科技, 2009, 30(7): 128-130;133.
[22] BERTRAM H C, STRAADT I K, JENSEN J A, et al. Relationship between water mobility and distribution and sensory attributes in pork slaughtered at an age between 90 and 180 days[J]. Meat Science, 2007, 77(2): 190-195.
[23] JAYASINGH P, CORNFORTH D P, BRENNAND C P, et al. Sensory evaluation of ground beef stored in high-oxygen modified atmosphere packaging[J]. Journal of food science, 2002, 67(9): 3493-3496.
[24] O,GRADY M N, MONAHAN F J, BURKE R M, et al. The effect of oxygen level and exogenous a-tocopherol on the oxidative stability of minced beef in modified atmosphere packs[J]. Meat Science, 2000, 55(1): 39-45.
[25] 邹思湘. 动物生物化学[M]. 北京: 中国农业出版社, 2005: 110.
[26] KIM Y H, KEETON J T, YANG H S, et al. Color stability and biochemical characteristics of bovine muscles when enhanced withL- orD-potassium lactate in high-oxygen modified atmospheres[J]. Meat Science, 2009, 82(2): 234-240.
[27] LAMBERT T H, NIELSEN J H, ANDERSEN H J, et al. Cellular model of induction for drip loss in meat[J]. Journal of Agricultural& Food Chemistry, 2001, 49(10): 4876-4883.
[28] CHEAH K S, CHEAH A M, WARRING J C. Phospholipase A2activity, calmodulin, Ca2+and meat quality in young and adult halothanesensitive and halothane-insensitive British Landrace pigs[J]. Meat Science, 1986, 17(1): 37-53.
[29] 陈韬. 宰后肌肉蛋白质和组织结构变化与冷却猪肉持水性的关系研究[D]. 南京: 南京农业大学, 2005: 11.
Effects of High Oxygen Modified Atmosphere Packaging and Vacuum Packaging on Water-Holding Capacity and Lipid Oxidation of PorcineLongissimus dorsiduring Chilled Storage
YUAN Lu1,2,GAO Feng1,2,ZHOU Guang-hong2,*
(1. College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;2. Key Laboratory of Meat Processing and Quality Control, Ministry of Education, Key Laboratory of Animal Products Processing and Quality Control, Ministry of Agriculture, Nanjing Agricultural University, Nanjing 210095, China)
The effects of high-oxygen modified atmosphere packaging (80% O2 + 20% CO2) and vacuum packaging on the waterholding capacity of porcineLongissimus dorsiwere investigated. Drip loss, cooking loss, water distribution, MDA, phospholipase A2activity were measured and their correlations were analyzed. Vacuum packaging could result in reduced water-holding capacity, and increased MDA content and phospholipase A2 activity on the 6thday. High-oxygen modified atmosphere packaging provided higher MDA content and phospholipase A2 activity than vacuum packaging on the 9thday. The correlation coefficients of MDA with drip loss, cooking loss andT22 area ratio were 0.642, -0.521, -0.987 and 0.786, respectively. Therefore, high-oxygen modified atmosphere packaging is a better system than vacuum packaging and can provide longer shelf life. The better system can affect the water-holding capacity of pork by influencing lipid oxidation and phospholipase A2 activity.
vacuum packaging;high-oxygen modified atmosphere packaging;water-holding capacity;lipid oxidation;phospholipase activity
TS251.5
A
1002-6630(2012)18-0307-05
2011-06-23
袁璐(1988—),女,硕士研究生,主要从事动物营养与肉品品质方面的研究。E-mail:2009105077@njau.edu.cn
*通信作者:周光宏(1960—),男,教授,博士,主要从事肉品质量控制研究。E-mail:ghzhou@njau.edu.cn

