高效液相色谱法测定紫菜中牛磺酸含量
王 芬,张 婷,顾振新,陈志刚*
(南京农业大学食品科技学院,农业部农畜产品加工与质量控制重点开放实验室,江苏 南京 210095)
高效液相色谱法测定紫菜中牛磺酸含量
王 芬,张 婷,顾振新,陈志刚*
(南京农业大学食品科技学院,农业部农畜产品加工与质量控制重点开放实验室,江苏 南京 210095)
采用高效液相色谱(HPLC)法测定紫菜中牛磺酸含量。用邻苯二甲醛进行柱前衍生,以XDB C18 (150mm ×4.6mm,5μm)色谱柱为分析柱,甲醇- pH5.3醋酸盐缓冲液(30:70)为流动相,流速1.0mL/min,检测波长315nm,温度30℃。牛磺酸质量浓度在5.0~300.0μg/mL范围内线性关系良好(R2=0.9991),平均回收率(n=6)为98.8%,相对标准偏差为1.8%,衍生物在15min内的稳定性良好,最低检出限0.25μg/mL。用本研究建立的HPLC法测定紫菜中牛磺酸含量为(1.04±0.07)%(干质量)。用此方法测定牛磺酸含量不受紫菜中其他成分干扰,简单、快速、专属性强,灵敏度高,结果准确、可靠。
高效液相色谱;柱前衍生;牛磺酸;紫菜
牛磺酸(β-氨基乙磺酸)为一种非蛋白质氨基酸,是婴幼儿生长发育过程中的一种必需氨基酸[1-2]。牛磺酸具有特殊的生理功能,可以促进大脑细胞发育、提高免疫力、缓解疲劳、调节神经传导,还有消炎、解热、镇痛、抗病毒等生物活性[3-6]。目前,国家已经将牛磺酸列为强化营养保健的食品添加剂[7],其作为一种优良的食品添加剂,正日益广泛应用于食品和饮料行业中[7-9]。牛磺酸主要以游离形式存在于动物组织(尤其是海洋贝类动物)中,但并未结合进蛋白质中;植物组织中很少含有牛磺酸[10-11]。本课题组对紫菜成分研究发现条斑紫菜中含有丰富的牛磺酸。
目前,国内外测定牛磺酸主要方法有滴定法、比色法、薄层扫描法、氨基酸自动分析法及高效液相色谱(high performace liquid chromatography, HPLC)法等[12-15]。滴定法、薄层扫描法和比色法容易受到其他氨基酸的干扰,误差相对较大;氨基酸自动分析法因价格昂贵限制使用范围;高效液相色谱法因精确度、灵敏度较高,样品处理比较简单,能够快 速进行样品分析而被广泛地应用。高效液相色谱法有柱前衍生和柱后衍生2种,后者需要柱后衍生器等专用设备[13-15]。鉴于以上测定方法优缺点,本研究采用柱前衍生法,以邻苯二甲醛(OPA)作为衍生试剂,3-巯基丙酸作为保护剂,首次测定紫菜中牛磺酸含量。
1 材料与方法
1.1 材料与试剂
条斑紫菜样品 连云港金海地食品公司;牛磺酸标样、邻苯二甲醛(OPA)及3-巯基丙酸 美国Sigma-Aldrich公司;甲醇(色谱纯) 中国医药集团上海化学试剂公司;乙酸钠、硼酸四硼酸钠、冰乙酸均为国产分析纯。
1.2 仪器与设备
1200高效液相色谱仪系统(配有可变波长紫外检测器和色谱工作站) 美国安捷伦公司;UV-2450紫外-可见分光光度计 日本岛津公司。
1.3 样品预处理
条斑紫菜样品处理:取10g样品,粉碎,按1:30比例加水,80℃浸提8h,用4层纱布过滤,离心(6000r/ min)得紫菜上清液。吸取3mL紫菜提取液于10mL离心管中。逐滴滴加1mol/L NaOH溶液,调pH值至中性,待衍生用。
1.4 溶液配制
硼酸钠缓冲溶液配制:称取2.48g硼酸和1.41g氢氧化钠,用水溶解定容至100mL,制成0.4mol/L硼酸钠缓冲溶液;OPA衍生剂溶液配制:取OPA 50mg,加入2mL甲醇、50μL 3-巯基丙酸,以0.4mol/L硼酸盐缓冲液定容至10mL,混匀,4℃避光保存。
1.5 检测波长的确定
牛磺酸在碱性条件下与衍生试剂反应,生成的衍生物紫外吸收。经测定牛磺酸衍生物在315nm处有最大吸收峰,因此采用315nm作为检测波长。
1.6 色谱条件
色谱柱:XDB C18(150mm×4.6mm,5μm);流动相:甲醇-pH5.3醋酸盐缓冲液(30:70,V/V);流速:1.0mL/min;进样量:20μL;检测波长:315nm;温度:2 5℃。
1.7 测定方法
精密称取牛磺酸50mg,加超纯水溶解后定容至10mL,于4℃保存、备用。将配制好的牛磺酸母液5mg/ mL经稀释配制系列浓度的梯度溶液,以蒸馏水为空白对照。分别吸取600μL,置于1.5mL离心管中,加入衍生试剂600μL,混合2min,用0.45μm微孔滤膜过滤,取20μL续滤液进样分析。以峰面积为纵坐标,质量浓度为横坐标,绘制标准曲线,得到回归方程。
2 结果与分析
2.1 专属性试验
为考察HPLC测定紫菜中牛磺酸的分离效能及干扰情况,取空白溶液、标样牛磺酸溶液及供试样品溶液分别按照1.7节方法操作,记录色谱图,结果如图1所示。空白溶液在牛磺酸衍生物相应位置无色谱峰出现,不干扰牛磺酸的含量测定(图1A),牛磺酸衍生物的保留时间约为8.8min(图1B),用此方法测定牛磺酸含量也不受紫菜中其他成分干扰(图1C),在当前液相条件下,分离状况良好。
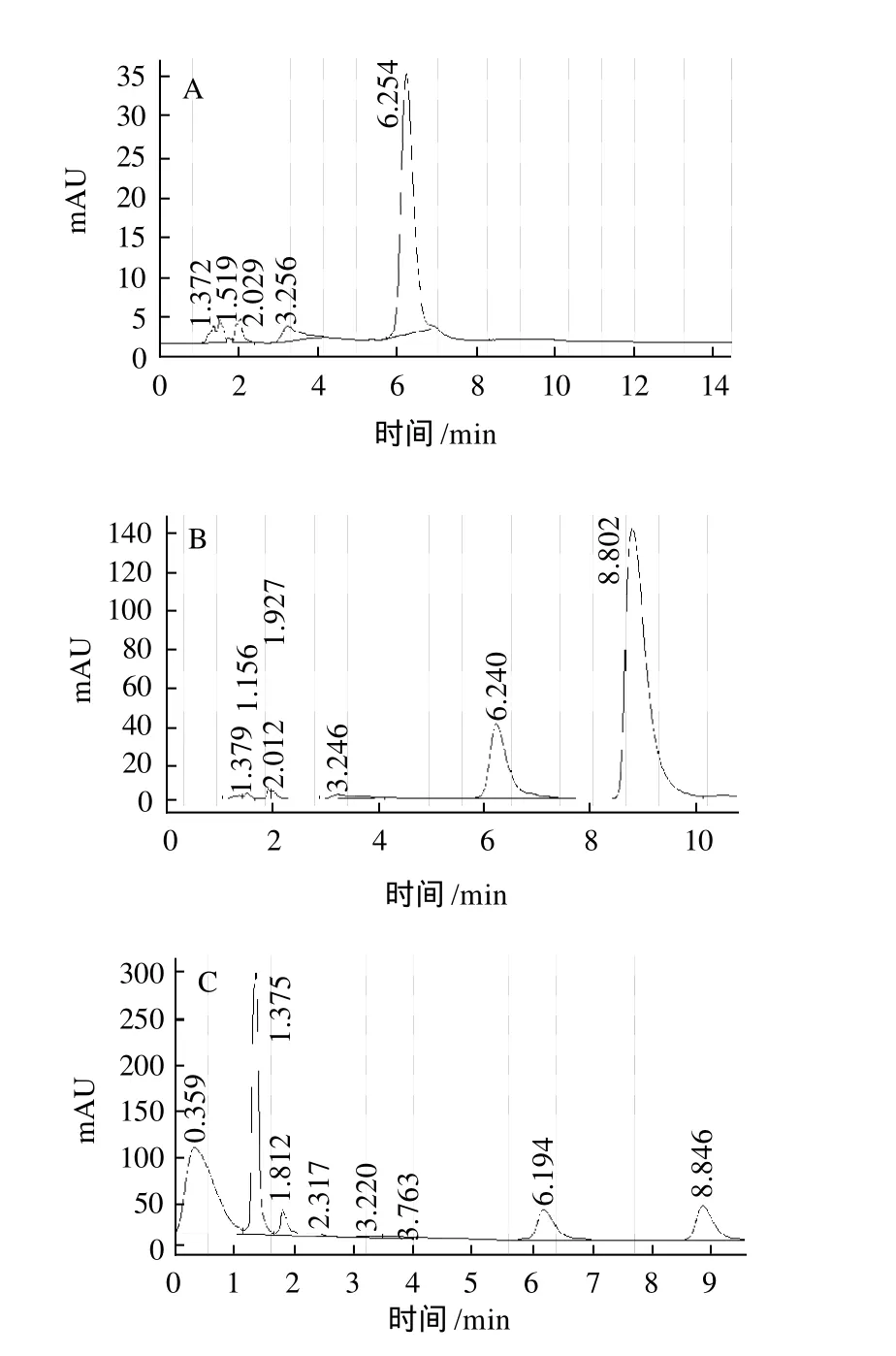
图1 空白试样(蒸馏水)(A)、牛磺酸标品(B)和样品溶液(C)衍生化色谱图Fig.1 HPLC chromatograms of blank sample, taurine standard and derivatized taurine
2.2 线性关系考察
取一系列牛磺酸标品进行测定,结果表明,牛磺酸在5~300μg/mL范围内线性关系良好,回归方程:Y=16.314X+89.79,R2=0.9991。取牛磺酸对照品溶液进行稀释,当信噪比大于10,得最低检出限为0.25 μg/mL,此方法灵敏度较高。
2.3 回收率测定
同一样品分别加入不同量的牛磺酸标样,按照1.7节方法操作测定加样回收率,详见表1。结果表明,此方法平均加样回收率为98.8%,相对标准偏差(relative standard deviation,RSD)值为1.8%。
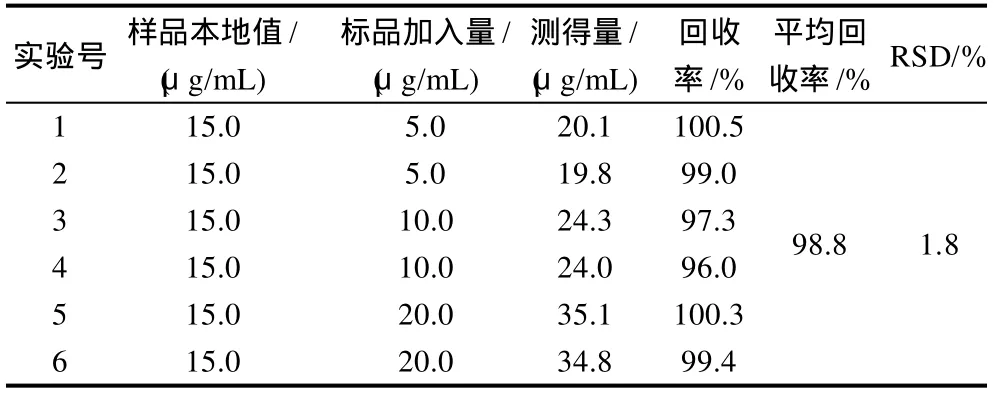
表1 加标回收率实验Table 1 Results of spike recovery tests
2.4 精密度测定
将20μg/mL对照品溶液按1.7节操作方法处理后取50μL注入液相色谱仪,连续进样5次,记录其主色谱峰的峰面积(表2),由表2可知,用此方法测定牛磺酸含量精密度较好,RSD为1.5%。
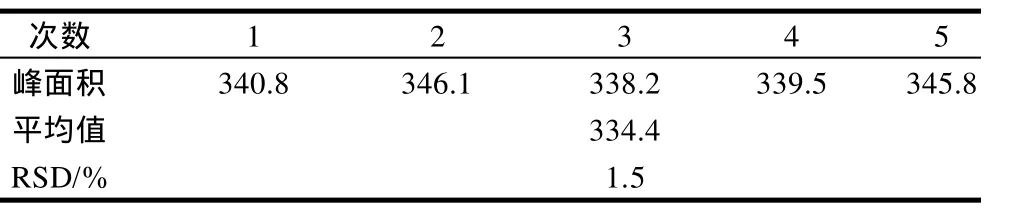
表2 精密度实验Table 2 Results of precision tests
2.5 稳定性实验
将20μg/mL对照品溶液按1.7节方法处理,分别在0、5、10、15min取50μL各进样,记录主色谱峰的峰面积。结果表明牛磺酸衍生物在15min内稳定性良好(RSD值为2.49%)。
2.6 紫菜样品中牛磺酸含量测定
紫菜样品经处理后按1.7节操作方法处理后操作,测得牛磺酸出峰时间约为8.8min(图/c)。重复3次测定,将衍生物峰面积(Y)代入直线回归方程,计算样品中牛磺酸含量为(1.04±0.07)%(干质量)。
3 讨 论
本研究采用HPLC法测定紫菜中牛磺酸含量。因为牛磺酸无紫外吸收,因此须经衍生才能产生紫外吸收。本实验采用甲醇-醋酸盐缓冲液体系测定紫菜中牛磺酸含量,对多种不同流动相比例进行比较,最终确定流动相为甲醇- pH5.3醋酸盐缓冲液(30:70,V/V),色谱分离效果较好,牛磺酸衍生物保留时间适当。对衍生化处理后的牛磺酸溶液在200~400nm波长范围内进行紫外扫描,结果在315nm波长处有最大吸收,故确定315nm为本实验检测波长。以本方法测定紫菜试样只需简单预处理就可以衍生反应,而后取样分析,并且分析时间短,灵敏度较高。由于牛磺酸衍生物的稳定时间相对较短,实验中必须严格控制衍生反应时间。
[1] 刘辉, 金玉兰. 牛磺酸研究的进展[J]. 国外医学: 妇幼保健分册, 2002, 13(l): 40-41.
[2] 赵振宇, 张韻慧. 牛磺酸药理作用的研究新进展[J]. 中国医院药学杂志, 2009, 29(16): 1390-1393.
[3] 白小琼, 孔德义. 牛磺酸研究进展[J]. 中国食物与营养, 2011, 17(5): 78-80.
[4] WARD R J, LALLEMAND F, De WITTE P, et al. Anti-inflammatory actions of a taurine analogue, ethanebeta-sultam, in phagocytic cells,in vivoandin vitro[J]. Biochemical Pharmacology, 2011, 81(6): 743-751.
[5] YEH T S, CHAN K H , HSU M C, et al. Supplementation with soybean peptides, taurine, pueraria isoflavone, and ginseng saponin complex improves endurance exercise capacity in humans[J]. Journal of Medicinal Food, 2011, 14(3): 219-225.
[6] MARINNE K, JURGEN L, GERO B, et al. Assignment of overlapping1H-NMR signals in carp seminaol plasma by proton-detected 2D-C,H correlation spectroscopy[J]. Biochemical and Biophysical Research Communication, 2000, 269(1): 76-80.
[7] 国家乳制品质量监督检验中心. GB 5413.26—1997婴幼儿食品和乳粉牛磺酸的测定[S]. 北京: 中国标准出版社, 1997.
[8] CAMPAGNOL P C B, DOS SANTOS B A, MORGANO M A, et al. Application of lysine, taurine, disodium inosinate and disodium guanylate in fermented cooked sausages with 50% replacement of NaCl by KCl[J]. Meat Science, 2011, 87(3): 239-243.
[9] CHANG Y Y, CHOU C H, CHIU C H, et al. Preventive effects of taurine on development of hepatic steatosis induced by a high-fat/cholesterol dietary habit[J]. Journal of Agricultural and Food Chemistry, 2011, 59 (1): 450-457.
[10] 汤志方. 海洋生物中牛磺酸的提取及分析[M]. 青岛: 青岛科技大学, 2005.
[11] 牛艳. 宁夏拘祀有效成分及其与生态因子关系的研究[M]. 银川: 宁夏大学, 2005.
[12] GHANDFOROUSH-SATTARI M, MASHAYEKHI S, NEMATI M, et al. A rapid determination of taurine in human plasma by LC[J]. Chromatographia, 2009, 69(11/12): 1427-1430.
[13] CHEN Zhi, CHEN Bo, YAO Shouzhuo. High-performance liquid chromatography electrospray ionization-mass spectrometry for simultaneous determination of taurine and 10 water-soluble vitamins in multivitamin tablets[J]. Analytica Chimica Acta, 2006, 569(1/2): 169-175.
[14] 张晾, 耿越, 张静静, 等. 高效液相色谱法快速测定海产品中牛磺酸[J]. 食品与药品, 2006, 8(4): 56-58.
[15] YOSHIYUKI S, TAKAOMI T, KATSUHIRO Y. Determination of taurine in energy drinks by hplc using a pre-column derivative[J]. Journal of Health Science, 2008, 54(6): 661-664.
Determination of Taurine in Porphyra yzoensis by High Performance Liquid Chromatography
WANG Fen,ZHANG Ting,GU Zhen-xin,CHEN Zhi-gang*
(Key Laboratory of Agricultural and Animal Products Processing and Quality Control, Ministry of Agriculture, College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
An HPLC method was proposed to determine the content of taurine in Porphyra yzoensis. Taurine was subjected to pre-column derivatization with OPA. The separation was performed on a XDB C18 (150 mm × 4. 6 mm, 5μm) using a mobile phase composed of methanol and pH 5.3 sodium acetate buffer (43:57) at a flow rate of 1 mL/min. Taurine was detected at a 315 nm wavelength. The column temperature was set at 30 ℃. Taurine was well separated with a good linear relationship in the range of 5.0-300.0μg/mL (R2= 0.9991). The average recovery was 98.8% (n=6) with a relative standard deviation of 1.8%. The taurine derivative was stable within 15 min. The limit of detection for taurine was 0.25μg/mL. The propose HPLC method was successfully applied to determine taurine in Porphyra yzoensis with a result of 1.04% ± 0.07% (dry wt). This method was interference-free, simple, rapid, specific, sensitive, accurate and reliable.
high performance liquid chromatography;pre-column derivatization;taurine;Porphyra yzoensis
TS201.7;S985.42
A
1002-6630(2012)18-0162-03
2011-08-02
中央高校基本科研业务费专项(KYZ201002);教育部博士点(新教师)基金项目(200803071026);江苏省自然科学基金项目(BK2009313)
王芬(1991-),女,硕士研究生,研究方向为食品生物技术。E-mail:847543640@qq.com
*通信作者:陈志刚(1971-),男,副教授,博士,研究方向为食品科学、生物催化与生物转化。E-mail:zgchen@njau.edu.cn

