CD34+CD38-Lin-细胞群单个细胞培养的初步研究
韩有金,齐军元,邱录贵
中国医学科学院 北京协和医学院 血液学研究所 血液病医院实验血液学国家重点实验室,天津300020
干细胞是近年来医学生物学领域内的研究热点之一,其中很大一部分研究成果集中在造血干细胞。干细胞的重要特性是具有自我更新能力、较强的增殖能力以及多向分化潜能[1]。这些生物学特性的维持和生物学行为的发生依赖于一些关键的信号通路,如 Hedgehog[2]、BMP[3]、Notch[4]通路。这些信号通路中的关键信号分子在造血干细胞中的作用一直是研究人员关注的重点。本研究在单个CD34+CD38-Lin-细胞水平上分别就上述通路的一些关键信号分子如Shh、BMP-4、Jagged-1对于CD34+CD38-Lin-细胞群体的自我更新、增殖扩增、定向分化的影响进行研究。
材料和方法
材料与试剂足月健康新生儿脐带血6份,每份100 ml,经产妇及家属书面同意用于本研究。淋巴细胞分离液,密度1.073 g/ml;Lin-磁珠分离试剂盒、Mini MACS分离器、LS和MS分离柱 (德国Miltenyi Biotec公司),7-氨基放线菌素D(7-aminoactinomycin D,7-AAD)细胞凋亡染色试剂盒 (以色列FERMENTEK公司),鼠抗人CD34和CD38,流式细胞仪 (美国BD公司),干细胞培养基、人造血干细胞甲基纤维素培养基MethoCult H4434(StemCell公司)。
CD34+CD38-Lin-细胞分选取足月健康新生儿脐带血,分离出其中的干细胞即CD34+CD38-Lin-细胞,具体步骤简述如下:经Fincoll分离得到单个核细胞,然后经免疫磁珠法先分离出其中的Lin-细胞群,再分离出上一步中所得细胞的CD34+细胞群,最终得到CD34+CD38-Lin-细胞群。用流式细胞术分析所得细胞的存活率及细胞纯度。
单个CD34+CD38-Lin-细胞生存能力检测取分离后的CD34+CD38-Lin-细胞,用流式细胞仪将其以单个形式加入到事先加好干细胞培养基的96孔板中。按照加入细胞因子的不同,以Shh、BMP-4、Jagged-1作为实验组,未添加细胞因子的以等量PBS作为对照组。1周内在倒置荧光显微镜下观察各组细胞的存活及增殖情况。
单个CD34+CD38-Lin-细胞增殖能力检测取分离后的CD34+CD38-Lin-细胞,用流式细胞仪将其以单个形式加入到事先加好干细胞培养基的96孔板中。按照加入细胞因子的不同,以BMP-4、Jagged-1作为实验组,未添加细胞因子的以等量PBS作为对照组。1周后计数各组细胞的每孔细胞数。
单个CD34+CD38-Lin-细胞集落形成分析用流式细胞仪将分离后的CD34+CD38-Lin-细胞以单个形式加入到事先加好甲基纤维素培养基的96孔板中。按照加入细胞因子的不同,以BMP-4、Jagged-1作为实验组,未添加细胞因子的以等量PBS作为对照组。1周后观察计数各组细胞形成红系爆式集落形成单位 (erythroid colony-forming unit,BFU-E)、粒系集落形成单位 (granulocyte colony-forming unit,CFU-G)、单核细胞系集落形成单位 (macrophage colony-forming unit,CFU-M)、粒单系集落形成单位(granulocyte macrophage colony-forming unit,CFU-GM)等各式集落的情况。
统计学处理单个脐血CD34+CD38-Lin-液体培养7 d后,计数有活细胞的培养孔数,并计算有活细胞培养孔中的活细胞平均数。
结 果
CD34+CD38-Lin-细胞群的分离用7-AAD阴性和侧向角 (side scatter,SSC)两个参数设门,以免流式细胞仪分选到死亡细胞 (图1A);再用流式细胞仪分选CD34+CD38-Lin-细胞 (图1B)。
培养1周内单个CD34+CD38-Lin-细胞的生存及倍增在培养第3天,各组均能看到单个CD34+CD38-Lin-细胞的分裂倍增现象;而在第7天能看到细胞进一步增殖 (图2)。培养7 d后,计数每份脐带血来源CD34+CD38-Lin-对照组和实验组有活细胞的培养孔,计算有活细胞孔占第0天接种了细胞的培养孔的比率。第2份脐血来源CD34+CD38-Lin-细胞培养结束后,发现Shh组有活细胞孔比率虽然高于对照组,但低于BMP-4和Jagged-1组 (图3),故在后4份脐带血来源CD34+CD38-Lin-细胞的培养中去掉了Shh组。
培养1周后干细胞的增殖培养1周后,计数各组每孔细胞数,并计算各组平均每孔的细胞数,对照组为5.465个细胞/孔,BMP-4组为6.295个细胞/孔,Jagged-1组为6.784个细胞/孔。每孔细胞数量的柱形分布图显示实验组中每孔细胞数量为0的孔数明显低于对照组,尤其是Jagged-1组,而实验组每孔细胞数量多于17的孔数高于对照组,其中BMP-4组最高 (图4)。
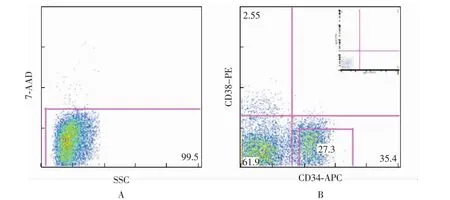
图1 流式细胞仪分选CD34+CD38-Lin-细胞群的设门过程Fig 1 Gating of viable CD34+CD38-Lin-cells
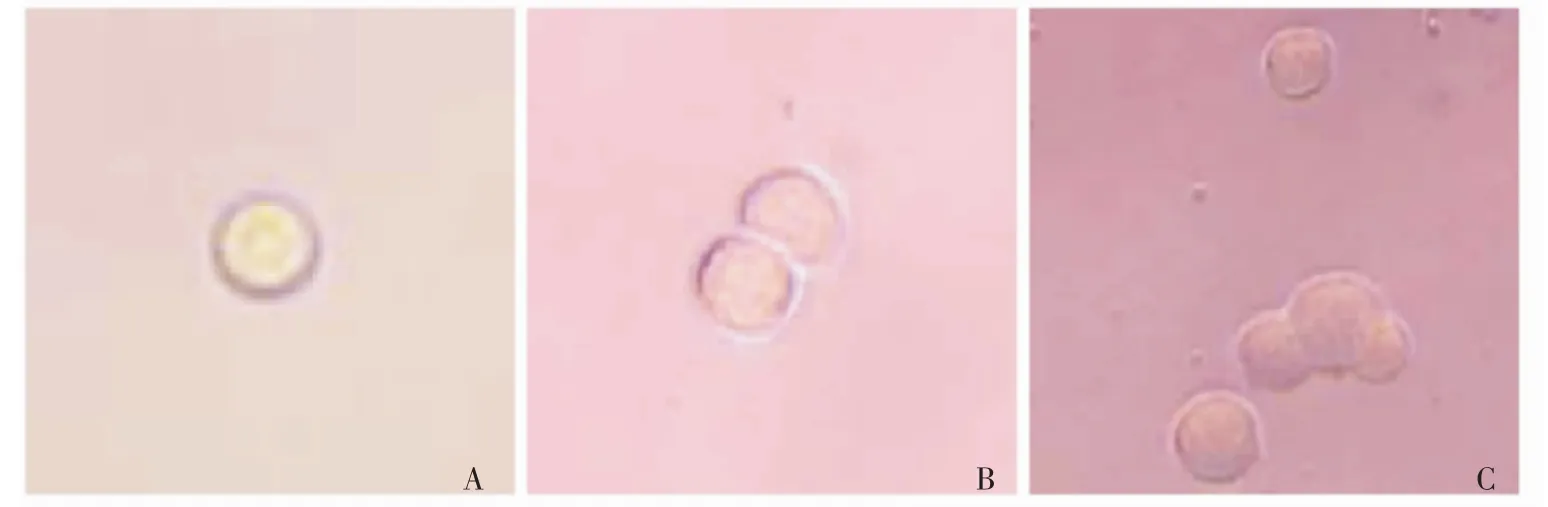
图2 培养1周内单个CD34+CD38-Lin-细胞的生存及增殖情况Fig 2 Single CD34+CD38-Lin-cell viability and proliferation from one culture well
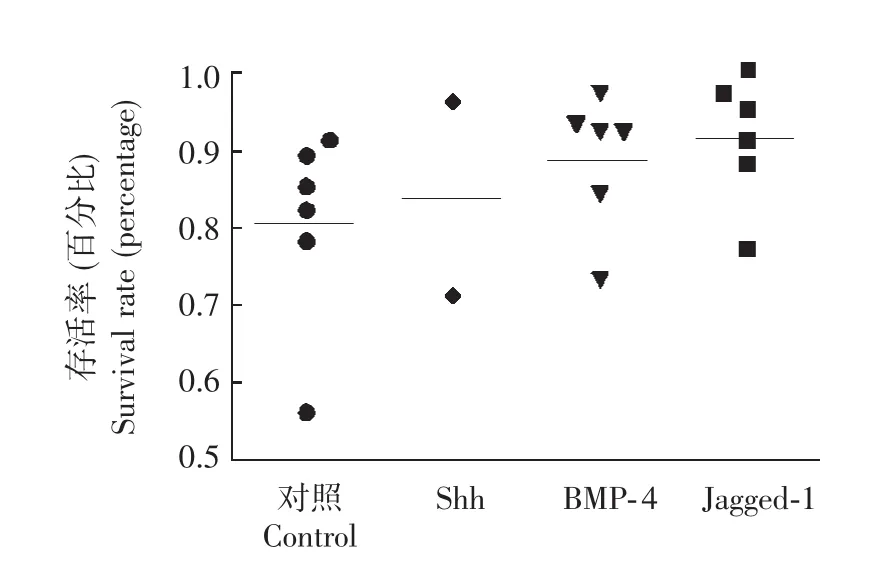
图3 培养1周后各组细胞的存活率Fig 3 Survival rates of wells with vital cells for each sample of umbilical cord blood after one-week liquid culture

图4 培养1周后具有一定数量活细胞孔占有活细胞孔比率的柱形分布图Fig 4 Percentage distribution of wells with certain number of viable cells out of total wells with viable cells
细胞集落形成经集落形成培养1周后,发现各组细胞均能形成包括 BFU-E、CFU-G、CFU-M、CFU-GM的各式集落 (图5)。但是每孔细胞均只能形成一种集落。实验组的每孔集落数明显高于对照组,实验组之间的差异并不明显 (图6)。
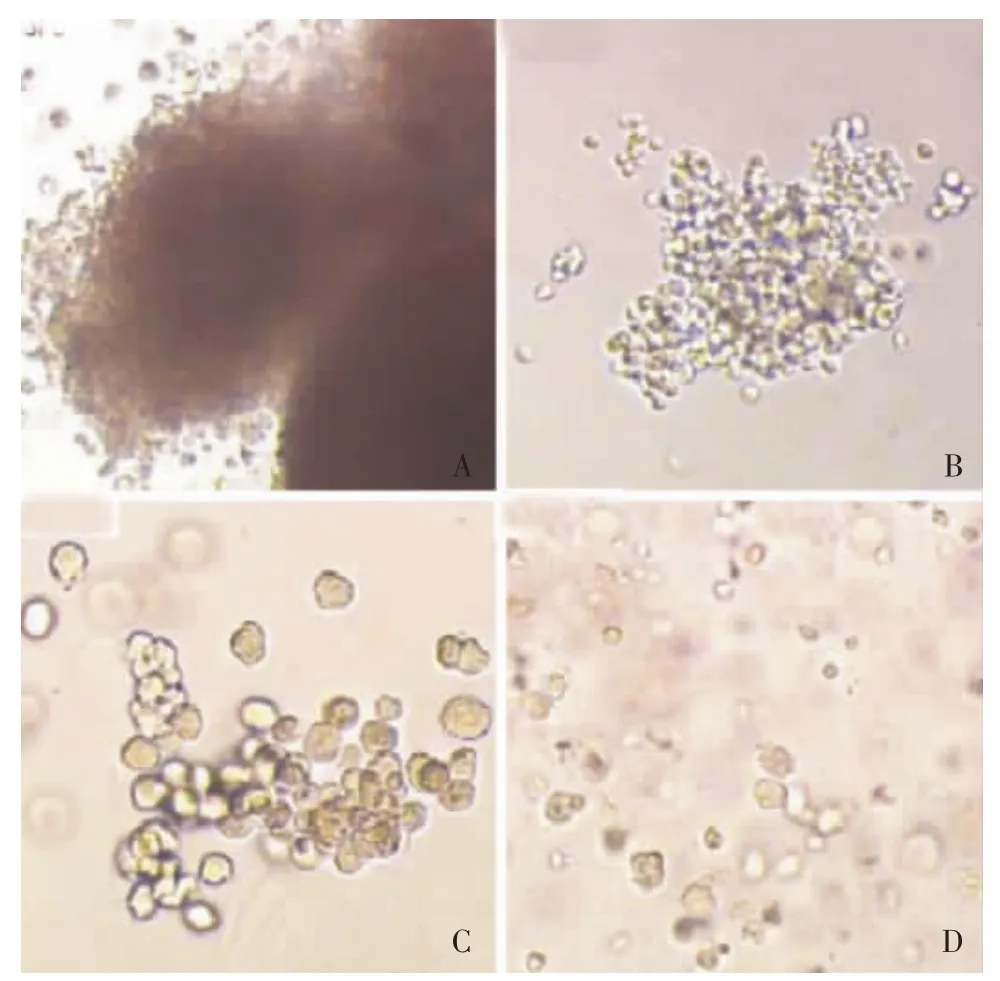
图5 培养1周后CD34+CD38-Lin-细胞形成的各式集落Fig 5 Colonies formed by cell(s)after liquid culture of 1 week from single CD34+CD38-Lin-cell initially seeded

图6 CD34+CD38-Lin-细胞液体培养1周后形成的集落数Fig 6 Total number of colonies formed by CD34+CD38-Lincells after 1-week liquid culture
讨 论
通常认为,干细胞的命运的主要是由干细胞龛或说是其所处的微环境决定的,这个微环境主要包括一些周围基质细胞和干细胞本身所分泌的细胞因子和生长因子等[5]。早在 1978 年,Schofield[6]就发现脾脏来源的造血细胞的增殖能力比骨髓中的造血干细胞显著下降,因而提出了干细胞龛理论,认为干细胞的干细胞性,即自我更新能力和定向分化能力依赖于干细胞龛,干细胞龛能精确调节真正干细胞和定向祖细胞的平衡。其后不断有研究人员通过实验证实该理论[7-10]。干细胞的自我更新、增殖扩增以及定向分化需要微环境的调节[11-12],并且与多种细胞信号通路有关[13]。但最近有研究表明干细胞在不依赖微环境的单细胞状态下也能向多系分化[14],说明其内部因素也发挥了非常重要的作用。
为了探讨造血干细胞的自我更新、增殖与分化在多大程度上依赖于体内的微环境,或者细胞本身的遗传因素是否更为重要,本研究分离培养新生儿脐带血中被证明含有造血干细胞的CD34+CD38-Lin-细胞群体[15],通过在不同条件的培养体系中进行单细胞水平的培养和集落形成实验,来研究造血干细胞的生物学特性。
本研究从新生儿脐带血中成功分离出CD34+CD38-Lin-细胞群,流式细胞术检测表明其活性很好,纯度也比较高,保证了进行下一步实验的可靠性。
随后利用流式细胞仪将所分离的CD34+CD38-Lin-细胞进行培养,且每天观察其生长情况,结果发现在培养的第3天,不管是空白对照组还是分别加入了相同浓度的细胞因子Shh组、BMP-4组和Jagged-1组,都出现了细胞的分裂增殖现象。而培养1周后计数,细胞进一步增殖变多,实验组细胞数量普遍明显多于对照组,说明含有造血干细胞的CD34+CD38-Lin-细胞群的增殖并不完全取决于外部微环境,细胞内部的遗传因素在其中起决定性作用;而实验组的细胞数量普遍较多,说明微环境尤其是细胞信号通路分子确实对于CD34+CD38-Lin-细胞(含有造血干细胞)的生存及自我更新有重要作用。
接下来的单细胞水平的集落形成实验则是为了研究CD34+CD38-Lin-细胞的分化能力与微环境及其自身内部遗传因素的关系。经集落形成培养1周后,本研究发现各组细胞都能形成包括BFU-E、CFU-G、CFU-M、CFU-GM在内的各式集落,但每孔细胞均只能够形成一种集落。这个结果可能由两方面的原因所导致:一方面可能是分离得到的CD34+CD38-Lin-细胞群中没有具有干细胞性的造血干细胞,而仅仅包含已经定向的祖细胞;另一方面可能是造血干细胞在单细胞水平下分裂增殖时丧失了干细胞性,所得到的子代细胞均为定向祖细胞,只具有单能性,不具有全能性。而要保持干细胞的生物学特性,则必须由外部信号分子和细胞内部分子相互作用,需要干细胞与外部微环境进行交流,从而调控干细胞的自我更新和增殖分化的平衡。这种可能性最近被 Sarrazin 等[16]和 Rieger等[17]的研究所证实。
总之,造血干细胞的生物学特性与微环境关系非常密切;其内部的遗传机制对造血干细胞的存活与增殖起决定性作用,外部因素起到促进作用,微环境中的细胞因子尤其是信号分子能极大提高干细胞的存活和增殖能力,干细胞生物学特性的保持尤其是全能性的保持严重依赖于与外界微环境的信息交流。本研究结果对白血病的治疗有一定的启示作用,白血病干细胞有可能依赖于微环境实现自我更新而保持干细胞性,因此治疗应针对其存活的微环境,从切断其与微环境的信息交流入手。
[1]Zhang H,Wang ZZ.Mechanisms that mediate stem cell selfrenewal and differentiation[J].J Cell Biochem,2008,103(3):709-718.
[2]Trowbridge JJ,Scott MP,Bhatia M.Hedgehog modulates cell cycle regulators in stem cells to control hematopoietic regeneration [J].PNAS,2006,103(38):14134-14139.
[3]Sadlon TJ,Lewis ID,D'Andrea RJ.BMP4:its role in development of the hematopoietic system and potential as a hematopoietic growth factor [J].Stem Cells,2004,22(4):457-474.
[4]Gering M,Patient R.Notch in the Niche[J].Cell Stem Cell,2008,2(4):293-294.
[5]Scadden DT.The stem-cell niche as an entity of action [J].Nature,2006,441(7097):1075-1079.
[6]Schofield R.The relationship between the spleen colonyforming cell and the haemopoietic stem cell [J].Blood Cells,1978,4(1-2):7-25.
[7]Xie T,Spradling AC.A niche maintaining germ line stem cells in the Drosophila ovary [J].Science,2000,290(5490):328-330.
[8]Kiger AA,White-Cooper H,Fuller MT.Somatic support cells restrict germline stem cell self-renewal and promote differentiation [J].Nature,2000,407(6805):750-754.
[9]Zhang J,Niu C,Ye L,et al.Identification of the haematopoietic stem cell niche and control of the niche size [J].Nature,2003,425(6960):836-841.
[10]Rieger MA,Hoppe PS,Smejkal BM,et al.Hematopoietic cytokines can instruct lineage choice [J].Science,2009,325(5937):217-218.
[11]Fuchs E,Tumbar T,Guasch G.Socializing with the neighbors:stem cells and their niche [J].Cell,2004,116(6):769-778.
[12]Li L,Xie T.Stem cell niche:structure and function [J].Annu Rev Cell Dev Biol,2005,21:605-631.
[13]Heasley LE,Petersen BE.Signalling in stem cells[J].EMBO,2004,5(3):241-244.
[14]Voog J,Jones DL.Stem cells and the niche:a dynamic duo[J].Cell Stem Cell,2010,6(2):103-115.
[15]Gallacher L,Murdoch B,Wu DM,et al.Isolation and characterization of human CD34-Lin-hematopoietic stem cells using cell surface markers AC 133 and CD7 [J].Blood,95(9):2813-2820.
[16]Sarrazin S,Mossadegh-Keller N,Fukao T,et al.MafB restricts M-CSF-dependent myeloid commitment divisions of hematopoietic stem cells [J].Cell,2009,138(2):300-313.
[17]Rieger MA,Hoppe PS,Smejkal BM,et al.Hematopoietic cytokines can instruct lineage choice [J].Science,2009,325(5937):217-218.

