应用磁共振弥散张量成像诊断大鼠锥体束损伤
李上勋,山 黛,段祎杰,邢景军,丁 杨,周亦武
(1.华中科技大学同济医学院法医学系,湖北 武汉 430030;2.中国科学院武汉物理与数学研究所 波谱与原子分子物理国家重点实验室 武汉磁共振中心,湖北 武汉 430071)
应用磁共振弥散张量成像诊断大鼠锥体束损伤
李上勋1,山 黛2,段祎杰1,邢景军1,丁 杨1,周亦武1
(1.华中科技大学同济医学院法医学系,湖北 武汉 430030;2.中国科学院武汉物理与数学研究所 波谱与原子分子物理国家重点实验室 武汉磁共振中心,湖北 武汉 430071)
目的 探索磁共振弥散张量成像(diffusion tensor imaging,DTI)在大鼠锥体束损伤中的应用价值。方法 建立大鼠Marmarou模型,伤后3、12、24及72h行磁共振DTI扫描,探索大鼠双侧锥体束弥散参数、β-淀粉样前体蛋白(β-amyloid precursor protein,β-APP)单位面积阳性轴索数和阳性染色轴索面积百分比、神经丝(neurofilament,NF)68平均光密度和积分光密度改变规律。 结果 实验组锥体束轴向弥散(axial diffusivity,AD)、各向异性分数(fraction anisotropy,FA)和相对各向异性(relative anisotropy,RA)呈持续性下降,伤后72h达到最低值(P<0.05),此与β-APP及NF68免疫组织化学染色观察指标变化趋势相对应。相关分析证实AD、FA和RA与β-APP染色指标均呈显著负相关。 结论 DTI对锥体束损伤的早期诊断具有重要的应用价值。
法医病理学;颅脑损伤;锥体束;磁共振成像,弥散;大鼠
磁共振弥散张量成像(diffusion tensor imaging,DTI)是磁共振弥散加权成像(diffusion weighted imaging,DWI)的延续,通过检测脑白质内水分子扩散而反映白质纤维束的微结构信息,能无创性显示白质纤维束走行、方向、髓鞘化等信息的技术[1-2]。研究表明,DTI与常规的MRI技术相比能更有效地反映神经轴索损伤及其严重程度,并被广泛应用于临床白质损伤诊断、神经功能评价及预后评估等[2]。目前,该技术已被用于小鼠脱髓鞘损伤、多发性硬化、脊髓损伤及控制性皮层冲击损伤(controlled cortical impact,CCI)后白质损伤的研究[3-6],其弥散参数改变与β-淀粉样前体蛋白(β-amyloid precursor protein,β-APP)、神经丝(neurofilament,NF)亚基,尤其神经丝轻链NF68等轴索损伤生物标记物密切相关[6-7]。本研究在建立大鼠创伤性脑损伤(traumatic brain injury,TBI)模型基础上,应用磁共振DTI技术、β-APP及NF68免疫组织化学染色,观察大鼠TBI后锥体束弥散参数及免疫组织化学改变特征,探讨DTI技术在锥体束损伤诊断及损伤时间推断中的应用价值。
1 材料与方法
1.1 实验动物与分组
成年SD雄性大鼠25只(由武汉大学医学部实验动物中心提供),体质量200~250g。随机分为4组实验组(分别于伤后3、12、24及72h行DTI扫描)和1组对照组,每组5只。
1.2 仪器与试剂
免疫组化染色一抗为单克隆兔抗β-APP(1∶200,英国Abcam公司)和单克隆鼠抗NF68(1∶200,美国Sigma公司)。二抗为生物素化羊抗兔IgG、羊抗鼠IgM,染色方法为ABC法。ABC试剂盒由美国Vector实验室提供,二抗及其他试剂由武汉博士德生物工程有限公司提供,二抗及ABC滴度均为1∶400。
Bruker BioSpec 7T/20 cm动物成像仪(德国Bruker公司),CM3050S型冷冻切片机(德国Leica公司),Nikon Eclipse 90i生物显微镜(日本尼康公司)。
1.3 TBI动物模型制备
实验组参照Marmarou等[8-9]报道的方法建立大鼠TBI模型。10%水合氯醛(0.3mL/100g)腹腔麻醉生效后,在冠状缝与人字缝之间作正中切口,分开头皮与骨膜,用EC胶将一直径10mm、厚度3mm无锈钢币粘贴于前囟与人字缝之间。450g圆柱形钢棒经1 m长有机玻璃管自由落体垂直落下,大鼠致伤后立即移开以避免再次损伤。
对照组大鼠除未给予打击,其他处理均与损伤组相同。
1.4 DTI扫描
磁共振成像在配备有直径为70mm梯度线圈的7T/20 cm Bruker BioSpec scanner动物成像仪上完成。DTI成像采用自旋平面回波DTI序列,扫描参数设定为:扩散加权系数b=800 s/mm2,名义体素大小117μm×117μm×800μm,扩散敏感梯度方向为30,累加4次,回波时间26 ms,重复时间5 000.001 ms,激发角度90°,层厚0.8 mm,层间距0 mm,梯度脉冲间隔时间(Δ)14ms,扩散梯度持续时间(δ)3ms,视野30mm×30mm,采样矩阵128×128,成像总时间46min 40s 0ms。
1.5 脑组织处理及免疫组织化学染色
各组大鼠DTI扫描后,脑组织灌流固定,取出脑组织后置于4%多聚甲醛固定液过夜(16~18h)。次日,于下丘水平离断大脑及脑干,于锥体交叉下缘2 mm切断颈髓保留完整脑干,同时经正中矢状切口将脑干分为均等的左、右两侧。经上述方法,脑干组织包含有大脑脚间区、脑桥、左或右侧锥体束[8-9]。脑干组织块置于30%蔗糖浸渍沉淀后冰冻切片,矢状位切片,连续6片,片厚30 μm,脑片直接黏附于明胶TBS处理的切片上,切片时明确区分左、右侧。由于单侧锥体束宽度约为1.2mm[10],因此单侧脑干组织块仅切36片。轴索染色阳性结果为棕黄色,阴性对照不染色。
1.6 数据处理与统计分析
经双盲法应用Panavision 5.0软件在各向异性分数(fraction anisotropy,FA)图上画取左、右侧锥体束,获取DTI图像及相应弥散参数:λ1即轴向弥散(axial diffusivity,AD)、λ2、λ3、表观弥散系数(apparent diffusion coefficient,ADC)、FA。由λ1、λ2和λ3求取径向弥散(radical diffusivity,RD)及相对各向异性(relative anisotropy,RA)。ADC=(λ1+λ2+λ3)/3;RD=(λ2+λ3)/2。每只大鼠可获得7组锥体束弥散参数(单侧)。首次画图后15 d,随机选取部分DTI图像再次画左、右侧锥体束,弥散参数经双尾t检验,二者差异无统计学意义(P>0.05)。
每张脑干切片,在生物显微镜40倍下观察腹侧锥体束区域,200倍下随机获取5个区域,利用NIS Element BR图像分析系统计算单位面积(mm2)下β-APP阳性轴索数及阳性染色面积百分比、NF68平均光密度及积分光密度。
2 结 果
2.1 动物行为学及脑干大体观察
实验组大鼠伤后即出现短暂呼吸暂停,10~20 s后呼吸浅快夹杂数次深大呼吸,伴有全身抽搐发作(15~30 s)甚至角弓反张,伤后1 min左右呼吸、心搏逐渐平稳。大鼠苏醒后主动活动减少,行动迟缓,反应性下降。对照组大鼠苏醒后活动基本同麻醉前。
实验组大鼠未见颅骨骨折、硬脑膜外及硬脑膜下出血。脑干腹侧及背侧蛛网膜下腔出血发生率分别为95%、80%,呈不同程度弥漫性分布。对照组未见明显异常。
2.2 DTI弥散参数改变
对照组大鼠FA图锥体束呈均匀的高信号。实验组伤后3h即可发现FA图信号减低、灰度增加,随着损伤时间延长FA灰度逐渐增加,伤后72 h,双侧锥体束灰度显著增加,与周围灰质分界较为模糊。AD图则仅在伤后3h发现明显的灰度增加,而其余时间组间灰度改变不明显。各组ADC、λ2和λ3图像表现为均匀的灰度,各组间未见明显灰度变化。
弥散参数定量分析结果示锥体束AD、FA和RA值伤后3h显著下降,12~72h呈持续性下降,但趋势较为平缓,72h均达到最低值(P<0.05)。ADC值伤后显著下降,伤后24 h达到最低值,24与72 h组间差异无统计学意义。双侧锥体束RD、λ2和λ3值仅伤后72h与其余各组比较差异均有统计学意义(表1)。同组各弥散参数左、右侧锥体束间差异均无统计学意义(P>0.05)。
表1 双侧锥体束弥散参数改变特征 (n=5,±s)
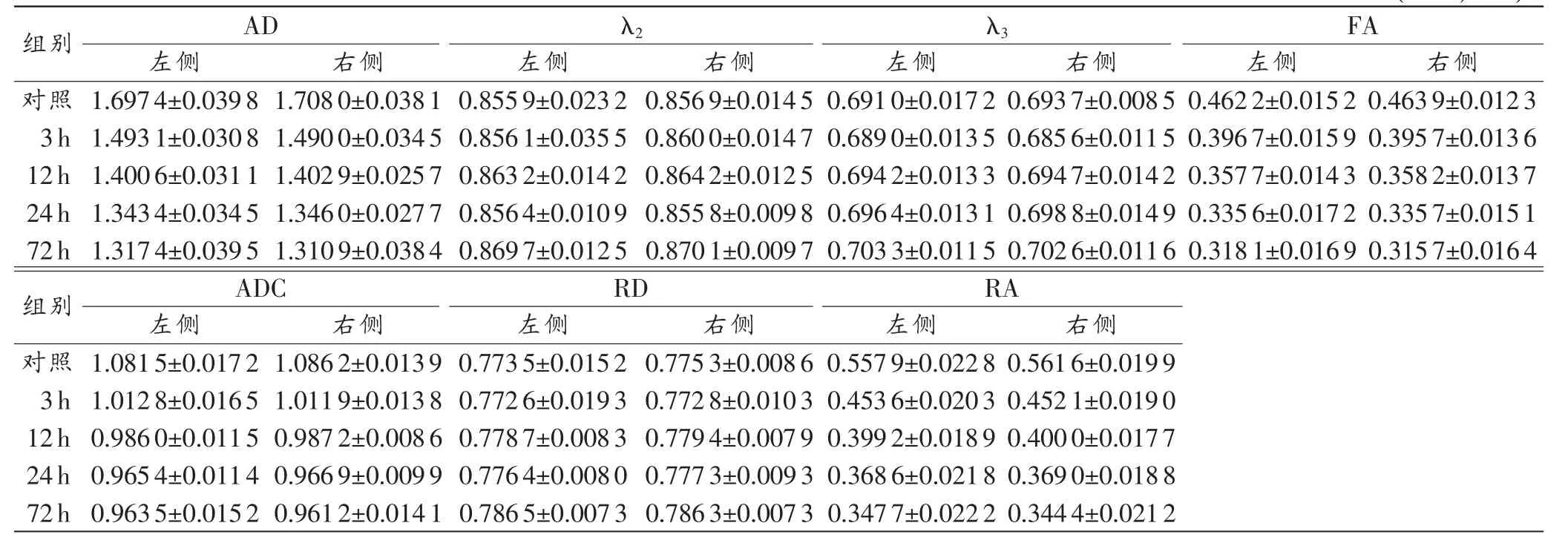
表1 双侧锥体束弥散参数改变特征 (n=5,±s)
组别 AD λ2 FA左侧 右侧 左侧 右侧 左侧 右侧 左侧 右侧对照 1.6974±0.0398 1.7080±0.0381 0.8559±0.0232 0.8569±0.0145 0.6910±0.0172 0.6937±0.0085 0.4622±0.0152 0.4639±0.0123 3h 1.4931±0.0308 1.4900±0.0345 0.8561±0.0355 0.8600±0.0147 0.6890±0.0135 0.6856±0.0115 0.3967±0.0159 0.3957±0.0136 12h 1.4006±0.0311 1.4029±0.0257 0.8632±0.0142 0.8642±0.0125 0.6942±0.0133 0.6947±0.0142 0.3577±0.0143 0.3582±0.0137 24h 1.3434±0.0345 1.3460±0.0277 0.8564±0.0109 0.8558±0.0098 0.6964±0.0131 0.6988±0.0149 0.3356±0.0172 0.3357±0.0151 72h 1.3174±0.0395 1.3109±0.0384 0.8697±0.0125 0.8701±0.0097 0.7033±0.0115 0.7026±0.0116 0.3181±0.0169 0.3157±0.0164组别 ADC RD RA左侧 右侧 左侧 右侧 左侧 右侧对照 1.0815±0.0172 1.0862±0.0139 0.7735±0.0152 0.7753±0.0086 0.5579±0.0228 0.5616±0.0199 3h 1.0128±0.0165 1.0119±0.0138 0.7726±0.0193 0.7728±0.0103 0.4536±0.0203 0.4521±0.0190 12h 0.9860±0.0115 0.9872±0.0086 0.7787±0.0083 0.7794±0.0079 0.3992±0.0189 0.4000±0.0177 24h 0.9654±0.0114 0.9669±0.0099 0.7764±0.0080 0.7773±0.0093 0.3686±0.0218 0.3690±0.0188 72h 0.9635±0.0152 0.9612±0.0141 0.7865±0.0073 0.7863±0.0073 0.3477±0.0222 0.3444±0.0212 λ3
2.3 β-APP及NF68免疫组织化学染色观察
对照组锥体束未检见β-APP阳性染色轴索。实验组双侧锥体束伤后3h即可检见少量β-APP阳性染色轴索或轴索膨体(axonal varicosities,AV),轴索迂曲肿胀、末端膨大,少量因轴索断裂后轴浆溢出局部轴膜包绕形成的轴索收缩球(axonal retraction balls,ARB)。伤后12~72h,轴索损伤的形态改变更为突出,表现为轴索显著肿胀、迂曲,β-APP阳性AV或ARB数量及阳性染色轴索总面积逐步增加,于伤后72 h达到高峰(图1)。大鼠双侧锥体束不同组间β-APP染色的定量分析结果见表2,结果示大鼠脑损伤后β-APP单位面积阳性染色轴索数和阳性染色轴索面积百分比在伤后呈持续性升高,72 h达到峰值(P<0.05)。

表2 双侧锥体束β-APP单位面积阳性轴索数和阳性染色轴索面积百分比 (n=5,±s)
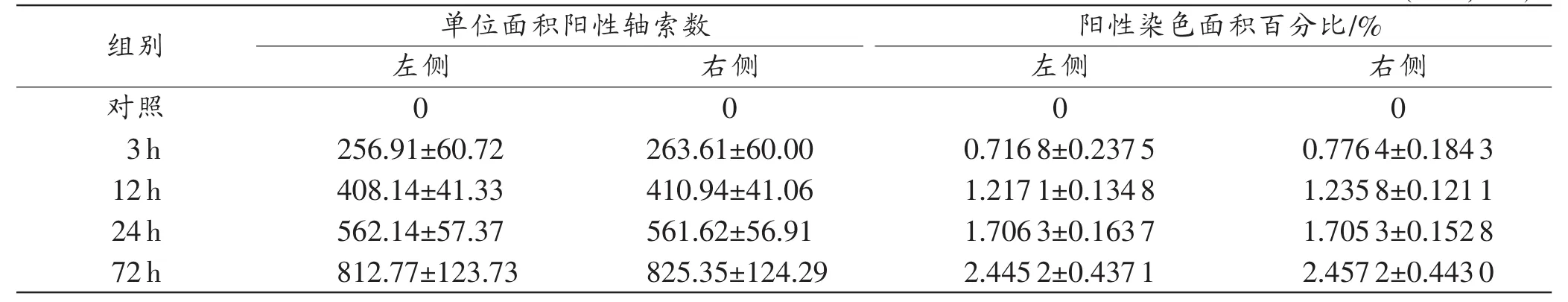
表2 双侧锥体束β-APP单位面积阳性轴索数和阳性染色轴索面积百分比 (n=5,±s)
组别 单位面积阳性轴索数 阳性染色面积百分比/%左侧 右侧 左侧 右侧对照0 0 0 0 3h 256.91±60.72 263.61±60.00 0.7168±0.2375 0.7764±0.1843 12h 408.14±41.33 410.94±41.06 1.2171±0.1348 1.2358±0.1211 24h 562.14±57.37 561.62±56.91 1.7063±0.1637 1.7053±0.1528 72h 812.77±123.73 825.35±124.29 2.4452±0.4371 2.4572±0.4430
对照组锥体束NF68染色呈弱阳性,TBI后3 h,神经轴索NF68阳性染色轻度增强,轴索轻度肿胀,扭曲;伤后12~72 h,轴索染色显著增强,轴突显著肿胀、扭曲,并可检见少量AV,呈长梭形或腊肠状(图2)。大鼠锥体束NF68染色平均光密度和积分光密度定量分析结果见表3,二者均在伤后3h升高,且随着时间的延长而逐步升高,在伤后72 h达到峰值(P<0.05)。

表3 双侧锥体束NF68染色平均光密度和积分光密度 (n=5,±s)
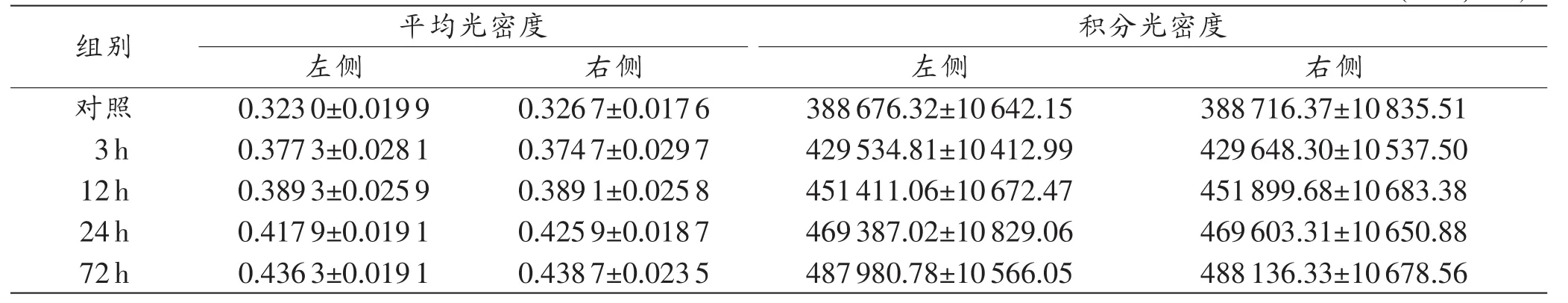
表3 双侧锥体束NF68染色平均光密度和积分光密度 (n=5,±s)
组别 平均光密度 积分光密度左侧 右侧 左侧 右侧对照 0.3230±0.0199 0.3267±0.0176 388676.32±10642.15 388716.37±10835.51 3h 0.3773±0.0281 0.3747±0.0297 429534.81±10412.99 429648.30±10537.50 12h 0.3893±0.0259 0.3891±0.0258 451411.06±10672.47 451899.68±10683.38 24h 0.4179±0.0191 0.4259±0.0187 469387.02±10829.06 469603.31±10650.88 72h 0.4363±0.0191 0.4387±0.0235 487980.78±10566.05 488136.33±10678.56
2.4 DTI弥散参数与β-APP免疫组织化学结果相关分析
经标准化处理的AD、FA和RA值(将实验组每只大鼠一侧锥体束的AD、FA或RA均值分别除以对照组5只大鼠同侧的AD、FA或RA的均值)[6]与β-APP单位面积阳性轴索数均呈显著负相关。左侧锥体束AD、FA、RA与β-APP单位面积阳性轴索数决定系数(R2)分别为0.815、0.833及0.828;右侧锥体束AD、FA、 RA与β-APP单位面积阳性轴索数R2分别为0.857、0.877及0.873。FA与β-APP单位面积阳性轴索数的相关性优于AD和RA。
3 讨 论
DTI是一种特殊的磁共振技术,由Basser等[1]于1994年提出,其基本原理是应用一个自旋回波序列加上一个对称的梯度脉冲,该序列可以测量一段时间一个方向上的水分子位移情况;由于组织内水分子扩散程度的不同导致磁共振信号强度增衰程度的不同。该技术既可评价水分子的弥散大小,也能反映弥散的方向性。其弥散参数包括3个主要本征值(λ1、λ2及λ3)和4个衍生参数(RD、ADC、FA和RA)。在随意微结构的组织内,水分子向各个方向扩散的速度相同,称为各向同性(isotropic)。在具有固定排列顺序的组织中,水分子向不同方向的扩散程度有差异,称为各向异性(anisotropy)。中枢神经系统白质为非均匀的系统,生理状态下水分子扩散表现出显著的各向异性[11-12]。实验组双侧锥体束AD值下降,其主要生物物理学机制为损伤局部轴膜收缩和封闭导致轴索内水分子扩散下降,AV和ARB形成减小细胞外间隙而导致轴索间水分子扩散减小,此与β-APP单位面积阳性轴索数及阳性染色轴索面积百分比的时间变化趋势相对应。小鼠CCI模型将DTI弥散参数与β-APP、NF68结果对比分析,发现损伤组胼胝体AD下降与β-APP阳性轴索呈显著负相关[6];亚急性期,AD逐渐恢复正常而RD升高,这些改变则与脱髓鞘和水肿有关[13]。在本实验条件下,实验组FA和RA值显著下降,此与AD值降低或与AD值减低和RD值升高均有关,结合文献,考虑原因为TBI早期锥体束仅表现为轴索损伤,随着损伤时间延长尤其伤后72h,由于轴膜通透性增加或局部髓鞘结构降解而导致RD值轻度升高。ADC值下降主要反映细胞内水肿(兴奋性水肿),反之则主要反映细胞外水肿(血管性水肿)。锥体束损伤后,水分子快速进入轴索内导致轴索肿胀,从而导致ADC值在伤后出现显著下降,然而ADC值还受到其他因素的影响包括局部纤维密度、方向、髓鞘损伤程度等[14]。因此判断脑水肿类型及程度,评估轴膜和髓鞘损伤将有助于深入阐明DTI弥散参数改变的生物物理学机制。
β-APP是通过轴突快速转运机制运输的一种神经元正常成分。通常在神经元中表达水平很低,受机械性损伤、缺血缺氧、兴奋性毒素等因素作用诱导而增高,并快速聚集于损伤的轴索内,动物TBI研究发现伤后2~6h即可在损伤轴索内检见β-APP阳性染色[15-16]。NF亚基,尤其是NF68在TBI后可发生快速磷酸化和降解,伤后3 h既可检见轴索NF68阳性染色增强[17-18],因此β-APP和NF68被广泛用为TAI的诊断标记物[7]。Marmarou模型造成的脑干轴索损伤主要集中于脑干纵行纤维束包括锥体束、内侧纵束等[8-9]。本研究发现TBI后3 h即可在双侧锥体束检见β-APP阳性染色轴索,NF68轴索染色显著增强,且随着损伤时间的延长,轴索病理改变更为突出,此与之前的研究结果[7,15-18]相吻合,证明在本实验条件下该模型稳定、可靠。横向比较各组左、右侧锥体束弥散参数及免疫组织化学染色结果发现,左、右侧锥体束弥散参数和免疫组织化学染色结果差异无统计学意义,证明在建模过程中碰撞倾斜而导致能量分布不均,生物力学得到较为严格的控制。
本实验采用双盲法,通过计算β-APP单位面积阳性染色轴索数及阳性染色轴索面积百分比而评估锥体损伤的严重程度,有研究[9]指出单根轴索可能出现多个β-APP阳性染色的AV或ARB,因此可能高估轴索损伤的严重程度,另有部分轴索经β-APP染色可能出现假阴性结果。鉴于此,NF68平均光密度值及积分光密度值则在一定程度上弥补了β-APP染色不足,二者联合应用可更为全面、客观地反映轴索损伤的严重程度。采用更为先进的技术如体式分析等将可能有助于更为客观地定量分析轴索损伤的严重程度[19]。
综上,大鼠TBI后DTI弥散参数可用于锥体束损伤的早期诊断,且能反映锥体束急性期损伤的时间信息,而针对轴索其他组分如轴膜、髓鞘等研究将有助于阐明TBI后DTI弥散参数改变的生物力学机制。
[1] Basser PJ,Mattiello J,LeBihan D.MR diffusion tensor spectroscopy and imaging[J].Biophys J,1994,66(1):259-267.
[2] Sundgren PC,Dong Q,Gómez-Hassan D,et al.Diffusion tensor imaging of the brain:review of clinical applications[J].Neuroradiology,2004,46(5):339-350.
[3] Song SK,Yoshino J,Le TQ,et al.Demyelination increases radial diffusivity in corpus callosum of mouse brain[J].Neuroimage,2005,26(1):132-140.
[4] Kim JH,Budde MD,Liang HF,et al.Detecting axon damage in spinal cord from a mouse model of multiple sclerosis[J].Neurobiol Dis,2006,21(3):626-632.
[5] Deo AA,Grill RJ,Hasan KM,et al.In vivo serial diffusion tensor imaging of experimental spinal cord injury[J].J Neurosci Res,2006,83(5):801-810.
[6] Mac Donald CL,Dikranian K,Song SK,et al.Detection of traumatic axonal injury with diffusion tensor imaging in a mouse model of traumatic brain injury[J]. Exp Neurol,2007,205(1):116-131.
[7] Li J,Li XY,Feng DF,et al.Biomarkers associated with diffuse traumatic axonal injury:exploring pathogenesis,early diagnosis,and prognosis[J].J Trauma,2010,69(6):1610-1618.
[8] Marmarou A,Foda MA,van den Brink W,et al.A new model of diffuse brain injury in rats.Part I:Pathophysiology and biomechanics[J].J Neurosurg,1994,80(2):291-300.
[9] Marmarou CR,Walker SA,Davis CL,et al.Quantitative analysis of the relationship between intra-axonal neurofilament compaction and impaired axonal transport following diffuse traumatic brain injury[J].J Neurotrauma,2005,22(10):1066-1080.
[10]Paxinos G,Watson C.The Rat Brain in Stereotaxic Coordinates[M].4th ed.Amsterdam:Academic Press Inc,1997.
[11]曾洪武,王培军.磁共振扩散加权与弥散张量成像原理分析及比较[J].中国医学影像技术,2005,21(12):1945-1947.
[12]陈小轲,吴仁华.弥散张量成像的原理及其在中枢神经系统的临床应用[J].实用放射学杂志,2006,22(5):613-617.
[13]Mac Donald CL,Dikranian K,Bayly P,et al.Diffusion tensor imaging reliably detects experimental traumatic axonal injury and indicates approximate time of injury[J].J Neurosci,2007,27(44):11869-11876.
[14]Westin CF,Maier SE,Mamata H,et al.Processing and visualization for diffusion tensor MRI[J].Med Image Anal,2002,6(2):93-108.
[15]Farkas O,Tamás A,Zsombok A,et al.Effects of pituitary adenylate cyclase activating polypeptide in a rat model of traumatic brain injury[J].Regul Pept,2004,123(1-3):69-75.
[16]Adelson PD,JenkinsLW, Hamilton RL,etal. Histopathologic response of the immature rat to diffuse traumatic brain injury[J].J Neurotrauma,2001,18(10):967-976.
[17]Serbest G,Burkhardt MF,Siman R,et al.Temporal profiles of cytoskeletal protein loss following traumatic axonal injury in mice[J].Neurochem Res,2007,32(12):2006-2014.
[18]Chen XH,Meaney DF,Xu BN,et al.Evolution of neurofilament subtype accumulation in axons following diffuse brain injury in the pig[J].J Neuropathol Exp Neurol,1999,58(6):588-596.
[19]Sterio DC.The unbiased estimation of number and sizes of arbitrary particles using the disector[J].J Microsc,1984,134(Pt 2):127-136.
2012-01-13)
(本文编辑:张建华)
Magnetic Resonance Diffusion Tensor Imaging for Diagnosis of Pyramidal Tract Damage in Rats
LI Shang-xun1,SHAN Dai2,DUAN Yi-jie1,XING Jing-jun1,DING Yang1,ZHOU Yi-wu1
(1.Department of Forensic Medicine,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China;2.Wuhan Center for Magnetic Resonance,State Key Laboratory of Magnetic Resonance and Atomic and Molecular Physics,Wuhan Institute of Physics and Mathematics,Chinese Academy of Sciences,Wuhan 430071,China)
Objective To explore the applicability of magnetic resonance diffusion tensor imaging(DTI)for diagnosis of pyramidal tract damage in rats.Methods Marmarou’s model was set up,followed by DTI scanning at 3,12,24 and 72 h post trauma to acquire the dispersion parameter of bilateral pyramidal tracts.Moreover,axonal varicosities per square millimeter and the percentage of positive area of axons demonstrated by β-amyloid precursor protein(β-APP)immunostaining were obtained,as well as the mean density and sum density of neurofilament(NF)68 immunostaining.Results Axial diffusivity(AD),fraction anisotropy(FA)and relative anisotropy(RA)in the pyramidal tract were significantly and continuously reduced and reached to the bottom at 72h post trauma(P<0.05)in accord with the gradient of axonal damage verified by β-APP and NF68 immunostaining.Furthermore,the changes of AD,FA and RA showed a significant negative correlation with the β-APP immunohistochemical results.Conclusion DTI has important value for early diagnosis in pyramidal tract damage.
forensic pathology;craniocerebral trauma;pyramidal tracts;diffusion magnetic resonance imaging;rats
DF795.1
A
10.3969/j.issn.1004-5619.2012.04.004
1004-5619(2012)04-0256-05
教育部留学回国人员科研启动基金资助项目(2009-35);中国科学院波谱与原子分子物理国家重点实验室开放基金资助项目(T152909);上海市法医学重点实验室开放课题(KF1107)
李上勋(1985—),男,博士研究生,主要从事法医病理学研究;E-mail:lishangxun@gmail.com
周亦武,男,教授,博士研究生导师,主要从事法医病理学、神经病理学研究;E-mail:yiwuhedi@sina.com

