溶剂热合成Cu2O微球及其对高氯酸铵热分解的催化作用
罗小林 韩银凤 杨德锁 陈亚芍
(1宝鸡文理学院化学化工系,植物化学陕西省重点实验室,陕西宝鸡721013; 2陕西师范大学化学化工学院,应用表面与胶体化学教育部重点实验室,西安710062)
溶剂热合成Cu2O微球及其对高氯酸铵热分解的催化作用
罗小林1,*韩银凤1杨德锁1陈亚芍2
(1宝鸡文理学院化学化工系,植物化学陕西省重点实验室,陕西宝鸡721013;2陕西师范大学化学化工学院,应用表面与胶体化学教育部重点实验室,西安710062)
以聚乙烯吡咯烷酮(PVP)为添加剂,利用溶剂热法合成了Cu2O微球.考察了PVP用量以及反应温度对产物形貌的影响,并在反应时间为2.5与4.5 h时分别合成了直径为100-200 nm和1µm的Cu2O微球.同时,利用差热分析(DTA)技术考察了不同直径的Cu2O微球对高氯酸铵(AP)热分解的催化效果,结果表明:添加2% (w)的直径为100-200 nm和1µm的Cu2O微球使得AP的高温分解温度分别降低了116和118°C,AP在低温阶段的分解量也明显提高.
Cu2O微球;溶剂热合成;高氯酸铵;热分解
1 引言
半导体材料由于其在光学、电学、生物学以及催化科学等领域中具有巨大的潜在应用价值而受到广泛的重视.作为一种p型半导体,氧化亚铜(能隙带宽约为2.17 eV)以其独特的电学、光学和催化性能在光能转化、超导材料、催化反应等领域获得了广泛的应用,已经成为近年来研究的热点.1-4目前,国内外的学者对Cu2O的合成和应用展开了大量的研究,利用不同方法合成了不同形貌的Cu2O,如立方体、正八面体、多面体、棒状、花状等.5-72008年,Kim等8将醇热法应用到Cu2O的合成中,获得了尺寸均匀的球形和立方形晶体.Luo等9在H2O/十六烷基三甲基溴化铵(CTAB)/二甲基甲酰胺(DMF)三元体系中,利用NaBH4的还原性,合成了花状的纳米Cu2O多晶.由此可见,对于合成特定形貌的Cu2O并对其展开具体应用已成为当前热门的课题.
AP具有高含氧量、高密度以及反应后能够产生高比冲等优点被作为氧化剂而被应用到固体复合推进剂当中.最近十几年,国内外一些研究小组将一些特殊的催化材料(如纳米Al粉、纳米Cu粉、纳米CuO以及纳米稀土氧化物等)应用于AP的催化热分解,发现这些材料能够有效降低AP的分解温度,提高AP的燃烧速率,对AP的热分解具有强烈的促进作用.10-14如Liu等15将粒径为20 nm的金属Cu混入到AP中去,使得AP的总表观分解热增加了0.86 kJ·g-1,提高了将近200%.朱俊武等16研究发现,添加多边形纳米Cu2O可使AP的高温分解温度降低104°C,其分解放热量也明显提高.尽管国内外研究者从不同角度对Cu2O催化AP热分解进行了一些研究,但研究体系仍不够系统,对不同直径Cu2O微球催化AP热分解的研究更是鲜有报道.本文通过溶剂热法合成了不同直径的Cu2O微球,并利用差热分析(DTA)考察了不同直径的Cu2O微球对AP热分解的催化效果.
2 实验部分
2.1 试剂与仪器
试剂:草酸铜、乙二醇为国产分析纯试剂(上海试剂厂),聚乙烯吡咯烷酮(PVP)为德国BASF公司进口分析纯试剂(K30),所有用水均为二次超纯水.
仪器:采用日本理学公司的D/MAX-IIIC全自动X射线衍射(XRD)仪进行测试,测试条件为Cu Kα辐射,最大管电压60 kV,最大管电流80 mA,扫描速率8(°)·min-1;采用荷兰FEI公司的Quanta 200型环境扫描电镜(SEM)测定样品形貌,电压20 kV;透射电镜(TEM)和选区电子衍射(SAED)分析采用日本电子公司JEM-3010型透射电镜,工作电压为300 kV;采用美国P.E.公司Lambd 950型紫外-可见(UV-Vis)光谱仪测定样品光学性质;热重-差热分析(TG-DTA)仪使用美国P.E.公司Pyris-II型综合热分析仪,在氮气气氛(氮气流速为50 mL·min-1)中,以25°C·min-1升温速率进行.
2.2 Cu2O微球的制备
Cu2O微球的合成参考以前银纳米材料的合成.17,18称取一定量的PVP置于50 mL聚对苯内衬管中,加入18 mL乙二醇溶液中搅拌至PVP完全溶解,再向溶液中加入0.05 mol·L-1的草酸铜乙二醇溶液2 mL,搅拌均匀后将不锈钢反应釜装好.将反应釜移入预热160°C烘箱中,反应一段时间以后,取出反应釜用自来水浇冷.所得黄色浊液用高速离心机以9000 r·min-1速率离心分离,并用乙醇、水洗涤各两次,产物80°C烘干4 h.
2.3 Cu2O微球对AP热分解催化性能研究
将10 mg AP与0.4 mg新制Cu2O微球混匀后,倒入12 mL丙酮中分散均匀,50°C下烘干,仔细研磨后取3 mg左右样品用于热分析,温度范围40-550°C.同样取3 mg左右纯AP作为对比样品,进行热重-差热分析(TG-DTA).
3 结果与讨论
3.1 PVP用量对产物形貌的影响

图1 不同PVP用量下所得产物的扫描电镜(SEM)和透射电镜(TEM)图片Fig.1 Scanning electron microscopy(SEM)and transmission electron microscropy(TEM) images of the products synthesized with different PVPusagesn(Cu2+):n(PVP):(A)∞,(B)20:1,(C)10:1,(D)2:1;T=160°C;t=2.5 h;Inset in Fig.C shows the corresponding selected area electron diffraction pattern.
图1为反应温度为160°C,反应时间为2.5 h,不同PVP用量下所得产物的SEM图片.从图中可以看出,当合成体系中不含PVP时,所得产物为立方形晶体,其中混有大量无规则颗粒,由于Cu2O属于立方晶系,其热力学稳定结构为立方体,因而在乙二醇还原体系中自由生长较易形成立方体;向合成体系中加入少量PVP(如图1B),所得产物为多面体不规则颗粒,颗粒直径约为800 nm,这是由于PVP与Cu2O晶体特定晶面具有一定的配位作用,因而可以吸附在Cu2O特定的晶面上,导致Cu2O晶体的各向异性生长;继续增加PVP的用量使n(Cu2+):n(PVP)= 10:1,此时合成体系中获得了较为特殊的Cu2O微球,其直径分布在100-200 nm,产物中基本没有其它形貌晶体出现,同时,对单个Cu2O微球进行选区电子衍射分析,从图1C插图中可以看出产物电子衍射图样为环形光斑,表明所得Cu2O微球为多晶结构;进一步增加PVP用量,所得产物仍为Cu2O微球(图1D),但球径分布不均匀,对比图1C可以看出,在此条件下所得Cu2O微球直径明显较前者大,接近1 µm,这是由于PVP分子链端的羟基同样具有一定的还原性,随着PVP用量的增大,体系的还原能力增强,Cu2O的生长速率也随之增加.Washio等19在合成银纳米材料时也发现了PVP链端羟基的还原作用使得银纳米粒子的结晶速率有所提高.
图2为n(Cu2+):n(PVP)=10:1时所得产物的XRD谱图.谱图中出现了六个较为明显的衍射峰,衍射峰分布与立方晶系的Cu2O标准衍射峰(JCPDF No. 65-3288)完全一致,分别对应Cu2O晶体(110)、(111)、(200)、(211)、(220)和(311)晶面,各衍射峰均有一定的宽化现象,表明所得Cu2O微球尺寸较小,这与TEM测试结果相一致.
3.2 反应温度对产物形貌的影响

图2 Cu2O微球的X射线衍射(XRD)谱图Fig.2 X-ray diffraction(XRD)pattern of Cu2O micro-spheres
由于乙二醇溶剂热反应体系的还原性来自于乙二醇高温脱水形成的乙醛,因而在合成Cu2O的过程中需要较高的温度,通常情况下反应温度一旦低于120°C,体系的还原性较弱,难以获得固体沉淀,但反应温度过高时,溶液的过饱和度又会减小,降低合成的效率.由此可见,在此体系中,反应温度对Cu2O的结晶具有重要的影响.图3为固定n(Cu2+): n(PVP)=10:1,反应时间为2.5 h,不同反应温度下所得产物的SEM图片.从图中可以看出:当反应温度为120°C时,所得样品为不规则多面体,颗粒尺寸约为2µm;当反应温度为140°C时,所得样品仍为多面体结构,颗粒尺寸减小为约2µm.值得注意的是,当反应温度升高为160°C,所得产物转变为球形结构(如图3C所示).这可能是由于在较低的温度下,体系还原性较弱,使得Cu2O的成核与生长速率较慢,各晶面生长速率的差异逐渐显露出来,从而形成了多面体结构,而反应温度较高时,Cu2O的成核速率较快,大量晶核生成并聚集以降低表面能,从而聚集形成了球形结构.当反应温度进一步升高为180°C时,所得产物尽管为球形结构,但所得球体均匀性较差.

图3 不同反应温度下所得样品的SEM图片Fig.3 SEM images of the products synthesized at different reaction temperaturesT/°C:(A)120,(B)140,(C)180;t=2.5 h;n(Cu2+):n(PVP)=10:1
3.3 Cu2O微球结晶过程研究
固定n(Cu2+):n(PVP)=10:1,反应温度为160°C,调节不同反应时间考察Cu2O微球的结晶过程.当反应时间为10和20 min时,所得体系均为淡蓝色透明溶液,经过长时间离心没有分离出固体粉末,表明体系在刚开始受热的20 min内没有发生明显变化.将反应时间为10和20 min的反应液取出用UV-Vis光谱仪进行分析(图4),从图4A中可以看出两份溶液在230 nm处均有较为明显的吸收,这与Cu2+溶液UV吸收峰较为接近(Cu2+溶液最大吸收波长为245 nm),说明在此阶段乙二醇尚未将Cu2+还原生成Cu2O;当反应时间为30 min和1 h时,所得体系均为淡黄色浊液,将浊液稀释后测得UV-Vis光谱见图4A,从图中可以看出:所得两份溶液在240 nm处同样有较为明显吸收,表明溶液中还有大量Cu2+未被还原,同时,溶液还在300-400 nm范围出现较为明显的肩峰,这可能与溶液中生成的Cu2O颗粒有关.将反应时间为30 min和1 h所得浊液经过离心分离得到少量沉淀,在乙醇中用超声分散后测得的UV-Vis光谱见图4B.从图中可以看出,反应时间为30 min时所得固体粉末在481 nm处有非常明显的吸收,而随着反应时间的延长为1 h,吸收峰有一定的蓝移现象,表明产物的尺寸可能有所增加.
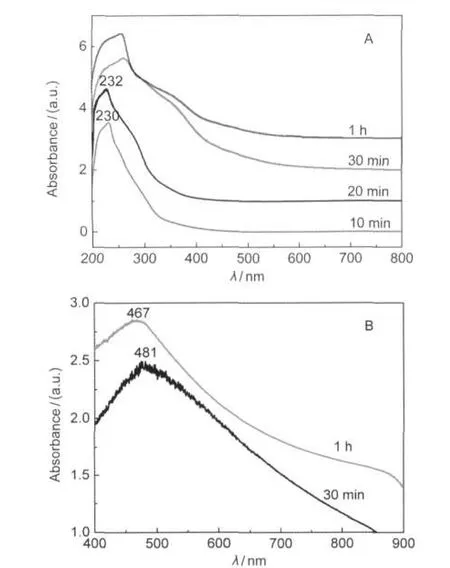
图4 不同反应时间下所得样品的紫外-可见(UV-Vis)光谱图Fig.4 UV-Vis spectra of the products synthesized for different time(A)reaction solution;(B)synthesized Cu2O powder
图5为不同反应时间下所得样品的TEM与SEM图片.从图中可以看出,当反应时间为30 min时,所得样品为Cu2O纳米微球,颗粒直径分布在50-150 nm,由于体系开始受热的前20 min里没有固体产物出现,说明体系受热的20-30 min内对应Cu2O球形晶核生成与初期生长阶段,从图5A插图中还可以看出产物电子衍射图样为环形光斑,表明生成的Cu2O晶体为多晶聚集的球形结构;延长反应时间为2.5 h,所得Cu2O长大为直径分布在100-200 nm的微球(如图1C所示);当反应时间为4.5 h时,Cu2O微球进一步长大,直径达到约1µm.
3.4 不同尺寸的Cu2O微球对AP热分解的催化作用
目前,国际上衡量含能材料热分解特性的基本手段是利用分析仪测定推进剂的分解温度、分解放热量及分解速率.20,21图6为n(Cu2+):n(PVP)=10:1,反应温度为160°C,反应时间为2.5 h条件下所得Cu2O微球与纯PVP的TG分析结果.从图中可以看出:经过多次醇洗和水洗的Cu2O微球在升温过程中出现三次较为明显的失重,从室温到364°C失重7.7%,这一阶段的失重对应于吸附水和乙二醇的挥发;从386°C到466°C样品失重2.2%,这一阶段的失重温度区间与所使用的PVP的失重温度(见图6B)相吻合,说明经过洗涤后的Cu2O微球表面仍然吸附了一定量的PVP,也印证了PVP分子在Cu2O微球结晶过程中可能具有的一些包覆性作用;而从486°C到540°C这一温度区间的少量失重则可能是由于Cu2O微球是由小颗粒微晶聚集成的球形多晶,而在此聚集过程中少量PVP被包覆进入了多晶聚集体内部,这些PVP的分解则需要相对较高的温度.

图5 不同反应时间下所得样品的TEM和SEM图片Fig.5 TEM and SEM images of the products synthesized for different timet:(A)30 min;(B)4.5 h

图6 Cu2O微球与纯PVP的热重(TG)分析曲线Fig.6 Thermogravimetric(TG)analysis curves of Cu2O micro-spheres and PVP(A)Cu2O micro-spheres;(B)PVP
图7为纯的AP、AP与直径分布在100-200 nm的Cu2O微球(图1C)混合物、AP与直径约为1µm的Cu2O微球(图5B)混合物的DTA曲线.从图中可以看出:(1)纯的AP在250°C左右出现一吸热峰,这对应于AP由斜方晶体转变为立方晶体的转晶过程,随着温度的升高,AP经历了两个复杂的分解过程,分别对应340°C左右的低温分解和466°C左右的高温分解;(2)不同直径的Cu2O微球对AP的转晶过程没有明显的催化作用,而直径100-200 nm和1 µm的Cu2O微球对AP的低、高温热分解过程有非常明显的催化作用,使得AP的低温分解温度降低了8-10°C,而高温分解温度则分别降低了116和118°C,展现了非常优异的催化性能,这是由于在AP的高温分解过程中Cu2O微球表面的晶格氧和吸附氧可以作为质子的接受体而简化分解反应的步骤,使分解反应迅速地进行;国内一些研究小组利用沉淀法制备了多边形纳米Cu2O,并将其应用于AP的催化热分解,可使得AP的高温分解温度降低103°C.22本工作制备的Cu2O微球较该文献结果又降低了15°C,这是由于所制备的Cu2O微球尽管尺寸较大,但其分散性更好,可以有效保证AP在分解过程中各种分解中间产物与催化剂充分接触,增加了催化剂的催化效率.(3)在两种不同直径的Cu2O微球催化作用下,AP的低、高温热分解温度降低明显,但二者温差均在2°C左右,说明Cu2O微球的平均粒径对AP的分解温度影响差异较小.此外,从TG分析结果(图8)中可以看出:添加两种Cu2O微球的AP在低温段的分解量有非常明显的增加,分别由纯AP的8.7%增加至55.7%(100-200 nm Cu2O微球)和48.5%(1µm Cu2O微球),充分说明Cu2O微球对于AP的低温分解也有非常明显的催化作用,而AP在低温段的大量分解产生大量的气体中间产物,使得Cu2O微球表面的气态中间产物浓度激增,也有利于高温阶段气-固相反应的迅速发生.值得注意的是,在直径为100-200 nm Cu2O微球催化作用下, AP在低温阶段的分解量较1µm Cu2O微球催化作用下又提高了7.2%左右,说明AP在低温阶段的分解与Cu2O催化剂的粒径有较大关系,反映出AP在低温阶段的分解对Cu2O微球催化剂是结构敏感型反应.
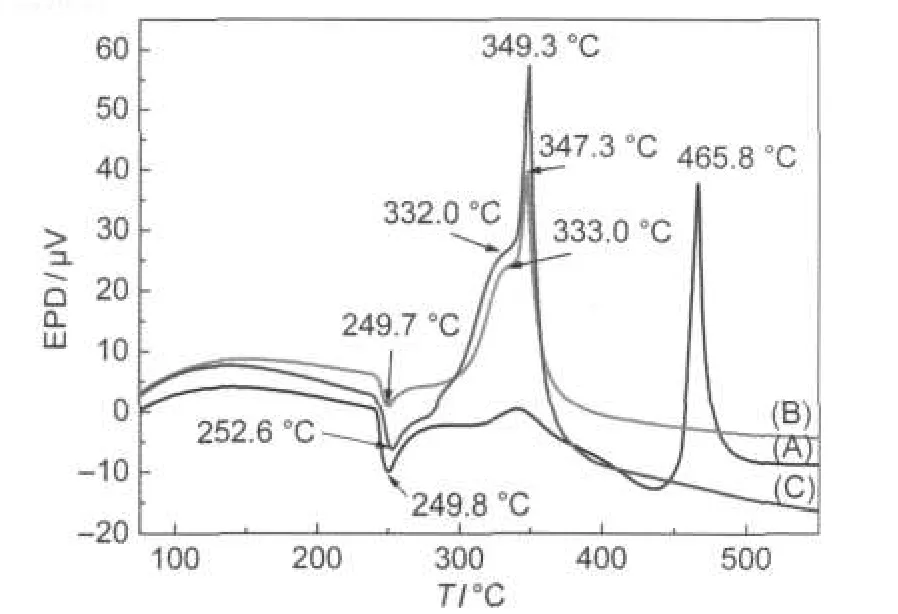
图7 不同直径Cu2O微球催化AP热分解的差热分析(DTA)曲线Fig.7 Differential thermal analysis(DTA)curves of APthermal decomposition catalyzed by Cu2O micro-spheres with different diameters(A)pureAP;(B)AP+Cu2O micro-spheres with diameter of 100-200 nm;(C)AP+Cu2O micro-spheres with diameter of 1µm; EPD:electric potential difference
4 结论
(1)利用醇热法,在160°C、n(Cu2+):n(PVP)=10: 1、反应时间为2.5 h的条件下合成了直径分布在100-200 nm的Cu2O微球;延长反应时间为4.5 h, Cu2O微球进一步生长,直径达到约1µm.
(2)所得不同直径的Cu2O微球均对AP热分解产生良好的催化效果,添加2%的直径为100-200 nm和1µm的Cu2O微球使得AP的低温分解温度降低了8-10°C,而AP的高温分解温度分别降低了116和118°C.
(3)所得不同直径的Cu2O微球明显提高了AP的低温分解量,添加2%的直径为1µm的Cu2O微球使得AP的低温分解量由纯AP的8.7%增加至52.3%,而100-200 nm的Cu2O微球则使AP的低温分解量提高至69.0%.
Reference
(1) Khitrov,G.A.;Strouse,G.F.J.Am.Chem.Soc.2003,125, 10465.
(2) Panda,A.B.;Glaspell,G.;El-Shall,M.S.J.Am.Chen.Soc. 2006,128,2790.
(3)Li,F.;Ding,Y.;Gao,P.X.;Xin,X.Q.;Wang,Z.L.Angew. Chem.Int.Edit.2004,43,5238.
(4) Lee,J.;Yang,B.;Li,R.;Seery,T.A.P.;Papadimitrakopoulos,F. J.Phys.Chem.B 2007,111,81.
(5) Siegfried,M.J.;Choi,K.S.Angew.Chem.2005,117,3282.
(6)Brown,K.E.R.;Choi,K.S.Chem.Commun.2006,3311.
(7) Yang,H.;Liu,Z.H.Cryst.Growth Des.2010,10,2064.
(8)Kim,M.H.;Lim,B.;Lee,E.P.;Xia,Y.N.J.Mater.Chem. 2008,18,4069.
(9) Luo,Y.S.;Li,S.Q.;Ren,Q.F.;Liu,J.P.;Xing,L.L.;Wang, Y.;Yu,Y.;Jia,Z.J.;Li,J.L.Cryst.Growth Des.2007,7,87.
(10) Li,F.S.;Singh,H.;Guo,X.D.Solid Propellant Technology and Application of Nano-Materials;National Defense Industry Press:Beijing,2008;pp 55-231. [李凤生,Singh,H.,郭效德.固体推进剂技术及纳米材料的应用.北京:国防工业出版社, 2008:55-231.]
(11) Sun,X.F.;Qiu,X.Q.;Li,L.P.;Xu,J.X.;Li,G.S.Inorg. Chem.2008,47,4146.
(12) Zhu,R.;Lin,M.C.J.Phys.Chem.C 2008,112,14481.
(13) Heng,Q.L.;Xiao,F.;Luo,J.M.;Sun,Q.J.;Wang,J.D.;Su,X. T.Chin.J.Inorg.Chem.2009,25,359.[衡秋丽,肖 峰,骆建敏,孙庆军,王吉德,宿新泰.无机化学学报,2009,25,359.]
(14) Zhou,L.M.;Liu,H.Y.;Li,F.S.Acta Phys.-Chim.Sin.2006, 22,627.[周龙梅,刘宏英,李凤生.物理化学学报,2006,22, 627.]
(15) Liu,L.L.;Li,F.S.;Tan,L.H.;Ming,L.;Yi,Y.Propellants, Explosives,Pyrotechnics 2004,29,34.
(16) Zhu,J.W.;Wang,Y.P.;Zhang,L.L.;Yang,X.J.;Lu,L.D.; Wang,X.Chin.J.Mater.Sci.Eng.2006,24,209.[朱俊武,王艳萍,张莉莉,杨绪杰,陆路德,汪 信.材料科学与工程学报, 2006,24,209.]
(17)Luo,X.L.;Li,Z.X.;Yuan,C.L.;Chen,Y.S.Mater.Chem. Phys.2011,128,77.
(18) Luo,X.L.;Chen,Y.S.;Yang,D.S.;Li,Z.X.;Han,Y.F.Solid State Sci.2011,13,1719.
(19)Washio,I.;Xiong,Y.J.;Yin,Y.D.;Xia,Y.N.Adv.Mater.2006, 18,1745.
(20)An,T.;Zhao,F.Q.;Yi,J.H.;Fan,X.Z.;Gao,H.X.;Hao,H. X.;Wang,X.H.;Hu,R.Z.;Pei,Q.Acta Phys.-Chim.Sin.2011, 27,281.[安 亭,赵凤起,仪建华,樊学忠,高红旭,郝海霞,王晓宏,胡荣祖,裴 庆.物理化学学报,2011,27,281.]
(21) Zhang,J.;Zhang,T.L.;Yang,L.;Zhang,J.G.;Cui,Y.Acta Phys.-Chim.Sin.2008,24,760. [张 进,张同来,杨 利,张建国,崔 燕.物理化学学报,2008,24,760.]
(22) Zhu,J.W.;Chen,H.Q.;Xie,B.;Yang,X.J.;Lu,L.D.;Wang, X.Chin.J.Catal.2004,25,637.[朱俊武,陈海群,谢 波,杨绪杰,陆路德,汪 信.催化学报,2004,25,637.]
September 5,2011;Revised:November 21,2011;Published on Web:December 1,2011.
Solvo-Thermal Synthesis of Cu2O Micro-Spheres and Their Catalytic Performance for Thermal Decomposition of Ammonium Perchlorate
LUO Xiao-Lin1,*HAN Yin-Feng1YANG De-Suo1CHEN Ya-Shao2
(1Shaanxi Key Laboratory for Phytochemistry,Department of Chemistry and Chemical Engineering,Baoji University of Arts and Sciences,Baoji 721013,Shaanxi Province,P.R.China;2Key Laboratory of Applied Surface and Colloid Chemistry,Ministry of Education,School of Chemistry&Chemical Engineering,Shaanxi Normal University,Xiʹan 710062,P.R.China)
Cu2O micro-spheres were fabricated by a solvothermal method using poly vinylpyrrolidone (PVP)as an additive.The influences of PVP dosage and reaction temperature on the morphologies of the products were investigated.Cu2O micro-spheres with diameters of 100-200 nm and about 1µm were synthesized with reaction time of 2.5 and 4.5 h,respectively.Meanwhile,differential thermal analysis(DTA) was used to determine the catalytic performance of these Cu2O micro-spheres with different diameters for thermal decomposition of ammonium perchlorate(AP).Adding 2%(w)Cu2O micro-spheres with diameters of 100-200 nm and about 1µm into AP decreased the maximum temperature of AP decomposition by 116 and 118°C,respectively,and increased the amount ofAP decomposed at lower temperature.
Cu2O micro-spheres;Solvent-thermal synthesis;Ammonium perchlorate;Thermal decomposition
10.3866/PKU.WHXB201112012www.whxb.pku.edu.cn
*Corresponding author.Email:luoxl225@163.com;Tel:+86-917-3566589.
The project was supported by Shannxi Provincial Department of Education Project,China(11JK0603)and Shannxi Provincial Key Laboratory Project,China(11JS007).
陕西省教育厅项目(11JK0603)和陕西省重点实验室项目(11JS007)资助
O643

