ZrO2修饰Cu催化剂对甲醇吸附原位红外表征
吴贵升 毛东森 卢冠忠 曹 勇 范康年
(1上海应用技术学院化学与环境工程学院应用催化研究所,上海201418;2复旦大学化学系,上海200433)
ZrO2修饰Cu催化剂对甲醇吸附原位红外表征
吴贵升1,*毛东森1卢冠忠1,*曹 勇2范康年2
(1上海应用技术学院化学与环境工程学院应用催化研究所,上海201418;2复旦大学化学系,上海200433)
通过原位红外漫反射实验比较研究了甲醇在Cu及ZrO2/Cu催化剂表面的吸附与反应,并且采用不同还原温度来处理催化剂,改变催化剂表面的氧含量,并进一步研究甲醇吸附和反应性能随着催化剂表面氧含量的变化规律.结果表明,甲醇在Cu催化剂表面反应生成吸附态甲醛物种,进一步生成CO2,而在ZrO2/Cu表面形成甲酸盐物种,并与表面氧进一步反应生成CO2.随着催化剂还原温度的升高,反应中间物进一步生成CO2的反应速率变慢,说明催化剂表面的氧物种含量决定着催化剂甲醇吸附中间物种的形成及反应速率.
甲醇吸附;原位红外漫反射;Cu;ZrO2/Cu
1 引言
Cu/ZrO2催化剂作为一种甲醇水蒸气重整反应催化剂相对于CuZnAl表现出优越的催化活性,1-10并且研究进一步表明,适当地提高焙烧或还原温度均可进一步提高催化活性.表面分析结果表明,催化剂的活性增加可能由于催化剂表面的锆组分的富集而产生的.1,2,11因此,在前期工作中,我们尝试用Cu作为催化剂的主组分,将ZrO2负载在Cu表面,考察人为地将ZrO2富集到Cu表面的催化剂行为.结果表明,ZrO2负载在Cu表面显著提高了催化剂的甲醇水蒸气重整反应的催化活性和稳定性,并且铜的表面氧含量对Cu催化剂的反应活性和稳定性起着重要的影响.12-14
本文对Cu和ZrO2/Cu进行不同温度的还原处理,目的是改变催化剂表面的氧含量,并考察催化剂表面氧含量对甲醇的吸附以及反应的行为变化规律.
2 实验部分
2.1 催化剂的制备
将硝酸铜粉末(AR)直接于400°C加热分解4 h来制备Cu催化剂.ZrO2/Cu催化剂(ZrO2的质量分数为10%)通过浸渍法制备,简单地说,将一定量的Cu催化剂浸在硝酸锆(AR)水溶液(0.1 mol·L-1)中,持续搅拌4 h,然后蒸干剩余的液体,在120°C下干燥10 h后,于400°C焙烧4 h制得.
2.2 催化剂的表征
原位红外漫反射:将催化剂样品(低于100目)装入样品杯,在流动的H2/Ar混合气氛(30 mL·min-1)下程序升温至所需温度并还原30 min后,在氮气(30 mL·min-1)保护下降到室温,然后将催化剂体系抽空至10-3Pa并保持30 min后扫描背景.将甲醇蒸气通过脉冲进样引入系统,并在不同温度保持不同时间后进行扫谱.在扫描谱图过程中,分辨率为4 cm-1,扫描次数为64次.
程序升温还原(TPR):0.02 g催化剂装在U型石英微反应器中,通入含氢为5%(体积分数)的H2/Ar混合气(50 mL·min-1)到稳定,反应器温度从室温程序升温至550°C,升温速率为15°C·min-1.期间耗氢信号通过四极质谱仪(QMS200,Balzers Omni-Star)在线检测.
3 结果与讨论
当甲醇吸附在经280°C还原后的纯铜催化剂表面时,主要在1000-1010、2700-2800及3600 cm-1左右出现吸附峰,分别对应于C―O、C―H和H―O的伸缩振动峰,由于甲氧基和甲醇的C―O和C―H的伸缩振动峰的位置接近,但O―H伸缩振动峰的强度显著低于甲醇,说明体系中存在吸附态甲醇和甲氧基15(见图1),当体系的温度缓慢升到200°C的过程中,吸附态的甲醇以及甲氧基没有明显的变化,当吸附温度达到200°C时,甲醇和甲氧基的吸附峰明显降低,并伴随着吸附态CO2吸收峰的急剧产生(2370 cm-1附近),当在200°C持续7 min后,甲醇和甲氧基的吸附峰进一步降低,CO2峰进一步增强,当体系温度升到220°C时,甲醇和甲氧基的吸附峰完全消失,仅呈现很强的CO2吸收峰,说明Cu催化剂在280°C还原30 min后其表面还保持着一定量的氧物种,从而导致CO2迅速生成.

图1 甲醇在经280°C还原Cu催化剂表面吸附的红外图谱Fig.1 IR spectra of methanol adsorption on Cu reduced at 280°CFollowing the introduction of methanol vapor,the temperature of catalyst was maintained at 22°C for 10 min(a),at 200°C for 1 min(b),for 7 min(c),and at 220°C for 1 min(d).
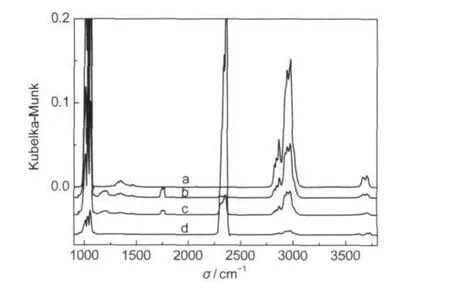
图2 甲醇在经350°C还原Cu催化剂表面吸附的红外图谱Fig.2 IR spectra of methanol adsorption on Cu reduced at 350°CFollowing the introduction of methanol vapor,the temperature of catalyst was maintained at 18°C for 10 min(a),at 200°C for 1 min(b),7 min(c),and 30 min(d).
为了去除Cu催化剂表面的氧组分,将还原温度提高到350°C,结果表明,吸附温度低于200°C时,还是仅呈现吸附态的甲醇以及甲氧基的吸附峰(见图2),当吸附温度达到200°C时,除了甲醇以及甲氧基的吸附峰大幅降低外,并在1750 cm-1出现一个吸附峰,对应于吸附态甲醛的羰基吸附峰,15-17并且随着吸附时间的延长,吸附态甲醇、甲氧基和甲酰基的吸附峰进一步降低,并且CO2的吸附峰显著增强,CO2的生成说明催化剂表面还是存在着氧物种.当进一步提高催化剂于400°C还原后,甲醇的吸附与反应的红外图谱和350°C还原后催化剂的甲醇吸附的图谱变化规律相似,只是在200°C吸附态甲醛的羰基吸收峰峰更强,并且转化为CO2的速度更慢.
结合TPD结果18以及甲醇在Cu/SiO2上的吸附15可以得出以下机理:

甲醇吸附在铜表面先形成甲氧基,然后脱氢形成吸附态甲醛物种,继续在氧物种的作用下,形成了CO2和H2.当催化剂表面氧物种丰富时,吸附态甲醛变成CO2的速率很快,以致于在图1中观测不到吸附态甲醛物种.通过实验还可以得出,铜物种的彻底还原比较困难,即使在400°C条件下,还依然剩余了少量的氧物种.纯铜表面存在着少量氧物种说明了纯铜催化剂具有较高的甲醇水蒸气反应的初始活性,13但是在甲醇的持续作用下,铜的表面氧物种会迅速消耗完全,从而导致铜催化剂的甲醇水蒸气重整反应的催化活性完全丧失.13

图3 甲醇在经280°C还原ZrO2/Cu催化剂表面吸附的红外图谱Fig.3 IR spectra of methanol adsorption on ZrO2/Cu reduced at 280°CFollowing the introduction of methanol vapor,the temperature of catalyst was maintained at 18°C for 10 min(a),at 200°C for 1 min(b)and 5 min(c).
对于ZrO2/Cu催化剂上的甲醇吸附,在200°C以下,催化剂表面主要呈现吸附态甲醇以及甲氧基的吸附峰(见图3),当体系温度升到200°C时,在1360、1380、1580 cm-1附近呈现了红外吸收峰,对应于甲酸盐的特征吸收峰,19-21并伴随着CO2吸收峰的急剧增加,说明甲酸盐与催化剂表面剩余氧作用形成了CO2.当甲醇吸附在经350°C还原后的ZrO2/Cu催化剂表面,当体系的温度升高至200°C时,催化剂表面未呈现明显甲酸盐吸收峰,在200°C保持20 min后,才出现微弱的CO2红外吸收峰(见图4),进一步增加吸附温度,甲醇的吸收峰才逐渐降低,CO2的吸附峰缓慢增加,当在250°C保持20 min,还可观测到很强的甲醇以及甲氧基吸收峰.
因此我们推出甲醇在ZrO2/Cu表面吸附和反应遵照以下的反应机理:

首先甲醇吸附在ZrO2/Cu表面并在ZrO2表面形成甲氧基,甲氧基在邻位氧物种作用下脱氢形成甲酸盐物种,甲酸盐物种进一步分解生成CO2和H2.但是当ZrO2/Cu还原温度升高后,催化剂表面氧物种急剧减少,并且在ZrO2表面形成了丰富的氧空位,22,23因此由甲氧基生成甲酸盐物种的速率显著降低,因而CO2的生成变得显著降低.而在甲醇水蒸气重整反应中,由于存在着水汽,而ZrO2可以有效地解离吸附水物种,从而有效地补充了催化剂表面消耗的氧物种,维持了表面甲酸盐进一步生成CO2的反应速率,使ZrO2/Cu催化剂相对于Cu保持了较高的甲醇水蒸气重整的反应活性和稳定性.13

图4 甲醇在经350°C还原ZrO2/Cu催化剂表面吸附的红外图谱Fig.4 IR spectra of methanol adsorption on ZrO2/Cu reduced at 350°CFollowing the introduction of methanol vapor,the temperature of catalyst was maintained at 18°C for 10 min(a),at 200°C for 20 min(b),at 230°C for 20 min(c),and at 250°C for 20 min.
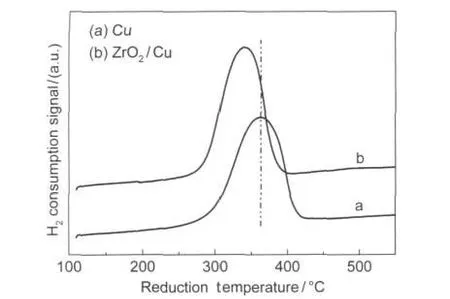
图5 催化剂的程序升温还原图Fig.5 Temperature-programmed reduction patterns of catalysts
通过以上实验结果可以看出,催化剂表面的氧物种对甲醇的吸附和反应起着决定性的作用,并且Cu与ZrO2/Cu经不同温度还原后吸附甲醇生成二氧化碳的速率变化表现出不同的规律.因此我们进一步对二者进行TPR表征(见图5),结果表明,相对于Cu,ZrO2/Cu的还原峰变窄,并且还原峰的位置向低温偏移了大约20°C,说明ZrO2的引入使铜的还原变得容易,此外,我们假定Cu催化剂所有铜组分彻底还原为零价铜,通过比较Cu和ZrO2/Cu耗氢的峰面积,推出ZrO2/Cu中的铜组分的还原度为119%.出现此计算结果原因可能有两个,第一,Cu催化剂在还原过程中未被彻底地还原;第二,ZrO2/Cu在还原过程中,不仅铜组分被还原而耗氢,而且ZrO2组分会消耗部分氢气而形成表面氧空穴.这两个原因也进一步支持了前面对甲醇在不同温度下还原的Cu和ZrO2/Cu表面吸附的红外谱图变化规律的解释.
4 结论
甲醇在Cu催化剂表面反应生成吸附态甲醛物种,进一步生成CO2,而在ZrO2/Cu表面形成甲酸盐物种,从而与表面氧进一步反应生成CO2.催化剂的表面氧物种对甲醇吸附、活化以及进一步反应起着重要的作用.
(1)Wu,G.;Sun,Y.;Li,Y.;Jiao,H.;Xiang,H.;Xu,Y.J.Mol. Struct.2003,626,287.
(2) Wu,G.S.;Ren,J.;Sun,Y.H.Acta Phys.-Chim.Sin.1999,15, 564.[吴贵升,任 杰,孙予罕.物理化学学报,1999,15,564.]
(3) Yao,C.;Wang,L.;Liu,Y.;Wu,G.;Cao,Y.;Dai,W.;He,H.; Fan,K.Appl.Catal.A 2006,297,151.
(4) Bianchi,D.;Cha⁃k,T.;Khalfallah,M.;Teichner,S.J.Appl. Catal.A 1993,105,223.
(5)Takezawa,N.;Shimokawabe,M.;Hiramatsu,H.;Sugiura,H.; Asakawa,T.;Kobayashi,H.React.Kinet.Catal.Lett.1987,33, 191.
(6) Bianchi,D.;Cha⁃k,T.;Khalfallah,M.;Teichner,S.J.Appl. Catal.A 1993,101,297.
(7) Bianchi,D.;Cha⁃k,T.;Khalfallah,M.;Teichner,S.J.Appl. Catal.A 1994,112,57.
(8) Bianchi,D.;Cha⁃k,T.;Khalfallah,M.;Teichner,S.J.Appl. Catal.A 1994,112,219.
(9) Szizybalski,A.;Girgsdies,F.;Rabis,A.;Wang,Y.; Niederberger,M.;Ressler,T.J.Catal.2005,233,297.
(10) Fisher,I.A.;Bell,A.T.J.Catal.1997,172,222.
(11) Sun,Y.;Sermon,P.A.J.Chem.Soc.Chem.Commun.1993, 1242.
(12)Wu,G.S.;Wang,Y.H.;Mao,D.S.;Lu,G.Z.;Cao,Y.;Fan,K. N.Acta Chim.Sin.2007,65,1757.[吴贵升,王宇红,毛东森,卢冠忠,曹 勇,范康年.化学学报,2007,65,1757.]
(13)Wu,G.;Wang,L.;Liu,Y.;Cao,Y.;Dai,W.;He,H.;Fan,K. Appl.Surf.Sci.2006,253,974.
(14) Wu,G.;Mao,D.;Lu,G.;Cao,Y.;Fan,K.Catal.Lett.2009, 130,177.
(15) Zhang,X.;Sun,Y.;Peng,S.Fuel 2003,81,1619.
(16) Rhodes,M.D.;Pokrovski,K.A.;Bell,A.T.J.Catal.2005,233, 210.
(17) Nitta,Y.;Suwata,O.;Ikeda,Y.;Okamoto,Y.;Imanaka,T.Catal. Lett.1994,26,345.
(18) Wachs,I.E.;Masix,R.J.J.Catal.1978,53,208.
(19) Narishige,N.;Niwa,M.Catal.Lett.2001,71,63.
(20) Fisher,I.A.;Bell,A.T.J.Catal.1999,184,357.
(21) Fisher,I.A.;Bell,A.T.J.Catal.1998,178,153.
(22) Liu,X.M.;Lu,G.Q.;Yan,Z.F.;Beltramini,J.Ind.Eng.Chem. Res.2003,42,6518.
(23) Tang,Q.;Hong,Q.;Liu,Z.J.Catal.2009,263,114.
October 17,2011;Revised:November 25,2011;Published on Web:December 6,2011.
In situ Infrared Characterization of Methanol Adsorption on ZrO2Modified Cu Catalysts
WU Gui-Sheng1,*MAO Dong-Sen1LU Guan-Zhong1,*CAO Yong2FAN Kang-Nian2
(1Research Institute of Applied Catalysis,Academy of Chemical and Environmental Engineering,Shanghai Institute of Technology, Shanghai 201418,P.R.China;2Department of Chemistry,Fudan University,Shanghai 200433,P.R.China)
The adsorption and reaction of methanol on Cu and ZrO2/Cu were investigated using in situ infrared diffuse reflectance spectroscopy,in which the catalysts were reduced at different temperatures in order to change the content of surface oxygen species and investigate the change trends of methanol adsorption and reaction over the catalysts with the oxygen species content.The results show that methanol is adsorbed on the surface of Cu to produce CO2via the intermediate of adsorbed formaldehyde,while the intermediate of formate is formed on the surface of ZrO2/Cu.The production rate of CO2via the intermediate becomes slower with the rise of the reduction temperature of the catalysts,illustrating that the content of oxygen species on the surface of the catalysts determines the formation of the intermediate and the reaction rate.
Methanol adsorption;In situ infrared diffuse reflectance;Cu;ZrO2/Cu
10.3866/PKU.WHXB201112062www.whxb.pku.edu.cn
*Corresponding authors.LU Guan-Zhong,Email:gzhlu@ecust.edu.cn.WU Gui-Sheng,Email:gswu@sit.edu.cn;Tel:+86-21-60877217.
The project was supported by the Shanghai LeadingAcademic Discipline Project,China(J51503)and Key Laboratory Project of Shanghai Molecular Catalysis and Function Materials,China(2009KF06).
上海重点学科(J51503)和上海市分子催化和功能材料重点实验室(2009KF06)资助项目
O643

