低温脂肪酶的分离纯化及酶学性质
王春雨, 迟乃玉, 张庆芳, 窦少华
(大连大学 生命科学与技术学院/辽宁省海洋微生物工程技术研究中心,辽宁 大连116622)
脂肪酶 (Lipase,EC3.1.1.3), 甘油三酰酯水解酶)是一类重要的工业酶,可以在油水界面上催化甘油三酯水解生成脂肪酸和甘油以及甘油一酯和甘油二酯,广泛存在于动物、植物各种组织及微生物中,是最早研究的酶类之一[1]。根据Msrgsin等人的定义[2],把最适酶活温度在30℃左右,在0℃左右仍有一定催化活性的脂肪酶称为低温脂肪酶。而大多数低温脂肪酶是由低温微生物生产,它们长期生活于低温环境中,如南极、北极以及海洋底部等极端环境中。目前所发现的产低温脂肪酶的低温微生物大都属于假单胞菌属(Pseudomonas),气单胞菌属(Aeromonas)等[3-4]。
低温脂肪酶具有高效、可低温下作用、作用周期短等优势,在应用上具有中高温脂肪酶无法取代的优越性,因此在食品、轻纺、化妆品、洗涤剂、有机合成、环境治理以及医药等领域上有广泛的应用前景。微生物脂肪酶种类多,作用温度及pH值范围比动植物脂肪酶广,底物专一性高,且便于工业生产以获得较高纯度的酶制剂,已成为工业生产脂肪酶的主要来源[5]。
1 材料与方法
1.1 材料
产低温脂肪酶菌株:由作者所在实验室从大连大黑山土壤和渤海海水中分离筛选得到。结合菌落形态学、生理生化特征和16S rDNA序列分析,参照齐祖同[6]和Accensi[7]等的方法,鉴定并命名为苏云金芽胞杆菌CZW001(BacillusthuringiensisCZW001)。
1.2 方法
1.2.1 苏云金芽胞杆菌CZW001发酵 将菌株CZW001活化后,接种于种子液中(胰蛋白胨1.0 g/dL,酵母提取物0.5 g/dL,NaCl 1.0 g/dL,琼脂1.5 g/dL,pH 7.0),20 ℃、160 r/min培养 12 h,转接于 100 mL发酵液中 (酵母膏 0.5 g/dL,(NH4)2SO40.5 g/dL,KH2PO40.2 g/dL,NaCl 0.3 g/dL,MgSO4·7H2O 0.05 g/dL,橄榄油体积分数 2%,pH 7.0),20 ℃、160 r/min培养2 d。发酵液4℃、10 000 r/min离心10 min,获取上清液。
1.2.2 硫酸铵沉淀 将100 mL发酵上清在冰浴中边搅拌边缓慢加入硫酸铵粉末至65%饱和度,4℃静置4 h。离心收集沉淀,将沉淀溶解于50 mL、0.05 mol/L pH 8.2的Tis-HCl缓冲液中,并用相同的缓冲液4℃透析12 h。
1.2.3 超滤浓缩 经截留相对分子质量为10 000的中空纤维柱超滤浓缩。
1.2.4 离子交换层析 先用Tis-Hcl缓冲液(0.05 mol/L pH 8.2)以0.5 mL/min的流速平衡DEAE-纤维素-52层析柱(1.6 cm×30 cm)5~10 个体积,直至UV280成水平直线上。将2 mL浓缩液加到层析柱上,用250 mL 0~1mol/L的NaCl以 0.3 mL/min的流速线性梯度洗脱。利用平板定性检测脂肪酶活性,收集含脂肪酶各管,测定其酶活,合并含酶活各管。
1.2.5 凝胶过滤层析 Sephadex G-100(Φ1.6×50 cm)预先用 Tis-Hcl缓冲液(0.05 mol/L pH 8.2) 以0.3 mL/min的流速平衡。将含脂肪酶样品2 mL超滤浓缩后上柱,用0.05 mol/L pH 8.2 Tis-Hcl缓冲液洗脱,收集有酶活性部分。
1.2.6 蛋白质浓度的测定 采用Bradford法[8]进行测定,以牛血清白蛋白为标准蛋白质。
1.2.7 脂肪酶活性的测定 采用分光光度计法测定脂肪酶活性。
2 结果与分析
2.1 脂肪酶的分离纯化
苏云金芽胞杆菌CZW001脂肪酶发酵上清液经硫酸铵沉淀、超滤离心、DEAE-纤维素-52离子交换层析和Sephadex G-100凝胶过滤层析等纯化步骤,脂肪酶纯化倍数为75.5倍,活性回收率为37.6%。其中DEAE-纤维素-52离子交换层析效果最佳,仅此一步就纯化了56倍,纯化效果见表1。SDS-PAGE凝胶电泳[9]显示纯化后的脂肪酶为单一条带,见图1,相对分子质量约为40 000。
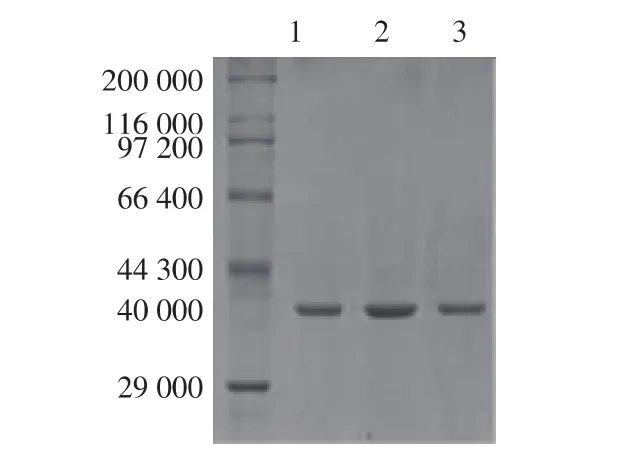
图1 12 g/dL SDS-PAGE电泳图谱Fig.1 12 g/dL SDS-PAGE of enzyme solution
2.2 低温脂肪酶酶学性质
2.2.1 pH对脂肪酶活力的影响 在30℃、pH 4.0~10.0的缓冲溶液中分别测定脂肪酶,测定3次求平均酶活力,结果见图2。该脂肪酶的适宜作用pH范围在 7~9,最适 pH 为8。

表1 脂肪酶的纯化Table 1 Purification of Bacillus thuringiensis CZWOO1 lipase

图2 pH值对酶活力的影响Fig.2 Effects of pH on lipase activity
2.2.2 温度对脂肪酶活力的影响 在pH 8.0条件下,测定0~45℃酶活力与温度的关系,结果见图3。CZW001脂肪酶活力在25℃达到最高,在0℃是仍具有酶活,相对酶活达10%。

图3 温度对酶活力的影响Fig.3 Effects of temperature on lipase activity
2.2.3 温度对酶稳定性的影响 将酶液在不同温度下作用不同时间,测定低温脂肪酶残余活力。结果见图4。菌株CZW001脂肪酶稳定性较差,在60℃处理30 min,酶活损失达70%。
2.2.4 金属离子对酶活性的影响 酶催化效果受诸多因素的影响,如不同的金属离子对酶活力的影响不同。它们有可能是酶的组成部分,也有可能是酶的激活剂或抑制剂。因而向酶解环境中或酶制剂储存过程中添加不同的金属离子对酶的催化效率及其稳定性影响较大,在酶反应液中加入Pb+、Na+、Ca2+、Mg2+、Al3+、Li+、Zn2+、Mn2+、Cu2+、Fe2+及 EDTA,使其终浓度为1 mmol/L,同时以不加金属离子的酶液作为对照,测定脂肪酶的活性,结果见图5。Ca2+、Mg2+和Cu2+能提高脂肪酶的活力,尤其是Ca2+作用最为明显,达到 230%。 Al3+、Zn2+、Fe2+对苏云金芽孢杆菌CZW001脂肪酶有显著的抑制作用,尤其是Zn2+和Fe2+,仅保留32%和24%的残余酶活力,这与Sugihara 报道的实验结果一致[10]。 Pb+、Na+、Li+、Mn2+和EDTA对苏云金芽胞杆菌CZW001脂肪酶活力影响不明显。

图4 温度对酶稳定性的影响Fig.4 Effects of temperature on lipase stability

图5 金属离子及EDTA对酶活性的影响Fig.5 Effect of metal ion and EDTA on enzyme
2.2.5 不同有机溶剂对脂肪酶活力的影响 如图6所示,脂肪酶对醇类有机溶剂的耐受性随碳链增加而减小,因此在进行醋化反应或转醋反应时宜选用短链醇或短链酯(如乙酸甲酯)作为反应底物。

图6 脂肪酶在不同有机溶剂中的稳定性Fig.6 Effect of various organic solvents on lipase stabilily
2.2.6 脂肪酶对不同油脂的水解特异性 分别以橄榄油、豆油、桐油、菜籽油、茶油、棉籽油、蓖麻油和三油酸甘油醋作为水解底物,测定脂肪酶活力,结果见图7。
该脂肪酶对豆油表现明显的特异性,对橄榄油、桐油、菜籽油、茶油、棉籽油、蓖麻油、三醋酸甘油酯未表现出特异性,而水解蓖麻油能力最低,是蓖麻油酸值过高(大于33.45)抑制了脂肪酶的水解活力,而不是因为油脂中脂肪酸碳链长度的差异造成的(上述油脂中主要脂肪酸碳链均为C18)。
3 结语
Bacillus thuringiensis CZW001脂肪酶发酵上清液经硫酸铵沉淀、透析、超滤离心、DEAE-纤维素-52离子交换层析和Sephadex G-100凝胶过滤层析得到电泳纯的脂肪酶,跑SDS-PAGE凝胶电泳,相对分子质量大约为40 000,与已报道低温脂肪酶相对分子质量大小有区别,如Pseudomonas frasi脂肪酶相对分子质量为 32 500[11],Pseudomonas sp.Strain KB700脂肪酶相对分子质量为49 900[12]。
Bacillus thuringiensis CZW001脂肪酶的最适作用温度为25℃,对热敏感,60℃处理30 min仅残留30%酶活性,酶的适宜作用pH范围在7~9,最适pH为8,大多低温脂肪酶对热敏感,如Pseudomonas sp.Strain KB700脂肪酶[12]在60℃处理5 min,残余酶活就急剧降低70%,LipP[13]在60℃处理30 min,残余酶活为25%。
Bacillus thuringiensis CZW001脂肪酶的水解活性对 Ca2+表现明显的依赖性,而 Al3+、Zn2+和 Fe2+对脂肪酶有显著的抑制作用。到目前为止,细菌脂肪酶Ca2+的结合位点和Ca2+对脂肪酶的激活机理己基本清楚,但脂肪酶活性对Ca2+的依赖性表现出来的差异是否说明了脂肪酶在结构上存在差异[14],有待进一步证实。
总之,该低温脂肪酶具有高效、耐碱和对热敏感等特点,在食品、洗涤、纺织以及环境治理等领域有良好的应用前景。尤其在食品行业中,由于对热敏感,从而避免高温灭活对食品品质产生的破坏。
[1]QU YEN D T,SCHMIDT-DANNERT C,SCHMID R D.High-level expression of a lipase from Bacillus thermocatenulatus BT L2 in Pichia pastoris and some properties of the recombinant lipase[J].Protein Expression and Purification,2003,28 (1):102-110.
[2]林学政,边际.极地微生物低温适应性的分子机制[J].机制极地研究,2003,15(1):75-82.LIN Xue-zheng,BIAN ji.Molecular mechanism of cold-adaptation of polar microorganisms[J].Chinese Journal of Polar Research,2003,15(1):75-82.(in Chinese)
[3]Rashid N,Shimada Y.Low-temperature lipase from psychrotrophic Pseudomonas sp.strain KB700A [J].Applied and Environmental Microbiology,2001,67(9):4064-4069.
[4]Han-Ki Lee,Min-Jung Ahn.Purification and characterization of cold active lipase from Psychrotrophic aeromonas sp.LPB 4[J].The Journal of Microbiology,2003,41(1):22-27.
[5]王蕾,蔡宇杰.一株碱性低温脂肪酶产生菌发酵条件的优化[J].食品与生物技术学报,2008,27(3):1673-1689.WANG Lei,CAI Yu-jie.Optimization of eermentation conditions for a low-temperature lipase-producing strain[J].Journal of Food Science and Biotechnology,2008,27(3):1673-1689.(in Chinese)
[6]Qi Z T.Flora Fungorum Sinicorum:Aspergilluset teleomorphi Cognati[M].Beijing:Science Press,1997.
[7]Accensi F,Cano J,Fignera L,et al.New PCR method to differentiate species in the Aspergillus niger aggregate[J].FEMS Microbiology Letters,1999,180(2):191-196.
[8]Braford M M.A rapid and sensitive method for the quantitation of micrograrn quantities of protein utilizing the principle of protein dye binding[J].Analytical Biochemistry,1976,72:248-254.
[9]Laemmli U K.Cleavage of structura1 proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[10]Sugihara A,Shimada Y,Tominaga Y.Purification and characterization of Aspergillus niger lipase[J].Agricultural and Biological Chemistry,1988,52(6):1591-1592.
[11]Alquati C L,De Gioia,G Santarossa,et al.The cold-active lipase of Pseudomonas fragi.heterologous expression,biochemical characterization and molecular[J].Eur J Biochemical,2002,269:3321-3328.
[12]Rashid N Y,Shimada S,Ezaki H Atomi,et al.Low-temperature lipase from psychrotrophic Pseudomonas sp.strain KB700A[J].Appl Environ Microbiol,2001,67:4064-4069.
[13]Choo,D W T Kurihara,T Suzuki,et al.A cold-adapted lipase of an alaskan psychrotroph,Pseudomonas sp.strain B11-1:gene cloning and enzyme purification and characterization[J].Appl Environ Micobiol,1998,64:486-491.
[14]Amada K,Kwon H J,Haruki M,et al.Ca2+-induced folding of a family I.3 lipase with repetitive Ca2+binding motifs at the C-terminus[J].FEBS Letters,2001,509(1):17-21.

