MnO2催化KCIO3热分解机理探究
毛立可 赵临远
MnO2催化KCIO3热分解机理探究
毛立可1赵临远2
(1宁夏育才中学宁夏银川750011;2广西师范大学化学化工学院广西桂林541004)
文章将KClO3和MnO2混合体系在一个固定的温度下较长时间的加热,通过计算失重率确定混合体系热分解温度和分析纯KClO3热分解温度相同,即330℃混合体系开始分解,认为MnO2对KClO3热分解催化作用是液-固催化。同时根据前人及目前实验中出现的各种实验现象,提出了混合体系热分解机理。
KClO3;MnO2;热分解;机理研究
目前关于KClO3在MnO2催化作用下的热分解机理主要有以下两种观点:

本文是通过将KClO3和MnO2混合体系在一个固定的温度下较长时间的加热,计算失重率以确定分解温度。最后得出结论认为在固态时MnO2不催化KClO3的热分解,混合体系热分解温度和分析纯KClO3热分解温度相同,即330℃混合体系开始分解。
一、实验部分
1.实验方法
按比例称取一定量的KClO3和MnO2于10mL坩埚中,使反应混合物在坩埚底部平铺一薄层。把坩埚放入蒸发皿中,在蒸发皿上方0.3cm处设置瓷质隔热板。隔热板能防止电阻炉顶部电炉丝受热时产生的光辐射对样品热分解带来影响、防止异物落入坩埚中影响失重率的测定、能够使热分解过程中崩射的样品反弹到蒸发皿中便于回收以准确计算失重率。把样品放入电阻炉里在不同温度下加热,最后称量、计算KClO3的失重率,并由失重率确定KClO3和MnO2混合体系热分解温度。在一定的温度下加热不同时间,计算KClO3的失重率并绘制失重率随时间变化曲线,即KClO3和MnO2混合体系热分解动力学曲线。
2.混合体系热分解温度
把KClO3和MnO2按3∶1、10∶1、20∶1、50∶1等四种不同比例组成混合体系,分别在150、160、180、190、200、220、240、280、300、320℃等不同温度下加热2小时,没有发现崩射现象,失重率都为0。KClO3和MnO2按3∶1组成的混合体系在330℃加热2小时失重率为1.59%,甚至比分析纯KClO3在此条件下失重率还低,说明MnO2在固态时不催化KClO3热分解。由此得到结论为混合体系热分解温度为330℃。
3.混合体系热分解动力学曲线
称取五份KClO3和MnO2按3∶1组成的混合体系,分别在360℃条件下加热0.34、0.5、1、1.5、2小时,称量、计算失重率、绘制混合体系热分解动力学曲线,见图1。
从图1可以看到KClO3和MnO2混合体系热分解速度很快,在360℃20分钟就达到4.72%,但也要看到2个小时只分解6.78%。这是因为在360℃时KClO3已经熔化,MnO2仍处于固体状态,MnO2密度较大沉积在反应物底部。在均相催化作用中,催化剂与反应物处于同一相,没有相界存在,可以说是一维化学反应。在多相催化作用中,催化剂与反应物不同相,有相界或界面存在,其催化作用主要是在界面发生。MnO2沉积在反应物底部使得KClO3和MnO2接触面较少。另外随着反应的进行,有较多的KCl生成,其覆盖在KClO3或MnO2的表面,隔离了KClO3和MnO2,减少了反应物之间的接触机会。这样使得MnO2未能充分发挥催化作用,所以随着反应进行速度越来越慢,从20分钟到两个小时,失重率没有明显的变化。从动力学曲线上可以看到这一点,一个小时以后反应几乎没有变化。

图1 KClO3和MnO2混合体系热分解动力学曲线
二、混合体系热分解机理探讨
对KClO3和MnO2混合体系的热分解,我们认为MnO2对KClO3热分解催化作用是液-固催化。混合体系在150-320℃之间没有发生分解反应,在330℃发生的分解反应也比较慢,是KClO3自身热分解反应,这说明固态MnO2对KClO3热分解反应没有起到催化作用。为了验证这一点,我们把炉腔温度先升到370℃并维持一分钟左右,使得KClO3处于熔化状态。然后打开电阻炉使炉腔温度迅速降到340℃,在340℃条件下加热混合体系0.5小时失重率为3.52%。在前面我们做KClO3热分解反应也做了类似实验,分析纯KClO3如果先在370℃加热一段时间使其处于熔化状态,然后在340℃条件下加热混合体系0.5小时失重率为0。这也证实了MnO2对KClO3热分解催化作用是液-固催化。对于MnO2催化机理,冯增媛等、W.K.Rudloff等指出过渡金属氧化物做催化剂,d电子数目起到很关键的作用,d电子层为半充满或接近半充满状态时催化能力最强,d电子层为充满(全空)或接近全充满(全空)状态时催化能力最弱。我们认为锰的价电子构型3d54s2,3 d处于半充满状态,4s处于全充满状态,而4p、4d均为全空,有能量较低的空轨道,可接受电子对形成络合物。
我们推测其反应机理为:KClO3中氧原子上有孤对电子,可进入空轨道与MnO2形成过渡中间物K2[Mn(ClO3)2O2],由于络合物的生成,形成了配位键Mn-O键,消弱了Cl-O,从而使Cl-O易于断裂,催化了KClO3热分解。

我们认为反应过渡中间物很快分解为KMnO4、KClO2、ClO2。该机理能够很好解释一些实验现象。在360℃加热KClO3和MnO2混合体系时我们发现MnO2沉积在熔融物的底部,上层为透明的KClO3晶体夹杂紫红色,紫红色晶体是KMnO4。对于那些气态中间物,学者们发现有Cl2、O3、Cl2O7、ClO2,用该机理也可以给予很好解释。过渡中间物分解生成的KClO2很不稳定,可能要发生下列反应:
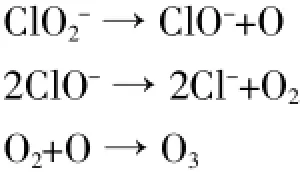
这些反应历程可以解释O3的生成机理,Cl2的生成可能是ClO2发生了分解反应:2ClO2→Cl2+2O2。对于该机理提出的要生成ClO2气体,J.M.Gaidis等对气态产物做了认真研究。发现KClO3和MnO2混合体系热分解生成的气态产物具有很强氧化性,可以氧化质谱仪连接部分用于密封的烃类化合物。作者通过质谱仪对气态产物进行研究,在35.2和30.8处有很强的质谱峰,没有发现35、37、70、72的各种氯的特征峰。作者又对Cl2O7、ClO2、Cl2的质谱进行了研究,发现Cl2O7、ClO2样品呈现出和氯酸钾分解气体产物相同的质谱峰,即Cl2O7样品在35.2和30.8处存在中等强度的质谱峰,ClO2样品在30.8处存在一个中等强度的质谱峰,作者由此认为氯酸钾分解的气体产物是Cl2O7、ClO2。J.M.Gaidis等人的发现非常吻合我们提出的机理,我们认为Cl2O7气体是在高温时KClO3自身分解生成KClO4,KClO4可发生如下反应:2KClO4→2K2O+ Cl2O7。
根据上述讨论,我们认为所提出的机理是可靠的,能够解释前人及目前实验中出现的各种实验现象。
[1]马世昌.基础化学反应[M].西安:陕西科学技术出版社, 2003:46
[2]人民教育出版社化学室主编.化学教师教学用书[M].北京:人民教育出版社,1995:31
[3]J.M.Gaidis,E.G.Rochow.The catalyzed decomposition of potassium chlorate[J].J.Chem.Edu.,1963,43(2):78-81
[4]廖代伟.催化科学导论[M].北京:化学工业出版社,2006:27
1008-0546(2013)04-073-02
G633.8
B
10.3969/j.issn.1008-0546.2013.04.031

