射频消融过程中肝组织热传导效应的模拟实验研究
姜凯,苏明,刘洋,赵向前,张文智,王敬,董家鸿,黄志强
射频消融(radiofrequency ablation,RFA)是利用交变电流产生的射频波引起区域组织内离子与极性分子的震动摩擦而产生相应的热效应,使肿瘤病灶的温度升高至有效的治疗温度(蛋白质凝固变性温度为>55℃)并维持一定时间,以达到使肿瘤细胞完全坏死的目的[1]。射频消融是广泛应用于肝细胞癌的有效微创治疗手段[2],但是当肿瘤毗邻主要胆管、血管、膈肌和胆囊等特殊部位时,射频消融的实施会存在一定的不确定因素和技术问题,如果对局部高热量传导范围不能进行确切控制,可能会导致肿瘤消融不完全或严重并发症[3-4]。为达到肿瘤的一次性完全消融,同时避免严重并发症的发生,需要了解射频消融局部产生的高热在肝肿瘤与组织中的传递规律,以达到对局部热量热传导范围(>55℃)的有效控制。目前关于肝组织热传导效应(heat conduction effect,HCE)温度、时间与传导范围之间的关系尚未见报道。本研究根据组织的生物物理学特性,模拟射频消融产生的局部高热,对射频消融区域周围肝脏组织中热传导效应的作用范围进行初步探讨,以期为临床安全有效的射频消融治疗提供理论依据。
1 材料与方法
1.1 主要材料及仪器 离体新鲜猪肝12个(青岛龙大肉食品有限公司),生理盐水(青岛制药有限公司),数显生化培养箱(常州国华电器有限公司),HWP系列八回路数字显示控制仪(泰州海格仪表有限公司),恒温水浴锅HHZ(江苏新一佳仪器有限公司)。
1.2 实验设计 采用恒温水流作为加热源,选取离体猪肝进行热传导实验,分别设定60、70、80、90℃恒温水流加热,模拟射频产生的局部热量,探讨局部加热条件下离体肝组织内温度场的变化及规律,以组织内温度达到>55℃为标准测定热传导效应的有效作用范围。
1.3 实验步骤 ①取新鲜猪肝中较大肝段(>10cm×8cm×6cm),置于恒温生化培养箱内保温。待猪肝各部温度达到预定温度(36.5℃)时准备实验;②将自制的加热循环回路按顺序依次连接好,选择金属钢管(直径5mm)贯穿猪肝加强热量传递;③安装测温热电偶,设定电偶与加热源之间的距离分别为5、10、15、20、25、30、35、40mm。整个体系如图1所示。重复步骤①和②两次,同样采集数据,取相同距离采温点的平均值。
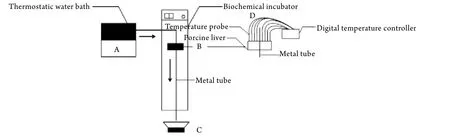
图1 离体猪肝热传导性热源控制系统与热传导温度测试装置示意图Fig.1 Heat source control system and heat conduct temperature measurement apparatus used for testing heat conduction effect in detached porcine liver (schematic layout)Add saline into thermostatic water bath (A), making the flow of water through detached porcine liver (B) in thermostatic biochem ical incubator bypass metal tube (black arrow), and flowing into saline collector (C). D was the arrangement of digital temperature controller and multiple temperature probes
1.4 数据采集 系统温度稳定后,打开阀门控制水的流量,使金属加热管的温度维持目标温度。记录时间间隔为200、400、600、800、1000、1200、1400、1600、1800、2400s时温控仪显示的温度数据,于不同热源温度(60、70、80、90℃)条件下,获取测温热电偶所测定的温度数据。
1.5 图像采集 采集实验开始前恒温处理猪肝与实验40m in后不同热源温度(60、70、80、90℃)下猪肝大体病理学标本图像。
2 结 果
2.1 数据采集结果 距离采温点5mm处,60℃组在40m in后最高温度仅52℃(且在5~10mm范围内随时间增加均不能达到55℃);70℃组在10m in时达到55℃;80℃组在7m in时达到55℃,17m in后维持在62~63℃;90℃组仅3m in即达到55℃,6.5m in后随时间增加温度维持在62.5~68.0℃。距离采温点10mm处,80℃组在40min后达到55℃,但随时间增加再无明显变化;90℃组25m in后持续维持在55℃以上(图2)。
2.2 图像采集结果 60℃组在5mm范围内,钢管周围肝组织颜色略有变化;70℃组在5mm范围内肝组织色泽变深褐色,边缘稍隆起,10mm采温点无明显变化;80℃组10mm范围内,色泽变白色,并出现凹陷,10mm采温点外无明显变化;90℃组10mm范围内变化显著,呈现白色明显凝固凹陷(图3)。
3 讨 论
1992年,MeGahan等[5]和Rossi等[6]首先采用原始射频消融电极的热力学原理进行动物肝脏灭活实验,产生的中心环状凝固性坏死直径小于1.0cm,且普通单电极一次最大破坏半径约为1.6cm,坏死区域形状类似射频头端,呈圆柱状,很难达到无缝一次消融。Goldberg等[7]对射频消融电极形状与破坏范围的关系进行了研究,发现两者在长度方面呈线性相关。Rossi等[6]报道破坏范围大小与治疗过程中组织有效的平均温度有关,治疗温度高于50℃时,组织开始凝固变性,破坏区域随温度增加而扩大,然而,当温度达到110℃后组织迅速碳化,阻抗增大,反而影响热量的有效传递,降低治疗效果。
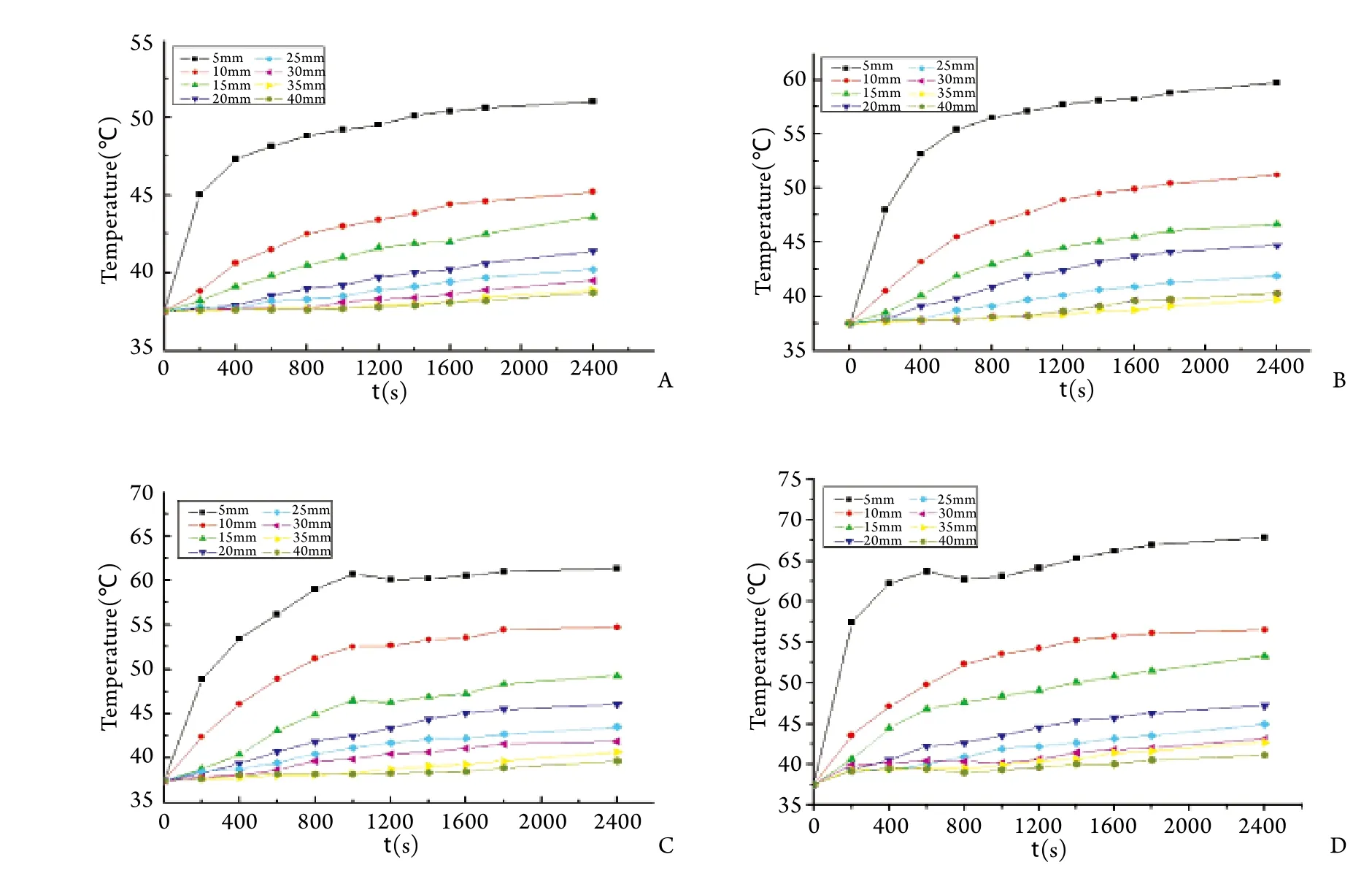
图2 不同热源温度条件下测温热电偶所测定的温度数据Fig.2 Temperature data detected by thermocouple at different temperature of heat sourceA. 60℃ thermostat group; B. 70℃ thermostat group; C. 80℃ thermostat group; D. 90℃ thermostat group
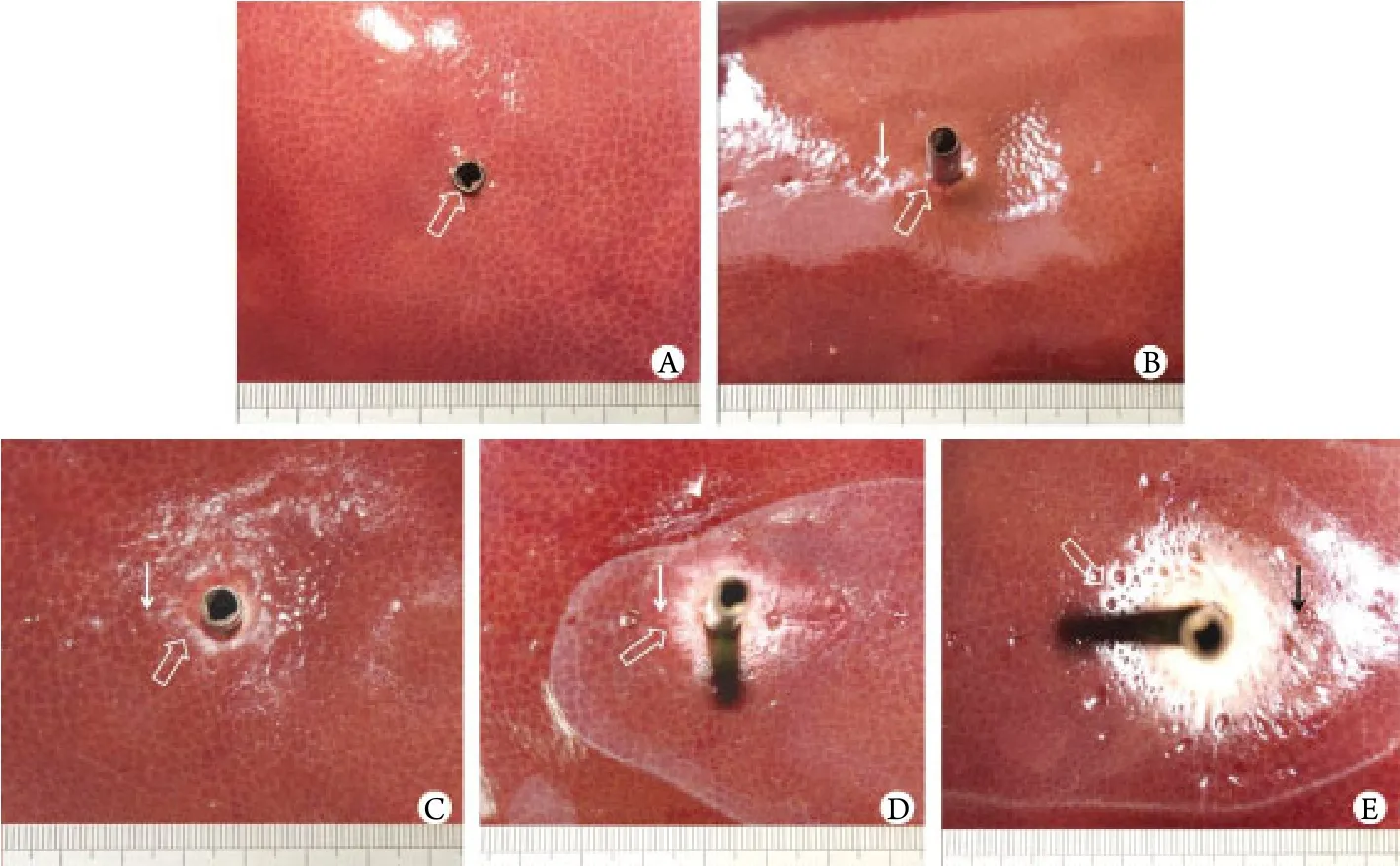
图3 不同热源温度条件下的肝脏图像Fig.3 Liver image at different temperature of heat sourceA. Liver manifestation and heating tube (white hollow arrow) at 36.5℃ thermostat; B. 60℃ thermostat group [only tissue around tube showed slight change in color (white hollow arrow), solid arrow pointed to probe at 5mm away from the tube]; C. 70℃ thermostat group [liver tissue changed into dark brown was seen in 5mm circum ference, and the margin apophysis was seen (white hollow arrow), however, no change at 10mm point (white solid arrow)]; D. 80℃ thermostat group [color extended to 10mm circum ference changed into white and the surface sunk down (white hollow arrow), outside of which showed no change (white solid arrow)]; E. 90℃ thermostat group [obviously changed into white and sinking (white hollow arrow) inside of 10mm circum ference, and the black solid arrow was pointing at 10mm temperature probe]
根据Stauffer提出的在生物体中适用的物理学导电公式P=|I|2/32π2r4σ(P为功率,I为电流强度,r为到电极的间距,σ为组织的导电性)推导,射频消融电流会在较短距离内将电能转化为热能,迅速接触引起的局部温度过高、组织脱水及气化会导致阻抗升高,热传导效率降低,从而影响能量的有效扩散[8]。研究显示,采用冷循环模式的射频消融治疗仪,治疗过程中始终维持头端温度20℃左右,可较大程度提高热传导效率,有效增加“破坏”覆盖范围[5-7]。Goldberg等[7]则探讨了通过电阻调控射频消融电流幅度的方式增大治疗半径的方法。上述研究着重强调了射频消融技术对肝组织的有效直接破坏范围,对肝肿瘤完全消融的临床实际应用起到了重要的指导作用。随着射频消融设备与方法的不断改进,消融范围的改善,肿瘤的完全消融率逐渐提高[9-10]。然而,若肿瘤毗邻主要胆管(距离<0.5cm以内)时,因处于射频消融治疗的直接破坏范围内,将对胆管造成严重的完全损伤并发症。因此,在射频消融覆盖的直接范围之外,了解热传导效应的有效破坏范围,对既达到肿瘤的完全消融,同时也避免对胆管的完全损伤具有重要的临床意义。
为深入了解热沉降效应(heat-sink effect,HSE)的局部能量衰减作用,Rossi等[11]采用活体猪肝进行研究,结果发现适当的入肝血流阻断会扩大破坏半径,即Pringle's法﹥门脉阻断﹥肝动脉阻断﹥无血流阻断。本研究采用实验热源模拟射频消融的区域温度,取用新鲜离体猪肝,无入肝与出肝血流(即全肝阻断),模拟Pringle's法,使得肝组织热传导温度衰减最小,而破坏范围达到最大限度。
在本实验所设定的40m in时间范围内,随着采温点距离的增加,温度衰减加剧,尤其当采温点距离>15mm时,在4个不同的加热温度下,所测温度均处于55℃以下,不能达到组织凝固变性,表明该模拟条件下,对于离体肝脏组织来说,单纯热传导效应引起的有效组织凝固变性距离在15mm以内。在距离热源相等的采温点,热源温度越高,达到目标温度(55℃)所需要的时间越短。如在10mm处的采温点,80℃组达到55℃以上需要40m in,90℃组仅需25m in即可,而其他两组(60℃与70℃)在实验时间内则无法达到目标温度;在5mm处,70℃、80℃与90℃组达到55℃的时间分别为10min、7min与3min(图2)。这些数据的临床意义在于,应使胆管等重要器官处于射频消融的直接作用范围外,并根据射频消融区域温度及时调整电极位置及持续时间,通过热沉降效应毁损胆管壁等特殊部位的肿瘤组织,以达到一次性完全消融的目的,避免因射频消融直接导致的严重并发症。
终止热源后,观察肝组织大体病理学标本变化发现,随着热源温度的升高,热源中心附近组织凝固变性的范围依次增加。当热源温度在70℃以上时,10m in以内有效作用半径均可达到5mm。80℃、90℃组在距加热管中心10mm的范围内均可达到55℃以上,就有效治疗温度的范围而言,与60℃与70℃两组相比有明显差异。其中,90℃组的破坏范围较理想,其覆盖同样距离所需的时间也最短,保证了热量传递的有效性。因此,热源温度控制在80~90℃,时间持续25~40m in,热传导效应的有效作用范围在10mm。在肝脏处于正常血流灌注的情况下,在射频消融治疗过程中加强直接消融范围内的能量给予,提高消融区域温度,使之维持在80℃以上,并持续必要的作用时间,可达到利用热沉降效应毁损胆管壁处的肿瘤,并避免胆管完全损伤的目的。当肿瘤靠近较大血管(直径>3mm)时,热沉降效应使热量衰减,理论上将减小热传导效应作用的有效范围,但有待活体动物实验进一步研究证实。
综上所述,本研究结果显示,热源维持足够高的温度(>80℃)和作用时间,可以提高热传导效应的有效覆盖范围。当热源温度维持在80~90℃、持续25~40m in时,热传导效应可使周围肝组织10mm范围边缘达到55℃以上的治疗温度。
[1] Lau WY, Leung TW, Yu SC, et al. Percutaneous local ablative therapy for hepatocellular carcinoma:a review and look into the future[J]. Ann Surg, 2003, 237(2): 171-179.
[2] Ansari D, Andersson R. Radiofrequency ablation or percutaneous ethanol injection for the treatment of liver tumors[J]. World J Gastroenterol, 2012, 18(10): 1003-1008.
[3] Soon JL, Jeyaraj PR, Agasthian T. Thoracic complications of radiofrequency ablation of recurrent hepatoma[J]. Ann Acad Med Singapore, 2008, 37(1): 75-76.
[4] Kim YS, Rhim H, Lim HK, et a l. Hepatic infarction after radiofrequency ablation of hepatocellular carcinoma with an internally cooled electrode[J]. J Vasc Interv Radiol, 2007, 18(9):1126-1133.
[5] MeGahan JP, Brock JM, Tesluk H, et al. Hepatic ablation with use of radio-frequency electrocautery in the animal model[J]. J Vasc Interv Radiol, 1992, 3(2): 291-297.
[6] Rossi S, Fornari F, Pathies C, et al. Thermal lesions induced by 480 kHz localized current field in guinea pig and pig liver[J].Tumori, 1990, 76(1): 54-57.
[7] Goldberg SN, Gazelle GS, Dawson SL, et al. Tissue ablation with radiofrequency: eff ect of probe size, gauge, duration, and temperature on lesion volume[J]. Acad Radiol, 1995, 2(8): 399-404.
[8] Miao Y, Ni Y, Mulier S, et al. Ex vivo experiment on radiofreguencyliver ablation with saline infusion through a screw-tip cannulated electrode[J]. J Surg Res, 1997, 71(1): 19-24.
[9] Rhim H. Com p lications of radiofrequency ab lation in hepatocellular carcinoma[J]. Abdom Imaging, 2005, 30(4): 409-418.
[10] Livraghi T, Goldberg SN, Lazzaroni S, et al. Hepatocellular carcinoma: radio-frequency ablation of medium and large lesions[J]. Radiology, 2000, 214(3): 761-768.
[11] Rossi S, Garbagnati F, De Francesco I, et al. Raltionship between the shape and size of radiofreguency induced thermal leisions and hepatic vascularization[J]. Tumori, 1999, 85(2): 128-132.
——猪肝泥

