人p21活化激酶6基因真核表达质粒的构建及其亚细胞定位
刘彤,李丹妮,李洋,李丰
(1.中国医科大学基础医学院细胞生物学教研室/教育部医学细胞生物学重点实验室,辽宁沈阳 110001;2.中国医科大学 七年制临床医学94期,辽宁沈阳 110001)
PAK(P21-activated kinase)是Rho家族小鸟苷三磷酸酶(Rho-GTPase)下游保守的丝氨酸/苏氨酸蛋白激酶。PAK家族成员参与许多重要的细胞活动,如细胞骨架重建、细胞移动/迁移、细胞凋亡与生存、细胞周期与有丝分裂,而且与肿瘤细胞的侵袭转移密切相关[1-3]。PAK家族有6个成员,第Ⅰ亚类包括PAK1-3,第Ⅱ亚类包括PAK4-6。第Ⅰ亚类成员含有自我抑制域,其激活依赖于上游 Rho-GTPase,如 Cdc42/Rac1。而第Ⅱ亚类成员不含有自我抑制域,表达后拥有持续的激酶活性[4-5]。
PAK6为Ⅱ类PAK家族的成员之一,它是以AR的配体结合域(LBD)上的氨基酸序列629-919,通过酵母双杂交识别筛选出来的雄激素受体关联蛋白,主要表达于前列腺、睾丸和大脑等器官[6]。PAK6基因总长2 055个碱基对,编码681个氨基酸,表达75 kDa蛋白质。根据文献报道,PAK6能与细胞骨架关联蛋白IQGAP1(IQ domain-containing GTPase-activating protein 1)相互作用,提示PAK6可能在神经发育以及神经系统疾病中具有重要作用[7-8]。PAK6能够同时与雄激素受体与雌激素受体相互作用[9],显示PAK6与激素类受体的生理学功能相关联。PAK6在前列腺癌中呈现高表达,尤其是在雄激素非依赖的情况下PAK6的过表达尤为明显[8],说明PAK6在前列腺癌的恶性进程中具有重要的作用,而且PAK6能够磷酸化雄激素受体的DNA结合结构域,并以激酶依赖性的方式抑制雄激素受体的转录激活作用[10]。因此构建PAK6真核表达载体并确定其亚细胞定位对研究PAK6的生物学功能有重要的作用。
本实验通过PCR扩增PAK6基因,构建了PAK6真核表达质粒并确定了PAK6蛋白的亚细胞定位。
1 材料与方法
1.1 材料与试剂
大肠杆菌DH5α感受态细胞以及人胚肾HEK293细胞为本实验室保存,pcDNA3.1HisC真核表达载体及转染试剂Lipofectamin 2000购于美国Invitrogen公司。DMEM培养基及10%胎牛血清购自GIBCO公司。各种限制性内切酶、PyrobestTM DNA polymerase、电泳凝胶回收试剂盒均购自TakaRa公司;质粒纯化抽提试剂盒购自Promega公司。蛋白分子质量标准购自MBI公司,DNA分子量标准购自 TaKaRa公司。T4 DNA连接酶购自NEB公司,引物序列合成及DNA序列测定由南京金斯瑞有限公司完成。其他试剂均为国产分析纯。Anti-PAK6抗体购自Abcam公司,Anti-His抗体购于南京金斯瑞公司,Anti-GAPDH、HRP标记山羊抗小鼠抗体购自上海康成公司,Alex Flour 488绿色荧光染料购自Molecular Probes公司。
1.2 PAK6真核表达质粒的构建
以胎脑文库cDNA为模板,利用PyrobestTM DNA polymerase设计引物进行PAK6基因的PCR扩增获得片段。将扩增的片段利用EcoRⅠ/XhoⅠ酶切后用T4 DNA连接酶连接到经同样酶切的pcDNA3.1HisC真核表达载体上,16℃过夜,得到连接产物。取3 μl上述连接反应液转化感受态细胞E.coli DH5α中,涂布于含氨苄西林的LB琼脂平板,37℃培养过夜。挑取白色菌落4个,接种于含氨苄西林3 ml的LB培养液中,37℃振荡过夜。用碱裂解法制备质粒DNA,用EcoRⅠ/XhoⅠ双酶切鉴定重组质粒,并送去南京金斯瑞公司进行测序,经测序正确后,将构建的质粒命名为pcDNA3.1HisC-PAK6。
1.3 免疫印迹实验验证PAK6蛋白在真核细胞中的表达
HEK293细胞正常培养于含有10%胎牛血清的DMEM培养基中。细胞的融合度达到60%时,按照转染试剂Lipofectamin 2000的说明书进行转染。转染后6 h更换新鲜培养基并继续培养16 h后收集细胞。RIPA裂解液中裂解细胞沉淀以提取总蛋白[50 mmol·L-1Tris/HCl(pH 7.4),150 mmol·L-1NaCl,1%Nonidet P-40,0.25%Na-deoxycholate,1 mmol·L-1EDTA and protease inhibitor cocktail]。裂解提取的总蛋白定量变性后,取等量蛋白经10%SDS-PAGE凝胶分离,恒流0.09 mA转印2 h至PVDF膜上,用5%脱脂奶粉封闭1 h,TBST洗膜 15 min×3,加入 Anti-PAK6 抗体(1∶1 000),室温1 h,TBST洗膜15 min×3,加入 HRP标记山羊抗小鼠IgG(1∶5 000)室温1 h,TBST洗膜15 min×3,ECL显色。
1.4 PAK6蛋白在真核细胞中的亚细胞定位
HEK293细胞转染后(同上述免疫印迹实验)于4%多聚甲醛中固定,加入羊血清封闭1 h。用含有0.1%Triton-X100的PBS洗细胞15 min×3,加入Anti-His/Anti-PAK6抗体(1∶100)室温孵育1 h,PBS洗细胞15 min×3。Alex Flour 488孵育1 h,PBS洗细胞15 min×3。Olympus显微镜观察实验结果。
2 结 果
2.1 PAK6真核表达载体的构建
以胎脑文库cDNA为模板,PCR扩增PAK6基因,得到约2 000 bp的特异性条带(图1),与预期结果相符。
将构建成功的pcDNA3.1HisC-PAK6质粒经EcoRⅠ/XhoⅠ酶切后得到5.0 kb和2.0 kb左右大小的两条特异性片段,与预期大小相符,证明质粒构建成功(图2)。
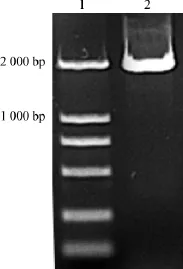
图1 PCR扩增PAK6基因片段Fig 1 PCR fragment of PAK6 gene
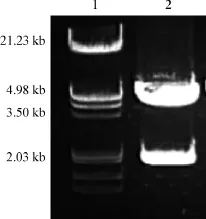
图2 pcDNA3.1HisC-PAK6质粒酶切图Fig 2 The enzyme digestion of pcDNA3.1HisC-PAK6
2.2 pcDNA3.1HisC-PAK6质粒在真核细胞中的表达
将纯化抽提的真核表达质粒pcDNA3.1HisC空载体和pcDNA3.1HisC-PAK6质粒转染HEK293细胞。提取的总蛋白在10%SDS-PAGE分离转膜后,我们用抗PAK6单克隆抗体进行Western blotting鉴定。结果(图3)显示,在第2泳道有一特异性结合抗体的条带(箭头所示),与蛋白分子量标准比对后,大小正确,说明pcDNA3.1HisC-PAK6质粒在HEK293细胞中表达PAK6蛋白。
2.3 PAK6蛋白在真核细胞的亚细胞定位
将纯化抽提的真核表达质粒pcDNA3.1HisC空载体和pcDNA3.1HisC-PAK6质粒转染HEK293细胞。空载体用Anti-His抗体孵育,pcDNA3.1HisC-PAK6用Anti-PAK6抗体孵育。染色结束后利用荧光显微镜观察,结果(图4)显示,pcDNA3.1HisC空载体的绿色荧光遍布整个细胞,而pcDNA3.1HisC-PAK6质粒表达在细胞浆中,说明PAK6蛋白表达于细胞浆中。

图3 pcDNA3.1HisC-PAK6质粒在HEK293细胞中表达PAK6蛋白Fig 3 The expression of pcDNA3.1HisC-PAK6 in HEK293 cells

图4 PAK6蛋白在HEK293细胞中的定位Fig 4 The subcellular localization of PAK6 in HEK293 cells
3 讨 论
PAK6是PAK家族中最晚发现的一个成员,其生物学功能并未像家族其他成员一样研究得比较详尽。目前,PAK6的主要功能是与雄激素受体相互作用并通过磷酸化调节AR的转录活性[6]。PAK6蛋白表达与前列腺癌的恶性进程密切相关,尤其是在难以治疗的复发性前列腺癌中[8]。复发性前列腺癌通常都是在采取去除雄激素以治疗原发性前列腺癌的患者中发病,这类患者通常都会伴有肿瘤的转移,例如骨转移,因此难以治愈[11]。
本研究构建了pcDNA3.1HisC-PAK6真核表达质粒,经测序及酶切鉴定证实PAK6被成功导入pcDNA3.1HisC载体中。此质粒能够表达PAK6蛋白并指示PAK6蛋白表达于细胞浆中。在图4中,空载体所示绿色荧光遍布于整个细胞,无特异性的亚细胞定位。另外,由于pcDNA3.1HisC空载体的表达对细胞影响较小,其表达也比右侧pcDNA3.1HisC-PAK6质粒表达较强。pcDNA3.1HisC-PAK6质粒与空载体相比明显表达于细胞浆中。有文献报道,绿色荧光蛋白标签的PAK6质粒也表达于细胞浆中[10],但绿色荧光蛋白标签分子量较大,为34 kDa。在研究PAK6的生物学功能时容易发生阻滞PAK6核转位以及引起非特异性反应等弊端。本研究中构建的pcDNA3.1HisC-PAK6真核表达质粒所带有的6×His标签蛋白仅为6个氨基酸大小,不容易引起非特异性的反应,更利于研究PAK6的生物学功能。本研究构建的PAK6真核表达载体并且确定其在细胞中的亚细胞定位对于阐述PAK6的生物学功能具有重要的作用。
[1]WELLS C M,JONES G E.The emerging importantce of group II PAKs[J].Biochem J,2010,425(3):465-473.
[2]POONAM R M,LI D Q,MURRAY B,et al.PAK signaling in oncogenesis[J].Oncogene,2009,28(28):2545-2555.
[3]DUMMLER B,OHSHIRO K,KUMAR R,et al.Pak protein kinases and their role in cancer[J].Cancer Metastasis Review,2009,28(1-2):51-63.
[4]BOKOCH G M.Biology of p21-activated kinases[J].Annu Rev Biochem,2003,72:743-781.
[5] JAFFER Z M,CHERNOFF J.p21-activated kinases:three more join the Pak[J].Int J Biochem,2002,34(7):713-717.
[6]YANG F,LI X,SHARMA M,et al.Androgen receptor specifically interacts with a novel p21-activated kinase 6[J].J Biol Chem,2001,276(18):15345-15353.
[7]JAUSORO I,MESTRES I,REMEDI M,et al.IQGAP1:a microtubule-microfilament scaffolding protein with multiple roles in nerve cell development and synaptic plasticity[J].Histol Histopathol,2012,27(11):1385-1394.
[8]KAUR R,YUAN X,LU M L,et al.Increased expression of PAK6 in prostate cancer and identification of PAK6 associated proteins[J].Prostate,2008,68(14):1510-1516.
[9]LEE S R,ROMAS S M,KO A,et al.AR and ER interaction with p21-activated kinase 6(PAK6)[J].Mol Endorcrinol,2002,16(1):85-99.
[10]SCHRANTZ N,da SILVA-CORREIA J,FOWLER B,et al.Mechanism of p21-activated kinase 6-mediated inhibition of androgen receptor signaling[J].J Biol Chem,2004,279(3):1922-1931.
[11]HIGANO C S,CRAWFORD E D.New and emerging agents for the treatment of castration-resistant prostate cancer[J].Urol Oncol,2011,29:S1-8.

