ATR激酶在紫外线损伤应答中的作用
戴仕奎,洪泽辉
(1.东南大学生命科学研究院,江苏南京 210009;2.东南大学医学院遗传与发育生物学系,江苏南京 210009)
DNA作为细胞生命活动最重要的遗传物质,保持其分子结构的完整性和稳定性对于细胞的存活和正常生理功能的发挥具有重要意义。环境因素以及细胞内源性的一些因子都会对细胞内DNA造成损伤。如果DNA损伤不及时修复,就会造成DNA突变、基因表达异常、细胞周期受阻等,从而引起细胞凋亡或癌变[1-2]。共济失调毛细血管扩张突变基因蛋白(ataxia telangiectasia mutated,ATM)、共济失调毛细血管扩张突变基因Rad3相关蛋白(ataxia telangiectasia mutated and Rad3 related protein,ATR)和DNA依赖蛋白激酶催化亚基(DNA dependent protein kinase catalytic subunit,DNA-PKcs)都是DNA损伤后激活细胞应答的重要激酶。这3种激酶参与不同类型的DNA损伤修复,DNA-PKcs主要参与DSBs修复;而ATM和ATR参与多种DNA损伤应答,在功能上存在一定程度的互补,对复制期DNA的稳定起着关键性作用。
由紫外线辐射造成的DNA损伤是最常见的一种损伤形式。在紫外线照射下,嘧啶脱氧核苷酸会产生畸变,主要形成嘧啶二聚体(cyclobutyl pyrimidine dimmers,CPDs)和 6-4 光产物((6-4)photoproduct,6-4PP)。紫外线损伤应答(UV damage response)是紫外线照射引起DNA损伤后细胞激活一系列反应修复DNA损伤或激活凋亡的过程,包括核苷酸切除修复(nucleotide excision repair,NER)、细胞凋亡(apoptosis)、细胞周期检测点(cell cycle checkpoint)激活等。ATR是紫外线损伤应答中最重要的激酶[3-4]。
1 ATR结构与功能
ATR是300 kDa大小的蛋白,根据其功能分为ATRIP结合结构域(ATRIP-interacting domain)、激酶结构域(kinase domain)等结构域[5-6](图1)。N 端的ATRIP结合结构域是ATR激活的重要结构域,C端的激酶结构域是ATR磷酸化下游蛋白重要结构域。ATR是磷酸肌醇-3激酶相关激酶(phosphatidylinositol 3-kinase related kinase,PIKK)蛋白家族成员,具有将靶蛋白的丝氨酸或苏氨酸磷酸化功能。在细胞生长代谢、DNA损伤修复等过程有重要的作用,其激酶区序列与磷酸肌醇-3激酶(phosphatidylinositol 3-kinase,PI-3K)家族蛋白有很高的相似性。ATR参与DNA损伤修复类型比ATM更加广泛,对复制期DNA的稳定起着关键性作用。ATR可以感知紫外线引起的损伤,磷酸化下游的蛋白,如p53、Chk1、claspin等,从而调控核苷酸切除修复、细胞周期以及细胞的凋亡。

图1 ATR结构域示意图(来自文献[5])Fig 1 A sketch map of ATR domain
2 ATR参与紫外线损伤应答的基本机制
2.1 ATR 的激活
紫外线照射引起DNA损伤,参与核苷酸切除修复的蛋白会一步一步聚集到损伤位点(见下述NER过程),RPA蛋白复合体结合到损伤位点以保护完整的那条DNA单链时,RPA会与ATRIP和RAD17复合体结合,ATR通过N端的ATRIP结合结构域与ATRIP相互结合,所以ATR会随着ATRIP结合到损伤位点。紧接着RFC复合体(RFC1-5)聚集到该位点上,Rad17会置换RFC1蛋白[7],Rad17-RFC2-5复合体招募9-1-1复合体(RAD9-HUS1-RAD1),之后,RAD9会被磷酸化,使得整个复合体结构变化产生一个TopBP1结合位点,则TopBP1结合到该复合体上,TopBP1作为ATR辅助激活因子将 ATR 激活[5,8-9]。Overmeer 等[10]认为,ATR的激活需要XPF将嘧啶二聚体5'端的DNA切开;但Ward等[11]研究认为,紫外线诱导产生的损伤修复产生的ssDNA不足以激活ATR。在紫外线照射后,只有处在复制期的细胞才发现ATR聚集在染色质上,ATR会聚集在停滞复制叉的ssDNA处,从而激活ATR,紧接着将H2AX和Chk1磷酸化,激活下游蛋白,磷酸化的H2AX促进ATR保持激活状态,使ATR稳定结合在ssDNA处。
2.2 ATR参与紫外线损伤应答的基本机制(图2)
ATR参与紫外线损伤应答主要是调控核苷酸切除修复、细胞检测点的激活以及细胞凋亡信号通路。
2.2.1 ATR调控核苷酸切除修复
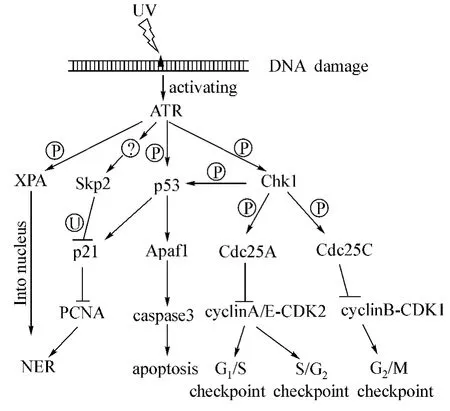
图2 ATR在紫外线损伤应答中的作用Fig 2 A sketch map of ATR kinas function in repair of UV-induced DNA damage
核苷酸切除修复是修复紫外线引起的DNA畸变的主要方式。核苷酸切除修复主要分为全基因组核苷酸切除修复(global genome nucleotide excision repair,GG-NER)和转录偶联核苷酸切除修复(transcriptioncoupled nucleotide excision repair,TC-NER)[12]。GGNER主要是执行全基因组的修复,而TC-NER主要是发生在基因转录过程中的一种快速修复方式。GGNER的过程主要有四步:(1)XPC-hHR23B蛋白复合物识别嘧啶二聚体。(2)TFIIH复合物解旋嘧啶二聚体处的DNA双链。(3)ERCCl-XPF复合物和XPG分别切除嘧啶二聚体5'端和3'端的3'-5'磷酸二酯键,造成24-32个核苷酸缺口。(4)DNA聚合酶ε和δ在PCNA协助下合成新的DNA片段,最后LIG1连接酶连接,完成整个修复过程。TC-NER与GG-NER的区别在于起始的识别机制不同,识别过程是依赖于RNA聚合酶的作用[12]。已有研究表明,ATR可以通过调控着色性干皮病蛋白A(xeroderma pigmentosum group A,XPA)的核质分布和p21的泛素化参与核苷酸切除修复。
2.2.1.1 ATR调控XPA核质分布 XPA是核苷酸切除修复中的一个重要的参与蛋白,人体细胞中缺失XPA会造成着色性干皮病(xeroderma pigmentosum)[13-14],XPA是一个32 kDa含锌的金属蛋白。核苷酸切除修复中,hR23B、DDB2、XPC这些蛋白识别损伤位点后,XPA同RPA、TFⅡH一起结合到损伤位点,XPA能够招募下游参与核苷酸切除修复的蛋白结合到损伤位点,从而促进修复的进行。
Auclair等[15]研究发现,ATR沉默或缺陷会影响S期细胞的核苷酸切除修复。正常的细胞中,XPA在细胞质和细胞核中都存在,但核质中的含量随着细胞周期的变化而变化,在G1、S期细胞质中较多,而G2期细胞核中较多[16]。在 S期,紫外线照射引起的 DNA损伤使 ATR激活,激活的 ATR与 XPA结合[17],将XPA磷酸化,促进XPA进入细胞核,参与核苷酸切除修复[18]。Chk1和p53是ATR下游重要的调控蛋白,XPA进入细胞核,也依赖p53 S15位的磷酸化[16]。
2.2.1.2 ATR调控p21泛素化修饰 p21是一个分子量为21 kDa的蛋白质,是细胞周期蛋白依靠性激酶抑制剂家族中的重要成员,是协调细胞周期、DNA复制、修复的重要蛋白。
p21同PCNA相互结合,抑制PCNA结合到DNA上,从而影响核苷酸切除修复。低剂量的紫外线照射(<40 J·m-2)时,激活的ATR会调控Skp2这个E3泛素连接酶的作用(但也有研究认为p21的降解依赖CRL4cdt2),将p21泛素化,使p21被蛋白酶体降解,促使PCNA解离出来,结合到损伤的DNA上,参与核苷酸切除修复[高剂量紫外线照射(>40 J·m-2)造成细胞DNA损伤过多,细胞会直接启动凋亡,此时p21不会被泛素化降解]。但ATR调控p21泛素化修饰的具体途径目前还了解的不是很清楚,有可能还有其他蛋白参与这一过程,有待深入研究[19-21]。
2.2.2 ATR调控细胞周期
增殖状态的真核细胞周期分为 G1、S、G2、M 4个时期,由细胞周期蛋白(cyclinA、B、C、D等)和细胞周期依赖激酶(cyclin dependent kinases,CDKs)这两类蛋白家族来调控细胞周期的进程[22-23],当处在应激状态或者其他一些不利于细胞周期进行的情况时,这两类蛋白家族蛋白根据所处的细胞周期启动G1/S、S、G2/M、有丝分裂中期相应的检测点。
紫外线辐射引起DNA损伤后,激活的ATR将Chk1、p53磷酸化,随后 Chk1将 Cdc25A磷酸化,Cdc25A抑制cyclinA的表达,抑制其与CDK2相互结合,激活了G1/S和S/G2期细胞周期检测点,抑制细胞周期的进行。Chk1还可以将Cdc25C在S216位置磷酸化,使其结构发生变化,14-3-3蛋白复合体结合到磷酸化的Cdc25C上,随后Cdc25C/14-3-3复合体进入细胞质,抑制Cdc2的磷酸化,从而激活G2/M细胞周期检测点[24]。
2.2.3 ATR调控紫外线诱导的细胞凋亡
细胞凋亡(apoptosis)是维持生物体微环境的重要调控方式,细胞在受到损伤无法修复的情况下启动凋亡程序,将受损细胞凋亡,以保护个体。紫外线诱导的凋亡的途径可以分为p53非依赖性凋亡与p53依赖性凋亡。p53非依赖性凋亡有3种途径:紫外线照射诱导细胞膜上的死亡配体(death ligand)释放或者表达增加,同死亡受体(death receptor)结合增加,激活凋亡;紫外线照射直接使细胞膜上的死亡受体聚集,不需要死亡配体存在的情况时,激活凋亡;紫外线照射引起线粒体内细胞色素C的释放,激活凋亡途径[25]。
紫外线诱导的细胞凋亡主要通过p53依赖性途径,受ATR调控:紫外线损伤后,ATR被激活,将p53磷酸化,使得p53与MDM2解离开,抑制p53被泛素化降解。当DNA损伤无法修复时,磷酸化的p53可以将Apaf1激活,Apaf1将caspase9剪切激活,紧接着caspase9将caspase3剪切激活,caspase3作为凋亡的效应蛋白使得细胞凋亡,同时p53也可以抑制线粒体细胞色素C激活的凋亡途径[26]。但 Heffernan 等[27]却在人角质形成细胞(human keratinocyte)中发现,ATR通过磷酸化Chk1,从而调控由紫外线引起的细胞凋亡,p53并没有参与。说明ATR可能磷酸化Chk1或p53来调控细胞的凋亡,但ATR通过Chk1调控细胞凋亡的具体过程尚未阐明,有待进一步深入研究。
3 结 语
过去的十几年间,ATR在维持基因组稳定性的研究上取得了巨大的进展。ATR参与紫外线损伤应答也有了很多新的发现:ATR能够调控细胞周期监测点的激活,同时也能够激活细胞的凋亡。但ATR怎样协调和选择这两个途径的激活、进行,同时会不会调控其他蛋白参与紫外线损伤应答,都不是很清楚,有待深入研究。
非黑色素瘤皮肤癌是指基层细胞瘤以及鳞片细胞瘤,是白种人最常见的恶性肿瘤,全球该肿瘤发病率在不断上升中,这与人口老龄化以及阳光辐射增加有直接的关系。我国香港地区的调查也发现非黑色素瘤皮肤癌发病率在不断的上升[28]。有多项研究表明经常饮用茶或者咖啡会降低非黑色素瘤皮肤癌发生的概率,这是由于咖啡和茶中含有咖啡因,能够抑制ATR的功能,促进紫外线照射引起损伤的细胞凋亡,从而降低了该皮肤癌的发生概率[27]。目前,我国的皮肤癌发病率呈上升趋势[29],因此,对于ATR在紫外线损伤应答中的功能,以及ATR抑制剂的研究对皮肤癌的治疗有着重要的意义。
[1] HANAWALT P C.Subpathways of nucleotide excision repair and their regulation[J].Oncogene,2002,21(58):8949-8956.
[2]江洁,洪泽辉.SSRP1基因的克隆及其参与DNA损伤应答的初步研究[J].东南大学学报:医学版,2011,30(6):865-868.
[3]BOMGARDEN R D,LUPARDUS P J,SONI D V,et al.Opposing effects of the UV lesion repair protein XPA and UV by-pass polymerase eta on ATR checkpoint signaling[J].EMBO J,2006,25(11):2605-2614.
[4]ABRAHAM R T.Cell cycle checkpoint signaling through the ATM and ATR kinases[J].Genes Dev,2001,15(17):2177-2196.
[5]SHIOTANI B,ZOU L.ATR signaling at a glance[J].J Cell Sci,2009,122(3):301-304.
[6] LEMPIAINEN H,HALAZONETIS T D.Emerging common themes in regulation of PIKKs and PI3Ks[J].EMBO J,2009,28(20):3067-3073.
[7]CIMPRICH K A,CORTEZ D.ATR:an essential regulator of genome integrity[J].Nat Rev Mol Cell Biol,2008,9(8):616-627.
[8]ZOU L,ELLEDGE S J.Sensing DNA damage through ATRIP recognition of RPA-ssDNA complexes[J].Science,2003,300(5625):1542-1548.
[9]KUMAGAI A,LEE J,YOO H Y,et al.TopBP1 activates the ATR-ATRIP complex[J].Cell,2006,124(5):943-955.
[10]OVERMEER R M,MOSER J,VOLKER M,et al.Replication protein A safeguards genome integrity by controlling NER incision events[J].J Cell Biol,2011,192(3):401-415.
[11]WARD I M,MINN K,CHEN J.UV-induced ataxia-telangiectasia-mutated and Rad3-related(ATR)activation requires replication stress[J].J Biol Chem,2004,279(11):9677-9680.
[12]FOUSTERI M,MULLENDERS L H.Transcription-coupled nucleotide excision repair in mammalian cells:molecular mechanisms and biological effects[J].Cell Res,2008,18(1):73-84.
[13]PARK C J,CHOI B S.The protein shuffle.Sequential interactions among components of the human nucleotide excision repair pathway[J].FEBS J,2006,273(8):1600-1608.
[14]RIEDL T,HANAOKA F,EGLY J M.The comings and goings of nucleotide excision repair factors on damaged DNA[J].EMBO J,2003,22(19):5293-5303.
[15]AUCLAIR Y,ROUGET R,AFFAREL B,et al.ATR kinase is required for global genomic nucleotide excision repair exclusively during S phase in human cells[J].Proc Natl Acad Sci USA,2008,105(46):17896-17901.
[16]LI Z,MUSICH P R,SERRANO M A,et al.XPA-mediated regulation of global nucleotide excision repair by ATR is p53-dependent and occurs primarily in S-phase[J].PLoS ONE,2011,6(12):28326.
[17]SHELL S M,LI Z,SHKRIABAI N,et al.Checkpoint kinase ATR promotes nucleotide excision repair of UV-induced DNA damage via physical interaction with xeroderma pigmentosum group A[J].J Biol Chem,2009,284(36):24213-24222.
[18]WU X,SHELL S M,LIU Y,et al.ATR-dependent checkpoint modulates XPA nuclear import in response to UV irradiation[J].Oncogene,2007,26(5):757-764.
[19]AL-KHALAF H H,HENDRAYANI S F,ABOUSSEKHRA A.ATR controls the p21(WAF1/Cip1)protein up-regulation and apoptosis in response to low UV fluences[J].Mol Carcinog,2011,51(12):930-938.
[20]BENDJENNAT M,BOULAIRE J,JASCUR T,et al.UV irradiation triggers ubiquitin-dependent degradation of p21(WAF1)to promote DNA repair[J].Cell,2003,114(5):599-610.
[21]ABBAS T,SIVAPRASAD U,TERAI K,et al.PCNA-dependent regulation of p21 ubiquitylation and degradation via the CRL4Cdt2 ubiquitin ligase complex[J].Genes Dev,2008,22(18):2496-2506.
[22]NIGG E A.Cyclin-dependent protein kinases:key regulators of the eukaryotic cell cycle[J].Bioessays,1995,17(6):471-480.
[23]吴平平,苏昀,金治,等.Rho-A蛋白通路在DLC-1基因调控人结肠癌HT29细胞周期中的作用及其机制[J].东南大学学报:医学版,2009,28(4):247-251.
[24]PENG C Y,GRAVES P R,THOMA R S,et al.Mitotic and G2 checkpoint control:regulation of 14-3-3 protein binding by phosphorylation of Cdc25C on serine-216[J].Science,1997,277(5331):1501-1505.
[25]KULMS D,SCHWARZ T.Molecular mechanisms of UV-induced apoptosis[J].Photodermatol Photoimmunol Photomed,2000,16(5):195-201.
[26]BATISTA L F,KAINA B,MENEGHINI R,et al.How DNA lesions are turned into powerful killing structures:insights from UV-induced apoptosis[J].Mutat Res,2009,681(2-3):197-208.
[27]HEFFERNAN T P,KAWASUMI M,BLASIN A,et al.ATRChk1 pathway inhibition promotes apoptosis after UV treatment in primary human keratinocytes:potential basis for the UV protective effects of caffeine[J].J Invest Dermatol,2009,129(7):1805-1815.
[28]CHENG S Y,LUK N M,CHONG L Y.Special features of non-melanoma skin cancer in Hong Kong Chinese patients:10-year retrospective study[J].Hong Kong Med J,2001,7(1):22-28.
[29]曾红梅,张思维,郑荣寿,等.2003~2007年中国皮肤黑色素瘤发病与死亡分析[J].中国肿瘤,2012,21(3):183-189.

