东方田鼠非酒精性脂肪肝模型的建立
杨玉琴,冯洁,柏熊,沈志敏,刘雄伟,高捷,谢建云,胡建华,高诚
(1.上海市公共卫生临床中心,上海 201508;2.上海市实验动物质量监督检验站,上海实验动物研究中心,上海 201203;3.上海西普尔-必凯实验动物有限公司,上海实验动物研究中心,上海 201203)
近年来,由于饮食结构的变化,非酒精性脂肪肝(non-alcoholic fatty liver,NAFL)的发病率呈逐年上升趋势,统计结果显示脂肪肝病人已占到平均人口的10% ~24%,在发达国家已成为第一位常见肝病,且有进展至肝硬化、肝癌、肝衰竭的危险,已成为全球普遍关注的医学问题和社会问题[1-4]。
目前基本采用大鼠、小鼠、兔等动物来建立NAFLD动物模型,并在此基础上对于这一疾病的发病机制、治疗手段等方面进行研究。高脂饮食能诱导出小鼠非酒精性脂肪肝模型,但小鼠不太适合长时间给药观察研究[5];兔虽也能建立模型但其抵抗力差,容易继发感染而死亡[6];目前比较常用的是大鼠和ob/ob小鼠,但这些动物模型的病变特点是病变进展很快,各期病变交叉出现,不能很好的体现病变的进展过程,不利于疾病发病机制的研究和治疗药物的筛选[7-8]。因此迫切需要发掘新的动物来建立非酒精性脂肪肝模型。
东方田鼠(Microtus fortis)隶属于啮齿目(Rodent)、仓鼠科(Cricetidae)、田鼠亚科(Microtinae)、田鼠属(Microtus),是我国常见的啮齿类动物,其具有天然的对日本吸血虫不感染的特性[9]。近些年来我们在对东方田鼠进行实验室繁育过程中发现东方田鼠在实验室条件饲养下易发生脂肪肝病变[10]。本文旨在用东方田鼠建立一种新的非酒精性脂肪肝动物模型。
1 材料和方法
1.1 实验动物
6周龄湖南洞庭湖种群东方田鼠70只,雄性,体重40 g左右,普通级,由上海西普尔-必凯实验动物有限公司【SCXK(沪)2008-0016】提供。实验在上海实验动物研究中心进行【SYXK(沪)2008-0058】。
1.2 主要试剂和材料
ALT、AST、ALP、r-GT、CHE、TG、TC、FFA、GLU、HDL和LDL检测试剂购自上海日和贸易有限公司(日本世诺临床诊断制品株式会社);苏木精(苏木素hematoxylin,分子量320.29)购自上海试剂三厂。
高脂肪料为在大小鼠的基础料上添加5%猪油、0.5%胆固醇、0.1%胆盐;高纤维料为在大小鼠的基础料上添加粗纤维,使粗纤维的含量为10%、粗脂肪含量为3%,以上饲料均由上海市斯莱克斯实验动物有限公司合成。
1.3 主要仪器
HBO100 ZEISS光学显微镜、KXL型自动生化分析仪、RM2245切片机、EG1150H包埋机、TP1020脱水机、BSIOOS电子天平。
1.4 模型建立
湖南洞庭湖种群东方田鼠70只饲养于(20±2)℃、相对湿度60% ~70%、明暗各12 h的动物饲养室内,经适应性喂养一周后,随机分为2组,每组35只,模型组饲喂高脂肪料,对照组饲喂高纤维料,动物饮水均为高压灭菌水,自由饮水取食。各组分别于造模开始后第 2、4、6、8、12周后处死实验鼠采样。
1.5 动物处理
动物处死前先禁食8 h,称重后乙醚麻醉,内眦静脉采血,处死,打开腹腔,肉眼观察肝脏情况,并迅速取出肝脏称肝重。取肝左叶同一部位1 cm×1 cm×1 cm组织置于4%甲醛溶液固定,用于制做病理切片。全血在室温下静置2 h后,4℃ 3500 r/min离心15 min分离血清,-20℃冷冻以备生化检测。
1.6 指标观察和测定方法
1.6.1 东方田鼠一般情况
实验期间观察食欲、行为、毛发、体重变化等,作详细记录,并计算肝指数(肝指数 =肝重/体重 ×100%)。
1.6.2 测定方法
血清 ALT、AST、ALP、r-GT、CHE、TG、TC、FFA、GLU、HDL和LDL按试剂盒说明操作进行检测。病理组织学检查:肉眼观察东方田鼠肝脏大体变化,对切片并作HE染色,光镜下观察东方田鼠肝脏脂肪变性情况,尤其注意肝脏的脂肪变性、炎性细胞、纤维化和坏死等病变。
1.7 统计学方法
实验数据采用SPSS 11.5软件进行统计学分析,结果以()表示,各组间实验数据的比较采用两样本均数的 t检验,P<0.05表示差异具有显著性意义。
2 结果
2.1 东方田鼠一般情况
整个造模过程中,对照组东方田鼠生长及生活状况正常;模型组东方田鼠被毛普遍较稀疏,色泽不鲜,反应较迟缓,食欲下降,随着时间的推移,其被毛稀疏加重,有脱毛现象,色泽蜡黄。
2.2 肝脏指标变化结果
2.2.1 一般指标结果
从表1可见两组田鼠随着饲养时间的延长体重、肝重和肝指数均不断增加,前4周,模型组田鼠体重比对照组有明显增加(P<0.05),从第6周开始,两组体重无明显差异;然而从第6周开始模型组田鼠肝重和肝指数显著增高(P<0.05),从第6周开始模型组田鼠肝指数大于5%。
表1 两组东方田鼠体重、肝重和肝指数比较()Tab.1 Comparison of the body weight,liver weight and liver index between the two groups of Microtus fortis
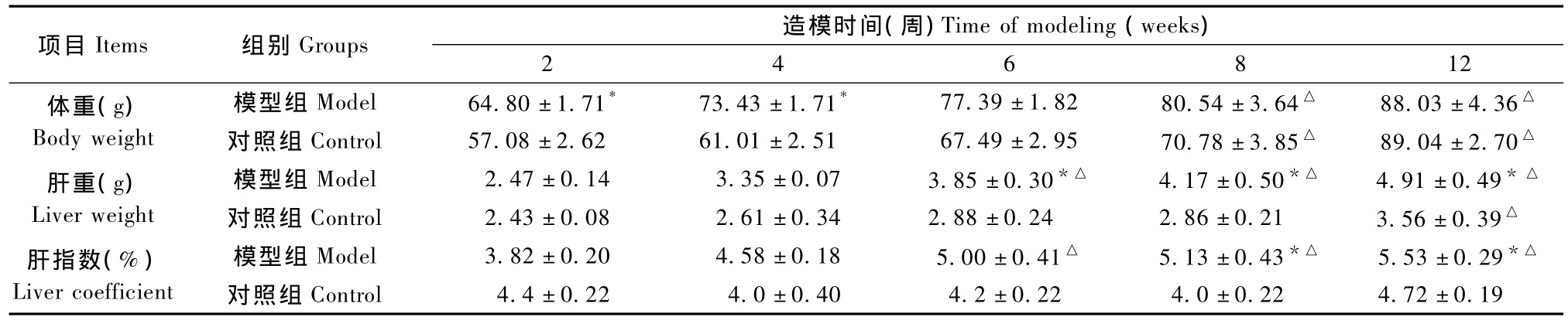
表1 两组东方田鼠体重、肝重和肝指数比较()Tab.1 Comparison of the body weight,liver weight and liver index between the two groups of Microtus fortis
注:*P<0.05与对照组相比较;△P<0.05与同组相比较Note:*P<0.05 vs.control group;△P<0.05 vs.the same group
?
2.2.2 血清学结果
随着造模时间的推移,模型组动物血清 ALT、AST、CHE、r-GGT、GLU、TC、LDL 和 FFA 均有显著升高,血清TG和HDL则逐渐降低,至第6周开始有显著降低(P<0.05)。与对照组相比,模型组田鼠的TC、LDL、FFA水平在造模开始2周起就显著升高(P<0.05),ALT、GLU、CHE 水平在 4周后显著升高(P <0.05),AST、r-GGT 水平在 12 周后也显著升高(P<0.05);随着模型组田鼠TG和 HDL水平逐渐降低,至造模后期,较对照组显著降低(P<0.05)。详见表2。
表2 两组东方田鼠血清学指标变化比较()Tab.2 Comparison of the serum biochemical indexes between the two groups of Microtus fortis
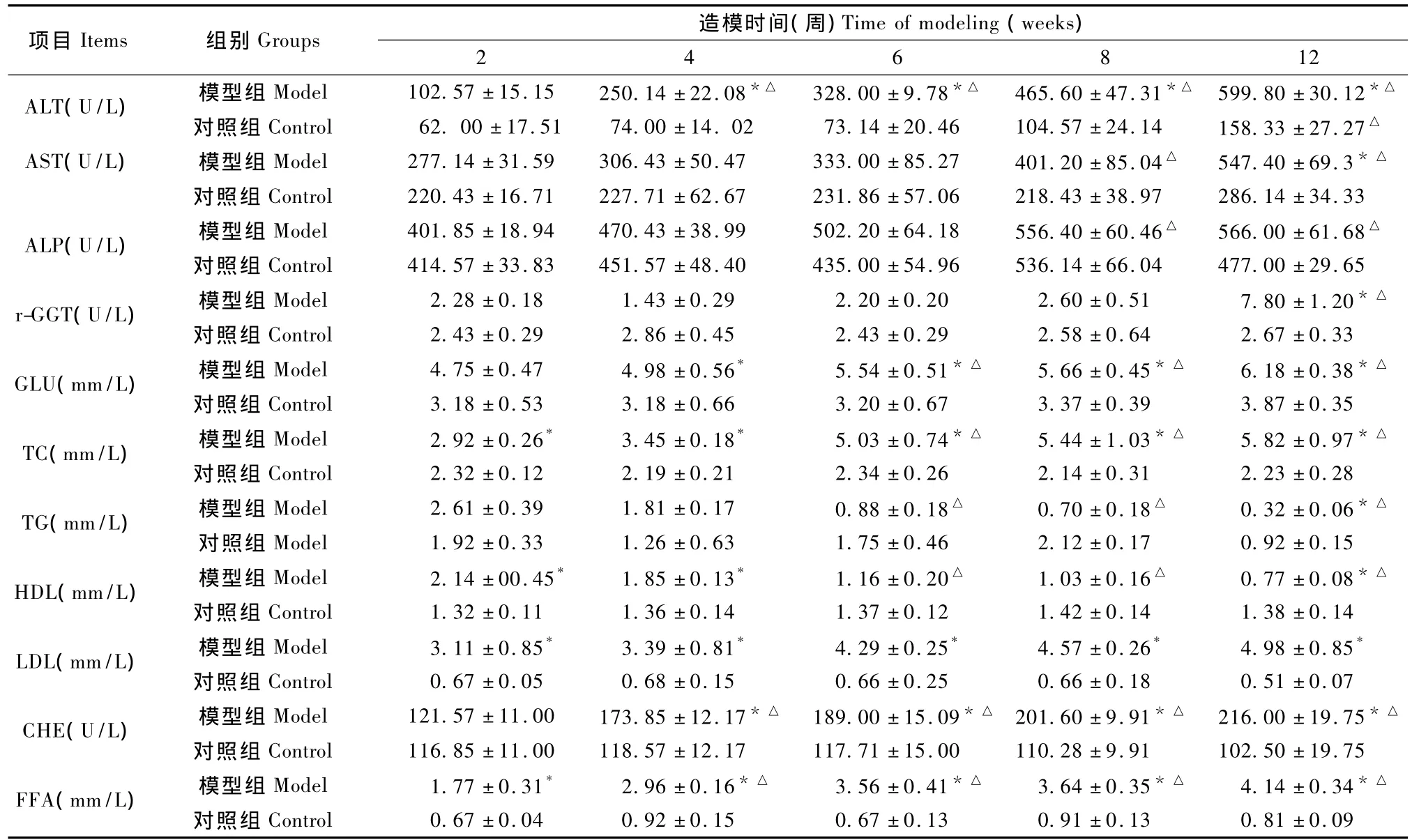
表2 两组东方田鼠血清学指标变化比较()Tab.2 Comparison of the serum biochemical indexes between the two groups of Microtus fortis
注:*P<0.05与对照组相比较;△P<0.05与同组相比较Note:*P<0.05 vs.control group;△P<0.05 vs.the same group.
?
2.3 组织病理学结果
肝脏形态学观察:对照组东方田鼠肝脏表面相对较光滑,红润,无结节,质软。模型组田鼠不仅出现了肝体积增大,包膜紧张,而且肝脏呈现土黄色,切面油腻,并且随着造模时间延长,程度更加明显。
HE染色后光镜下观察,对照组东方田鼠肝脏在12周时部分肝细胞出现了轻度的脂肪变性,其余各组均无病变,肝细胞排列正常,细胞中央有大而圆的核,肝小叶规则,基本未见炎症细胞。模型组在2周时几张切片偶然出现小脂滴,但不明显;4周时部分切片的肝细胞出现了小的脂肪滴;6周时所有切片的肝细胞均表现为脂肪变性,且为弥漫性脂肪变性,并出现了几个较大的脂肪滴,肝细胞核相对大小不均;8周时脂肪滴进一步融合,大脂肪滴在整个肝内弥漫出现;12周时均出现重度的脂肪变性和炎性细胞浸润,炎性细胞浸润以小叶内为主。以上提示,6周时,模型组已经成功发生非酒精性脂肪肝,并且随着造模时间延长,病变程度加重。详见图1(封二)。
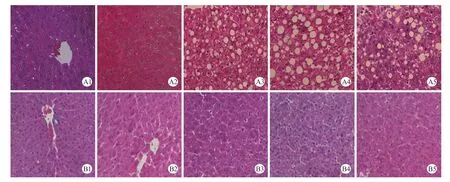
注:A1-A5分别为模型组2、4、6、8和12周肝脏;B1-B5分别为对照组2、4、6、8和12周肝脏。图1 肝脏的组织病理学变化(HE,×20)Note: A1-A5: Livers of the model group in 2, 4, 6, 8 and 12 weeks. B1-B5: Livers of the control group in 2, 4, 6, 8 and 12 weeks.Fig.1 Pathological changes of the livers (HE, ×20)
3 讨论
目前高脂饮食诱导是建立非酒精性脂肪肝动物模型的常见方法。高脂饮食诱发性脂肪肝形成的影响因素较多,其中最主要的是血脂代谢异常,其表现有下两种情况:一是由于血浆游离脂肪酸升高,被肝摄取并合成甘油三酯增多,血浆脂蛋白的形成跟不上游离脂肪酸进入肝脏的速度,使甘油三酯在肝脏内积聚而形成脂肪肝;二是由于血浆脂蛋白代谢障碍。极低密度脂蛋白的主要作用是将肝内合成的甘油三酯通过血液循环转运至全身组织,极低密度脂蛋白形成减少,可导致肝细胞内合成的脂肪不易排出,从而诱发脂肪肝[11-13]。
本实验采用在大小鼠的基础料上添加5%猪油、0.5%胆固醇、0.1%胆盐的饲料对东方田鼠进行饲养来建立东方田鼠非酒精性脂肪肝模型。模型组田鼠的体重、肝重、肝指数较对照组都有显著性差异;血清中与脂肪代谢相关的指标 ALT、AST、CHE、r-GGT、GLU、TC、LDL 和 FFA 均有显著升高,HDL 在造模的前4周升高,从第6周开始降低,然后迅速下降;并且肝脏病理切片显示模型鼠在实验6周开始出现肝细胞脂肪变性,其肝指数也大于5%。表明已成功建立了东方田鼠NAFLD模型。
但本模型也有一些指标与人类NAFLD及其他模型动物存在差异。首先在人和其他动物NAFLD中,一个显著的表现为 TG 升高[14-15],但在本模型中,TG在造模的第2周比对照组升高,但随后逐渐降低,直至第6周比对照组低,随着造模时间的延长,其数值不断下降,表现出与人和其他动物NAFLD显著的不同,可能的原因是高脂饲料喂养的东方田鼠引起肝脏摄取脂肪酸增多,在造模的早期,肝脏合成的TG与载脂蛋白结合,运至血液,而在造模后期,可能载脂蛋白形成障碍,从而造成脂肪酸积聚在肝脏无法以TG的形式转运至血液,导致东方田鼠模型组在造模的后期血清中TG的浓度不升反降。
其次,模型组动物血清中ALP与对照组相比无差异。ALP是肝脏病变的一个重要指标[16],在中重度脂肪肝时肝细胞过度制造ALP,经淋巴道和肝窦进入血液引起血清碱性磷酸酶明显升高[15],结合本实验的病理结果,模型田鼠肝内出现了大量的脂肪变性,只有在造模12周时才见到较多的炎细胞,并未见到显著地纤维化病变,还未引起肝细胞的严重病变,说明建立的模型可能病变进展较为缓慢,有一定的疾病演变过程,这样的模型可以更好的用于发病机制和临床药物的研究。
大鼠非酒精性脂肪肝模型是近些年来建立的较成熟的模型,而大鼠建模饲料需要在一般普通基础饲料基础上再加上2%胆固醇、5% ~10%猪油[17-18]。而本次东方田鼠的建模饲料是在普通大小鼠料的基础上只添加5%猪油、0.5%胆固醇、0.1%胆盐,用脂肪含量较低的饲料在短期内就建立了东方田鼠非酒精性脂肪肝模型,并且其模型成功模拟了人类非酒精性脂肪肝病变的演变过程。
本次用东方田鼠建立的非酒精性脂肪肝模型,与其他动物建立的模型相比有以下特点:⑴模型较容易建立,在6周就出现了明显的脂肪肝病变;⑵其血清甘油三酯在造模前期增高,而随后却明显降低;⑶本研究中病理结果显示我们的模型组并未出现明显的纤维化,血清指标中ALP也无显著差异,说明肝脏无明显的纤维化病变。
以上研究结果显示我们建立的东方田鼠非酒精性脂肪肝模型具有模型易构建和病变有一定进展过程等优点,可以用于发病机制和早期临床药物干预等方面的研究。本文只是对东方田鼠非酒精性脂肪肝模型进行初步研究,若想确切了解本模型的发病机制及这一模型与其他模型的区别仍需进一步深入研究。
[1]Mehta K,Van Thiel DH,Shah N,et al.Nonalcoholic fatty liver disease pathogenesis and the role of antioxidants[J].Nutr Rev,2002,60:289-293.
[2]翁小刚,朱晓新,杨庆,等.非酒精性脂肪肝的实验研究进展[J].中国实验方剂学杂志,2009,15(11):104-109.
[3]谢雯,脂肪性肝病的研究进展[J].中国临床医生,2006,8(34):2-24.
[4]刘树军,黄静娟,车念聪,非乙醇性脂肪肝发病机制研究进展[J].首都医科大学学报,2007,2(28):216-219.
[5]徐磊,徐承富,石巧娟,等.小鼠非酒精性脂肪性肝病模型的建立与评价[J].中华肝脏病杂志,2007,15(9):693-694.
[6]南月敏,王蕾,李良霄,等.非酒精性脂肪肝动物模型研究进展[J].河北医科大学学报,2007,28(1):67-71.
[7]Kucera O,Garnol T,Lotková H,et al.The effect of rat strain,diet composition and feeding period on the development of a nutritional model of non-alcoholic fatty liver disease in rats [J].Physiol Res.2011,60(2):317 -328.
[8]Lin HZ,Yang SQ,Chuckaree C,et al.Metformin reverses fatty 1iver disease in obese leptin-deficient mice [J].Nature Med,2000,6(8):998-1003.
[9]黎申恺,朱祖林,金壁如,等.东方田鼠对日本血吸虫的不感染性[J].寄生虫学报,1965,2(1):103-105.
[10]周光兴,谢建云,柏熊,等.不同年龄东方田鼠组织器官的形态学观察[J].华东地区十届实验动物科学学术交流会论文集,2008:395.
[11]倪鸿昌,李俊,金涌,等.大鼠实验性高脂血症和高脂血症性脂肪肝模型究[J].中国药理学通报,2004,6,20(6):703-706.
[12]钟岚,范建高,王国良,等.肥胖高脂血症性脂肪性肝炎模型的建立[J].实验动物科学与管理,2000,17(2):16-20.
[13]Perez-Aguilar F.Etiopathogenesis of non-alcoholic steatohepatitis[J].Gastroenterol Hepatol,2005,28(7):396 - 406.
[14]楼琦,石巧娟,郭红刚,等.非酒精性脂肪肝大鼠脂质代谢及病理变化的动态观察[J].中国比较医学杂志,2012,22(3):5-11.
[15]钟岚,范建高,王国良,等.非酒精性脂肪性肝炎动物模型的建立[J].中华实用医学,2000,2(1):3-6.
[16]Anstee QM,Goldin RD.Mouse models in non-alcoholic fatty liver disease and steatohepatitis research [J].Int J Exp Path,2006,87:1-16.
[17]胡克章,杨坤,黄正明.高糖高脂肪饲料诱导的大鼠非酒精性脂肪肝模型的动态研究[J].中国药理学通报,2009,25(suppl):185-189.
[18]张玉峰,陈文慧.非酒精性脂肪肝动物模型造模方法的研究[J].中西医结合肝病杂志,2002,13(2):123-125.

