下调HOXB7基因对卵巢癌SKOV3细胞增殖的影响及机制探讨
赵宇清黄妍高蜀君丰有吉
1.复旦大学附属妇产科医院妇科,上海 200011;
2.复旦大学附属肿瘤医院妇瘤科,复旦大学上海医学院肿瘤学系,上海 200032;
3.上海市第一人民医院妇产科,上海 200080
下调HOXB7基因对卵巢癌SKOV3细胞增殖的影响及机制探讨
赵宇清1黄妍2高蜀君1丰有吉3
1.复旦大学附属妇产科医院妇科,上海 200011;
2.复旦大学附属肿瘤医院妇瘤科,复旦大学上海医学院肿瘤学系,上海 200032;
3.上海市第一人民医院妇产科,上海 200080
背景与目的:HOXB7基因在卵巢癌中过表达,可能与细胞恶性转化相关。本研究采用RNA干扰技术下调HOXB7基因表达,并探讨其对卵巢浆液性囊腺癌SKOV3细胞增殖的影响及可能的机制。方法:将SKOV3细胞分为3组:空白组(未作转染处理)、阴性对照组(转染阴性质粒pRNAT-neg)和HOXB7siRNA干扰组(转染干扰质粒pRNAT-hoxb7)。荧光显微镜观察转染效率,RT-PCR、蛋白质印迹法(Western blot)检测干扰效应。BrdU实验检测细胞增殖;流式细胞仪测定细胞周期、凋亡的变化;Western blot方法检测与细胞周期相关蛋白Cyclin D1、Cyclin E的表达变化。结果:转染干扰质粒pRNAT-hoxb7到SKOV3细胞后,HOXB7基因的表达受到高效且特异的抑制(P<0.01);细胞增殖量减少;G1期阻滞,Cyclin D1、Cyclin E表达下降;细胞凋亡率增加。结论:HOXB7基因的表达下调可抑制SKOV3细胞增殖,其机制可能与转录下调细胞周期相关蛋白Cyclin D1、Cyclin E,使细胞周期阻滞在G1期有关;同时可促进其凋亡。
卵巢肿瘤;同源盒基因;增殖;细胞周期;Cyclin D1;Cyclin E
HOXB7基因属同源异型盒基因HOX家族HOXB簇。目前认为,其作为一类特殊的转录调节因子,不仅控制胚胎细胞的发育和分化,其过表达可能导致某些肿瘤的发生[1],在白血病、黑色素瘤、乳腺癌、胰腺癌、肺癌、肠癌等肿瘤中均证实有HOXB7基因的高表达,并且与肿瘤细胞增殖、分化、侵袭、血管生成有关[2-12]。也有研究结果表明:HOXB7基因在卵巢浆液性囊腺癌,内膜样癌中表达较正常卵巢组织高,且与卵巢癌的分级有关[13],但其在卵巢癌发生、发展中的作用尚不明了。本研究应用RNAi技术,将HOXB7基因的特异性小分子干扰RNA(siRNA)的重组质粒转染入卵巢浆液性囊腺癌SKOV3细胞,以观察阻断HOXB7基因表达对细胞增殖、细胞周期及凋亡的影响;同时检测细胞周期蛋白Cyclin D1、Cyclin E变化,初步了解其在卵巢癌中的分子机制。
1 材料和方法
1.1 材料
卵巢浆液性囊腺癌细胞株SKOV3购自美国菌种保藏中心(American Type Culture Collection)。细胞培养基RPMI-1640、Opti-MEM购自美国Gibco公司,胎牛血清购自杭州四季清公司。脂质体LipofectamineTM2000、TRIzol均购自美国Invitrogen公司。RT-PCR试剂盒购自美国Fermants公司。HOXB7兔抗人多克隆抗体购自美国ZYMED公司;兔抗人Cyclin D1和Cyclin E多克隆抗体购自美国Neomarkers公司;GAPDH鼠抗人单克隆抗体购自上海康成生物工程有限公司;HRP标记羊抗兔、羊抗鼠IgG购自上海奇康生物科技公司。质粒pRNAT-U6.1/Neo购自美国GenScript公司。
1.2 方法
1.2.1 HOXB7siRNA表达载体构建
HOXB7siRNA由载体pRNAT-U6.1/Neo质粒介导。根据siRNA设计原则和HOXB7基因mRNA编码序列,选定特异性的HOXB7siRNA序列:AGAGTAACTTCCGGATCTA(GenBank编号NM_004502,362~380 bp)。对于选定的siRNA序列,合成两条DNA模版单链,且每条单链均由siRNA的正义链与反义链组成。同时设计一条经BLAST与现有基因文库中所有人源基因均无同源性的非特异性序列(5’-TTCTCCGAACGTGTCACGT-3’)作为阴性对照。分别将根据每个序列合成的2条DNA模板单链退火后,插入空质粒构建成重组质粒。重组质粒分别命名为pRNAT-hoxb7、pRNAT-neg(作为阴性对照)。经上海博亚公司测序,鉴定正确后用于细胞转染。
1.2.2 细胞培养及转染
SKOV3细胞在37 ℃,CO2体积分数为5%的条件下,培养于含10%胎牛血清的RPMI-1640培养液中,以0.25%胰酶消化、传代。
将培养的SKOV3细胞分3组:第1组为细胞未作转染处理(空白组);第2组为细胞转染阴性质粒pRNAT-neg(阴性对照组);第3组则为细胞转染干扰质粒pRNAT-hoxb7(pRNAT-hoxb7干扰组)。转染前1天将SKOV3细胞接种于24孔板中,转染时细胞汇合至70%~80%时,按LipofectamineTM2000说明书的步骤分别转染干扰质粒pRNAT-hoxb7、阴性对照质粒pRNAT-neg。24 h后,用0.2%胰蛋白酶消化,1∶10传代于6.0 cm孔板中,48 h后用荧光显微镜观察转染后细胞荧光蛋白表达情况。高倍镜下计数100个细胞计算细胞转染阳性率。
1.2.3 RT-PCR检测
分组同细胞转染,SKOV3细胞在转染72 h后,各组取1×106个细胞按照TRIzol说明书提取细胞总RNA,紫外分光光度仪定量。取4 μg总RNA按试剂盒步骤逆转录为cDNA,再用不同引物进行PCR反应。HOXB7上游引物:5’-AGAGTAACTTCCGGATCTA-3’,下游引物 5’-TCTGCTTCAGCCCTGTCTT-3’;扩增产物为274 bp。GAPDH上游引物:5’-ACCACAGTCCATGCCATCAC-3’;下游引物:5’-CCACCACCCTGTTGCTGTAG-3’,扩增产物为450 bp。PCR的反应条件为:94 ℃变性5 min;94 ℃ 60 s、55 ℃ 60 s、72 ℃ 60 s,共30个循环;72 ℃延伸10 min;反应体系用 GAPDH作为内参照, PCR产物经1.5%琼脂糖凝胶电泳分离,紫外灯下观察并拍照。Touching凝胶成像系统分析条带灰度值,以HOXB7与GAPDH条带灰度值的比值作为HOXB7mRNA的相对表达水平。
1.2.4 蛋白质印迹法(Western blot)检测
分组同细胞转染,SKOV3细胞在转染72 h后,蛋白裂解液裂解细胞并提取总蛋白,金鸡钠酸(bicinchonininc acid)法定量。30 μg蛋白经SDS-PAGE胶分离后,转移至硝酸纤维素膜上,室温封闭1 h,加入HOXB7多抗(1∶200)、Cyclin D1多抗(1∶200)、Cyclin E多抗(1∶200)、GADPH单抗(1∶10 000),4 ℃温育过夜,次日加入HRP标记的羊抗兔、羊抗鼠二抗37 ℃温育1 h。采用增强化学发光法(enhanced chemiluminescene,ECL)显影。Touching凝胶成像系统分析条带灰度值,并与GAPDH相比较计算相对表达水平。
1.2.5 BrdU检测细胞增殖
分组同细胞转染。SKOV3细胞在转染72 h后,用10 nmol的BrdU标记细胞1 h,4%多聚甲醛室温固定20 min。用2N的HCl 37 ℃处理1 h,0.1 mol/L的硼酸钠(NaB4O7)室温处理30 min,0.1%TritonX-100室温处理2 min,10%小牛血清室温下封闭1 h,加入BrdU单抗(1∶500),4 ℃温育过夜,次日再加入羊抗鼠二抗37 ℃温育1 h,DAB显色5 min,置显微镜下观察。以细胞核呈黄色/棕黄色染色为阳性染色(为进行DNA合成的细胞)。每张片子随机取5个高倍视野(×200),计数阳性细胞所占的比例。
1.2.6 流式细胞仪检测细胞周期和细胞凋亡
分组同细胞转染。SKOV3细胞在转染72 h,并经消化、离心后(200×g,5 min,离心机型号:GB12258-1990)收集获得,用70%冷乙醇4 ℃固定过夜。用磷酸盐缓冲液(PBS)洗2次重悬细胞,加入500 μg/mL的PI和10 mg/mL的RNA酶A,37 ℃避光染色30 min,过滤后在流式细胞仪上检测,每组检测10 000个细胞,流式细胞仪自动检测出每个细胞所处的细胞周期并分别计算出G1期、S期和G2/M期的细胞所占的百分比。
转染72 h后弃上清液,冰预冷的1×PBS洗涤细胞2次,离心2 min后收集细胞,以1×106/ mL的浓度重悬于1×结合缓冲液中。取100 μL细胞悬液(1×105细胞)加入到5 mL的离心管中,分别加入5 μL Annexin Ⅴ-FITC和5 μL PI;轻轻振荡混匀,室温暗室温育15 min。每管加入400 μL的 1×结合缓冲液,混匀,立即用流式细胞仪进行分析。结果分析:未凋亡的活细胞[AnnexinⅤ(-)/PI(-)],早期凋亡细胞[AnnexinⅤ(+)/PI(-)],晚期凋亡细胞和坏死细胞[AnnexinⅤ(+)/PI(+)],机械损伤的细胞[AnnexinⅤ(-)/PI(+)]。本研究中,[AnnexinⅤ(+)/PI(-)]的细胞被认为是凋亡细胞,即早期凋亡细胞[14]。
1.3 统计学处理
所有研究均设3份平行试验,采用SPSS 11.5软件对上述结果进行分析,统计数据以表示,同组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 细胞转染情况
质粒中含有编码GFP的基因,故转染干扰质粒pRNAT-hoxb7到SKOV3细胞12 h后荧光显微镜下即可见绿色荧光细胞。48 h荧光达到明亮状态,转染48 h后荧光细胞阳性率为(80.5±3.5)%。
2.2 RNA干扰后HOXB7mRNA及蛋白抑制情况
SKOV3细胞分别经阴性质粒pRNAT-neg、干扰质粒pRNAT-hoxb7转染后,RT-PCR、Western blot方法检测SKOV3细胞HOXB7mRNA和蛋白表达。结果显示:①与空白组相比,阴性对照组细胞HOXB7 mRNA的表达无明显变化,但pRNAT-hoxb7干扰组细胞HOXB7 mRNA的表达明显下降,吸光度为阴性对照质粒组的19%(图1A);②Western blot结果显示,pRNAT-hoxb7干扰组细胞HOXB7 蛋白表达情况与mRNA表达一致,半定量分析表明,其蛋白表达量仅为阴性对照组的29%(图1B)。
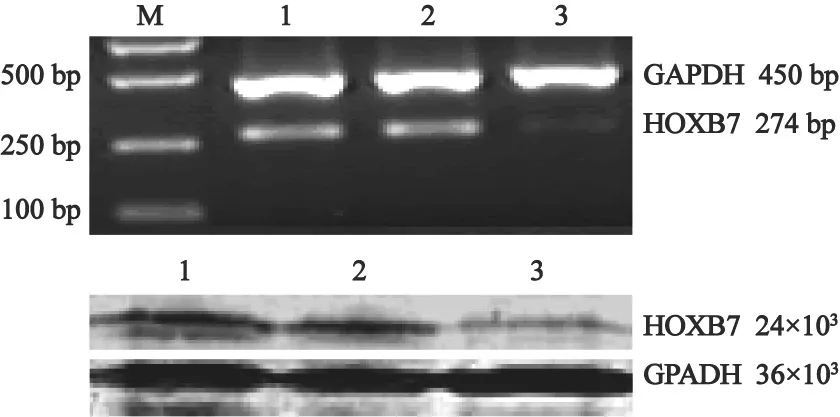
图 1 转染HOXB7siRNA到SKOV3细胞后HOXB7mRNA和蛋白表达变化Fig. 1 Transfection with HOXB7 siRNA plasmids(pRNAT-hoxb7) to knonck down HOXB7 gene in SKOV3 cell line
2.3 RNA干扰后,SKOV3细胞增殖率的改变
采用BrdU法分别检测SKOV3细胞空白组、阴性对照组、pRNAT-hoxb7干扰组细胞增殖率的变化。BrdU阳性的细胞核呈均一的棕黄色,为增殖的细胞,而BrdU阴性的细胞核则被苏木素复染为蓝色。计数5个高倍镜视野中阳性细胞所占百分比即代表各组细胞的增殖率。结果显示,pRNAT-hoxb7干扰组的SKOV3细胞增殖率为(22.78±2.08)%,明显低于空白组(35.40±1.95)%和阴性对照组(33.13±2.19)%,差异有统计学意义(P<0.05)。
2.4 干扰HOXB7表达后对人卵巢癌细胞系SKOV3细胞周期的影响
应用流式细胞仪分析细胞的细胞周期。结果显示,与空白组和阴性对照组相比,pRNAT-hoxb7干扰组G1期细胞所占比例增加,而S期细胞所占比例减少,且差异有统计学意义(P<0.01,表1)。
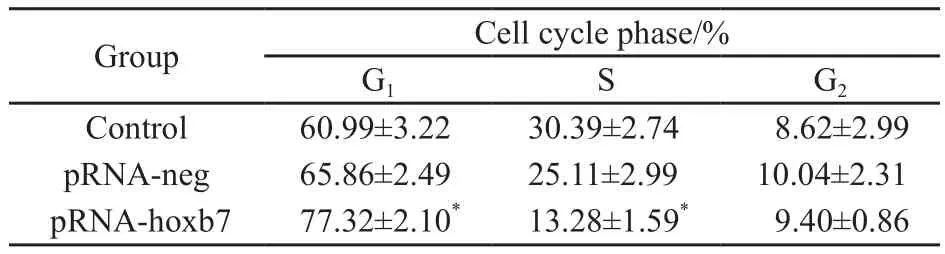
表 1 流式细胞仪检测RNA干扰前后卵巢癌SKOV3细胞周期的变化Tab. 1 Effects of HOXB7 depletion on SKOV3 cell cycle distribution
2.5 干扰HOXB7表达后SKOV3细胞中Cyclin D1和Cyclin E蛋白的表达变化
为进一步研究RNA干扰HOXB7基因引起SKOV3细胞S期变化的机制,本研究采用Western blot法检测了与细胞增殖和细胞周期有关的Cyclin D1和Cyclin E蛋白在各组细胞中的表达情况,结果发现,与空白组和阴性对照组相比,pRNAT-hoxb7干扰组Cyclin D1和Cyclin E蛋白表达水平显著下降,差异有统计学意义(P<0.05);而内参照GAPDH在各组中的表达水平相似(图2)。
2.6 HOXB7 siRNA对SKOV3细胞凋亡的影响
细胞凋亡时,膜磷脂中的磷脂酰丝氨酸(phosphatidylserine,PS)从细胞膜的内表面移到外表面,AnnexinⅤ与PS有高度的亲和力,因而能识别凋亡细胞。PI是流式细胞仪分析的显色剂。本研究中SKOV3细胞用AnnexinⅤ和PI双染色,通过流式细胞仪分析细胞的凋亡。结果显示,pRNAT-hoxb7干扰组的SKOV3细胞凋亡率为(5.54±0.61)%,高于空白组(2.50±0.59)%和阴性对照组(3.33±0.25)%,差异有统计学意义(P<0.05,图3)。
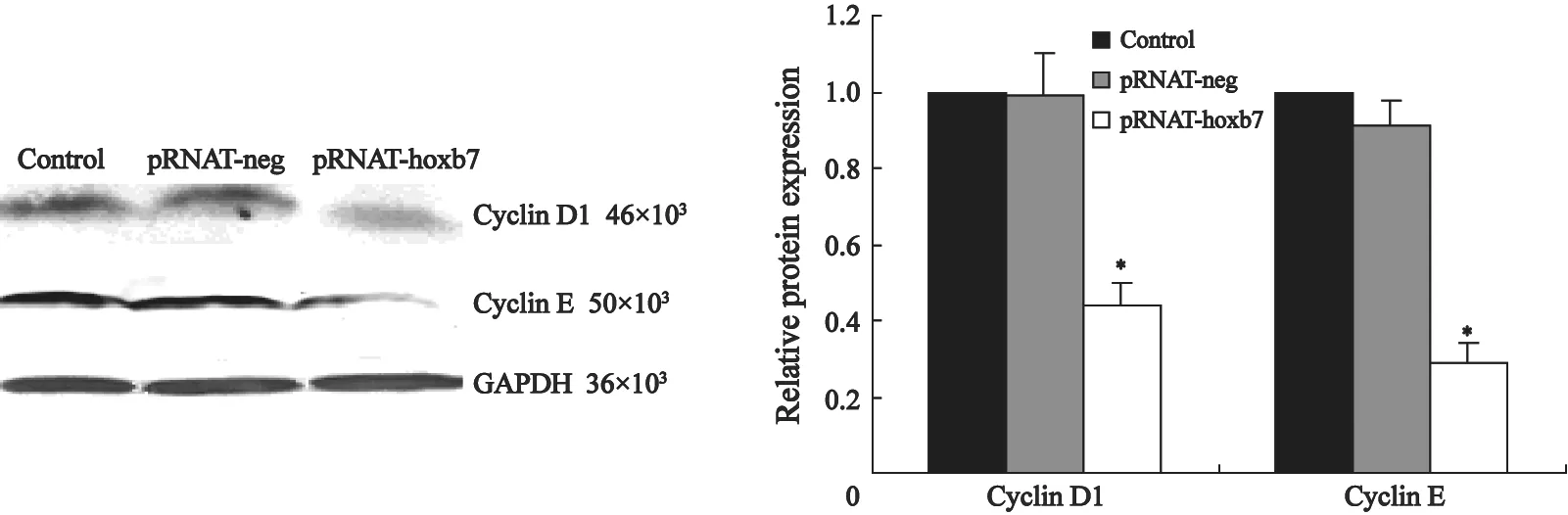
图 2 Western blot 检测HOXB7 siRNA作用后,ES-2、SKOV3细胞中Cyclin D1和Cyclin E蛋白的表达变化Fig. 2 Western blot analysis of Cyclin D1 and Cyclin E after transfection of siRNA for 72 h
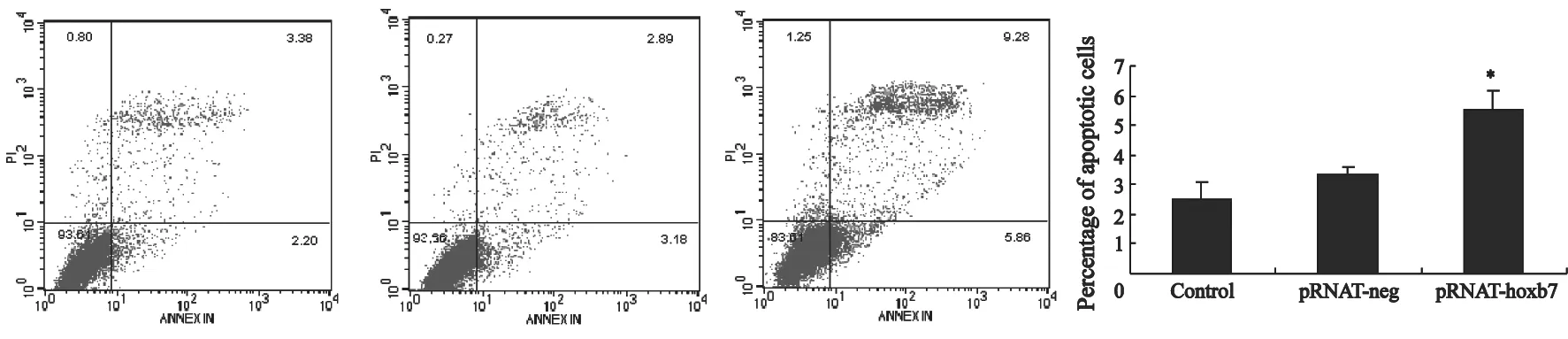
图 3 流式细胞仪检测RNA干扰HOXB7后ES-2、SKOV3细胞凋亡的变化Fig. 3 The effects of siRNA on apoptosis of SKOV3 cells in the lower right quadrant [Annexin V(+)/PI(-)] were viable apoptosis cells
3 讨 论
卵巢浆液性囊腺癌占卵巢恶性肿瘤的40%~50%,恶性程度较高、易发生转移、预后差,目前对其发生的分子机制尚不完全明了。近年有文献报道了作为胚胎发育主控基因的HOX基因参与了卵巢肿瘤的发生。如HOXA7与高分化卵巢癌或癌肿早期发生有关,可作为卵巢癌早期诊断的标志[15];HOXA9、HOXA10、HOXA11可能与诱导上皮性卵巢癌向不同病理类型分化(浆液性、内膜样、黏液性)有关[16]。
HOXB7基因属同源异型盒基因HOX家族,定位于染色体17q21.3。目前,HOXB7基因与卵巢癌关系的研究尚少,Naora等[13]用SEREX方法检测卵巢正常上皮,卵巢浆液性囊腺癌,内膜样癌患者血清中HOXB7表达及Western blot检测相应组织中HOXB7蛋白质表达,提示HOXB7在上述肿瘤组织中高表达;将HOXB7正义质粒转染入卵巢永生化上皮细胞中,细胞增殖率增加3倍,同时伴随细胞分泌碱性成纤维因子(basic fibroblast growth factor,bFGF)增多,提示HOXB7基因可能是通过转录上调bFGF分泌进而促进卵巢表面上皮细胞的增生。
为研究 HOXB7基因与卵巢癌细胞周期及相关机制,本部分实验选择了阳性表达HOXB7基因的卵巢浆液性囊腺癌细胞SKOV3。应用pRNAT-U6.1/Neo质粒构建HOXB7siRNA表达载体,并转入到上述细胞中;经RT-PCR和Western blot技术验证,其能有效阻断HOXB7基因的表达。随后,采用BrdU法和流式细胞仪分别检测干扰前后细胞增生能力及细胞周期的变化,以观察HOXB7基因对卵巢浆液性囊腺癌体外细胞增生的影响。结果显示,RNA干扰使HOXB7基因表达沉默能够显著抑制SKOV3细胞的增殖,并且使其S期细胞比例下降,G1期细胞比例增加,细胞周期阻滞在G1期。
为了进一步探讨HOXB7基因沉默导致细胞生长受抑和G1期阻滞的机制,本研究检测了在细胞增殖和细胞周期调控中起主要作用的Cyclin D1和Cyclin E蛋白在HOXB7基因干扰前后的表达变化。Cyclin D1和Cyclin E都是G1期相关的细胞周期蛋白,在G1/S期转变过程中起重要作用[17]。正常细胞的增殖分化有赖于细胞有序的周期活动,Cyclin D1定位于染色体11q13,与CDK4/CDK6结合而形成复合物,使Rb发生磷酸化而与E2F分离,驱动细胞由G1期进入S期,促进细胞增殖。当Cyclin D1或CDK4/CDK6表达失控时,可能导致细胞增殖周期失调,肿瘤发生。Cyclin E定位于染色体19q12~19q13,与细胞周期素依赖性激酶2(CDK2)结合并使之激活,在G1晚期调控和G1/S期转换过程中起关键作用,可促使细胞由G1期进入S期。Cyclin E异常表达可使CDK2持续激活,细胞周期失控而导致肿瘤发生。许多恶性肿瘤均有Cyclin D1、Cyclin E的高表达,如乳腺癌、肝癌、头颈部肿瘤等,卵巢癌亦不例外[17]。本研究发现干扰HOXB7基因后,SKOV3细胞中的Cyclin D1和Cyclin E表达水平明显降低;提示在卵巢癌中,RNA干扰HOXB7基因表达所致细胞增生能力下降可能与Cyclin D1和Cyclin E降低有关,但具体通过何途径调节尚需进一步研究。
目前有关HOXB7基因与卵巢癌凋亡关系的研究尚鲜见报道。本研究应用流式细胞仪检测了RNA干扰HOXB7基因对卵巢癌SKOV3细胞凋亡的影响。结果显示,RNA干扰使HOXB7基因表达沉默,促进卵巢癌SKOV3细胞凋亡,但具体机制尚待进一步研究。
综上所述,本研究结果表明,HOXB7基因在卵巢浆液腺囊腺癌细胞株中呈阳性表达;应用构建真核表达载体的RNA干扰技术能特异并有效地沉默HOXB7基因的表达,为研究其功能提供了一个理想的技术平台;阻断HOXB7基因在卵巢癌中表达可抑制卵巢癌细胞的恶性增殖,促进其凋亡,且抑制卵巢癌细胞的恶性增殖可能与下调细胞周期相关蛋白Cyclin D1和Cyclin E的表达有关,为进一步开展卵巢癌的基因治疗奠定了基础。另外,涉及肿瘤发生、发展的基因和影响因素决不是单一的,为了更好地了解HOXB7在卵巢癌发生、发展中的作用,有必要进一步研究HOXB7与其他调节增殖、侵袭相关基因之间的关系。
[1] FORD H L. Homeobox genes: a link between development, cell cycle, and cancer [J]. Cell Biol Int, 1998, 22(6): 397-400.
[2] INAMORI K, TAKESHITA K, CHIBA S, et al. Identification of homeobox genes expressed in human T-lymphocytes[J]. Biochem Biophys Res Commum, 1993, 196(1): 203-208.
[3] CARE A, FALICETTI F, MECCIA E, et al. HOXB7 constitutively activates basic fibroblast growth factor inmelanomas[J]. Mol Cell Biol, 1996, 16(9): 4842-4851.
[4] CARE A,FALICETTI F, MECCIA E, et al. HOXB7: a key factor for tumor associated angiagenic switch[J].Cancer Res, 2001, 61(17): 6532-6539.
[5] MAKIYAMA K, HAMADA J, TAKADA M, et al. Aberrant expression of HOX genes in human invasion breast carcinoma[J]. Oncol Rep, 2005, 13(4): 673-679.
[6] INAMORI K, TAKESHITA K, CHIBA S, et al. Identifacation of homeobox genes expressed in human T-lymphocytes[J]. Biochem Biophys Res Commum, 1993, 196(1): 203-208.
[7] CARE A, FALICETTI F, MECCIA E, et al. HOXB7 constitutively activates basic fibroblast growth factor in melanomas[J]. Mol Cell Biol, 1996, 16(9): 4842-4851.
[8] WU X, CHEN H, PARKER B, et al. HOXB7, a homeodomain protein, is overexpressed in breast cancer and confers epithelial-mesenchymal transition[J]. Cancer Res, 2006, 66(19): 9527-9534.
[9] NGUYEN K A, ARENSMAN M, LAY A R, et al. HOXB7 promotes invasion and predicts survival in pancreatic adenocarcinoma[J].Cancer, 2013, 119(3): 529-539.
[10] YUAN W, ZHANG X, XU Y, et al. Role of HOXB7 in regulation of progression and metastasis of human lung adenocarcinoma[J]. Mol Carcinog, 2012 Aug 21.doi:10.1002/mc.21947. [Epub ahead of print].
[11] LIAO W T, JIANG D, YUAN J, et al. HOXB7 as a prognostic factor and mediator of colorectal cancer progression[J]. Clin Cancer Res, 2011, 17(11): 3569-3578.
[12] BITU C C, CARRERA M, LOPES M A, et al. HOXB7 expression is a prognostic factor for oral squamous cell carcinoma[J]. Histopathology, 2012, 60(4): 662-665.
[13] NAORA H, YANG Y Q, MONTZ F J, et al. A serologically identified tumor antigen encoded by a homeobox gene growth of ovarian epithetial cells[J]. Proc Natl Acad Sci USA, 2001, 98(7): 4060-4065.
[14] ELBASHIR S M, HARBORTH J, LENDECKEL W, et al. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells [J]. Nature, 2001, 411 (6836): 494-498.
[15] NAORA H, MONTZ F J, CHAI C Y, et al. Aberrant expression of homeobox gene HOXA7 is associated with mullerian-like differentiation of epithelial ovarian tumors and the generation of a specific autologous antibody response [J]. Proc Natl Acad Sci U S A, 2001, 98(26): 15209-15214.
[16] CHENG W, LIU J, YOSHIDA H, et al. Lineage infidelity of epithelial ovarian cancers is controlled by HOX genes that specify regional identity in the reproductive tract[J]. Nat Med, 2005, 11(5): 531-537.
[17] NAM E J, KIM Y T. Alteration of cell-cycle regulation in epithelial ovarian cancer[J]. Int Gynecol Cancer, 2008, 18(6): 1169-1182.
Silencing of HOXB7 by RNAi influences proliferation and relative mechanism of ovarian serous adenocarcinoma cell line SKOV3
ZHAO Yu-qing1, HUANG Yan2, GAO Shu-jun1, FENG You-ji3(1. Department of Gynecology and Obstetrics, Gynecologic and Obstetric Hospital of Fudan University, Shanghai 200011, China; 2. Department of Gynecologic Oncology, Fudan University Shanghai Cancer Center, and Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 20032, China; 3. Department of Gynecology and Obstetrics, Shanghai First People’s Hospital, Shanghai 20080, China) Correspondence to: FENG You-ji E-mail: fengyj4806@sohu.com
Background and purpose: The expression of HOXB7 gene was higher expressed in ovarian cancer and may be involved in the cellular malignant transformation.This study used the sequence-specific siRNA knocking down the expression of HOXB7 gene and aimed to investigate its effect on cell proliferation and relative mechanism of ovarian serous adenocarcinoma cell line SKOV3. Methods: SKOV3 cells were divided into 3 groups: untreated control group, non-specific siRNA group transfected with unrelated siRNA (pRNAT-neg) and HOXB7siRNA groups transfected with HOXB7s-iRNA (pRNAT-hoxb7). RT-PCR, Western blot were used to examine the HOXB7mRNA and protein expression. Cell cycle and apoptosis were analyzed by flow cytometry. We further investigated the expression of Cyclin D1, Cyclin E by Western blot, which were critical in regulating cell proliferation. Results: The pRNAT-hoxb7 siRNA had high inhibition for HOXB7 gene (P<0.01). HOXB7 RNAi could also arrest of G1cell cycle, induce inhibition of cell proliferation and increase apoptosis rate. Western blot showed the expression of Cyclin D1, Cyclin E decreased after HOXB7 expression downregulated. Conclusion: Down-regulated HOXB7 expression could inhibit the expression of Cyclin D1, Cyclin E and thus is involved in the G1arrest and may increase the apoptosis rate of SKOV3 cells.
Ovarian neoplasms; Homeobox gene; Proliferation; Cell cycle; Cyclin D; Cyclin E
10.3969/j.issn.1007-3969.2013.03.003
R737.31
:A
:1007-3639(2013)03-0173-06
2012-12-19
2013-03-01)
丰有吉 E-mail:fengyj4806@sohu.com

