坎地沙坦酯对糖尿病大鼠肾脏氧化应激及MCP-1 表达的影响
王素梅
(1.辽宁医学院药理教研室,辽宁 锦州 121000;2.盘锦市中心医院肾内科,辽宁 盘锦 124000)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病(diabetes mellitus,DM)常见的慢性并发症,其发病机制目前尚不十分清楚,糖脂代谢紊乱、肾素血管紧张素系统的激活、氧化应激以及细胞凋亡等因素都参与其发生发展,其中氧化应激在DN 的发生发展中起重要作用[1],活性氧族(reactive oxygen species,ROS)增加及机体炎症反应在糖尿病继发性病变中发挥着重要的生物学作用[2-3]。研究显示[4],糖尿病常伴有多种细胞因子水平的改变,单核/巨噬细胞的趋化积聚对最后的肾脏损伤有着重要影响,MCP-1 被认为是引起其作用的重要调节因子,影响着巨噬细胞浸润和肾小球硬化。本研究通过观察探讨坎地沙坦对糖尿病肾脏氧化应激及MCP-1 表达的影响,进一步探讨坎地沙坦酯对糖尿病肾病的保护作用及可能机制。
1 材料和方法
1.1 材料
健康雄性SD 大鼠40 只,体重250~300 g,由辽宁医学院动物实验中心提供。链脲佐菌素(美国Sigma 公司),MDA、SOD 试剂盒(北京建成生物工程研究所),抗大鼠MCP-1 多克隆抗体(京博奥森生物技术有限公司)。
1.2 动物模型对建立
健康SD 大鼠40 只,雄性200~250 g 左右(由辽宁医学院实验动物中心提供),适应性饲养1周后,随机分为正常对照组(A)10 只,糖尿病模型组(B)10 只,坎地沙坦酯(C)低、高剂量组(D)各10 只。糖尿病组和坎地沙坦酯组均一次性给予链脲佐菌素(Sigma 公司)50 mg·kg-1(体重)左下腹腔注射,72 h 后尾静脉取血测血糖,血糖≥16.7 mmol·L-1,尿糖阳性者定为糖尿病大鼠模型。对照组给予等量柠檬酸缓冲液。坎地沙坦组按低、高剂量分别给予坎地沙坦酯5、10 mg/ (kg·d),溶于0.9%氯化钠溶液1.5 mL,灌胃1 次,连续12 周。
1.3 样品采集及处理方法
成模饲养12 周后,用20%乌拉坦(5 mL/kg)腹腔注射麻醉大鼠,颈总动脉取血2 mL,离心10 min (3000 r/min),分离血清,-80 ℃保存,用于生化指标测定。肾脏以冰生理盐水冲洗干净,用滤纸吸干水分后称重,计算肾脏质量指数=肾重/体重,左肾冻存于-80 ℃冰箱中,用于Western印迹检测;右肾以10%中性甲醛溶液固定,PBS冲洗,石蜡包埋,制成4 μm 切片,用于光镜观察及免疫组化检测。
1.4 血清中尿素测定
采用日立7180 全自动生化分析仪测定UREA。
1.5 血清及肾组织MDA 含量、SOD 活性测定
丙二醛(MDA)用硫代巴比妥酸(TBA)法,超氧化物歧化酶(SOD)活性用黄嘌呤氧化酶法。SOD 测定原理:通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子自由基(O2-),后者氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色,用可见分光光度计测其吸光度。通过公式计算出被测样品中SOD 活力。具体操作按照试剂说明书进行。
1.6 免疫组化方法检测MCP-1 蛋白表达
采用免疫组化ABC 染色法,切片厚4 μm,常规脱蜡水化,一抗为兔抗大鼠Bcl-2、P53 单克隆抗体(1 ∶50 稀释),二抗为生物素化羊抗兔lgG(1 ∶100 稀释),以PBS 代替一抗作阴性对照,DAB 显色,苏木素复染,中性树胶封片。Bcl-2为细胞质和核膜表达,阳性表达细胞为黄色或棕黄色,阴性对照用PBS 代替Ⅰ抗。
1.7 western 印迹检测MCP-1 蛋白表达及半定量分析
取大鼠肾组织,立即放入预冷的裂解缓冲液中,4 ℃超声粉碎,12000 × g 离心30 min,取上清,用Lowry 法测定蛋白质含量。用10%~12%的SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,每个泳道蛋白上样量为20 μg。一个泳道加SeeBlue Plus 2 预染蛋白标记物,电泳后将PAGE凝胶中的蛋白质电转移至硝酸纤维素膜上,取出后将膜放入3 % BSA 阻断缓冲液中,封闭60 min,再用TBS 洗膜3 次,每次10 min。将膜放入一抗中(抗体1 ∶500 稀释),4 ℃过夜。TTBS 冲洗后,将膜放入二抗(二抗均1 ∶500 稀释)中,室温孵育1~2 h,然后用TTBS 洗膜3 次,每次10 min。将膜在Super Signal West Pico 底物工作液中孵育5 min,进行Ecl 化学发光。测定MCP-1。每个抗体测定时都进行β-肌动蛋白测定,以保证蛋白上样量的一致性。利用Visionworks 6.3.3.图像采集及分析软件对蛋白带进行分析。实验重复3 次。
1.8 统计学方法
实验数据用χ2表示,用SPSS13.0 软件进行统计学分析。采用one-way ANOVA 和LSD-t 检验进行两两比较。
2 结 果
2.1 大鼠一般情况及血糖变化
病程12 周时,糖尿病组大鼠“三多一少”症状明显,精神萎靡,体毛脱落。坎地沙坦酯各剂量组大鼠一般情况优于糖尿病组。
DM 组血糖一直在高水平波动,与A 组比较明显升高(P <0.01);坎地沙坦酯各剂量组血糖与糖尿病组相比降低不明显(P >0.05),差异无统计学意义,见表1。

表1 坎地沙坦酯对糖尿病大鼠血糖的影响
2.2 坎地沙坦酯对糖尿病大鼠肾质量指数影响
与A 组相比,DM 组大鼠肾质量指数明显升高(P <0.01);坎地沙坦酯各剂量组肾质量指数与DM 组相比有不同程度的降低见表2。
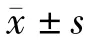
表2 坎地沙坦酯对糖尿病大鼠体重及肾脏质量指数的影响(,n=8)
2.3 坎地沙坦酯对糖尿病大鼠尿素水平的影响
与A 组相比,B 组大鼠尿素明显升高(P <0.01);而不同浓度的坎地沙坦酯剂量组尿素明显降低(P <0.05),见表3。
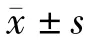
表3 地沙坦酯对糖尿病大鼠血清尿素氮水平的影响(,n=10)
2.4 坎地沙坦酯对糖尿病大鼠MDA 含量及SOD活性的影响
结果显示,与A 组相比,B 组MDA 含量显著升高 (P <0.01),SOD 活性显著降低 (P <0.05);与B 组相比,C 组、D 组SOD 活性有不同程度的升高(P <0.05),见表4。
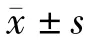
表4 各组大鼠血清及肾组织SOD 活性、MDA含量变化(,n=8)
2.5 坎地沙坦酯对糖尿病大鼠肾脏MCP-1 蛋白表达的影响及半定量分析(Western Blot)
与A 组相比,B 组中MCP-1 蛋白表达均明显升高(P <0.01);而坎地沙坦酯各剂量组与B 组相比,MCP-1 蛋白表达明显减少(P <0.05),见表5、图1。
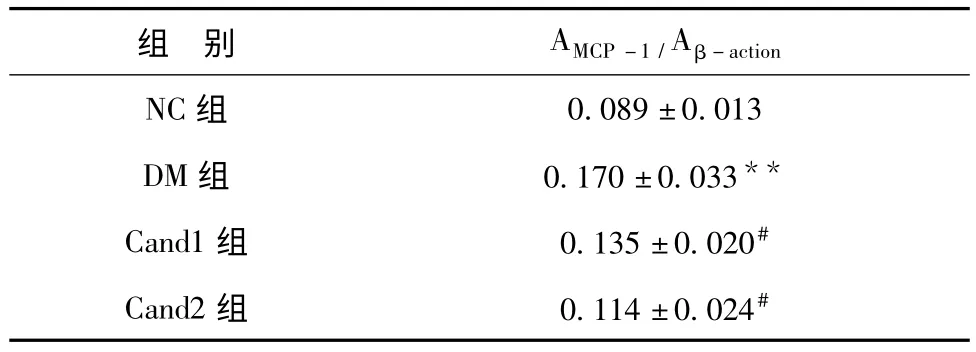
表5 坎地沙坦酯对糖尿病大鼠肾脏MCP-1 蛋白表达的影响(χ2,n=3)
2.6 坎地沙坦酯对糖尿病大鼠肾脏MCP-1 蛋白表达的影响(免疫组化法)
MCP-1 在各组大鼠肾皮质均有表达。A 组大鼠肾组织MCP-1 有较少表达,可见少量散在的棕黄色颗粒。B 组中MCP-1 蛋白表达明显增加,可见较多的棕黄色颗粒,坎地沙坦酯用药组MCP-1蛋白表达明显减弱,见图2。
3 讨 论
糖尿病肾病(diabetic nephropathy,DN)系糖尿病严重的并发症,其机制尚未完全阐明,氧化应激是其发生发展的共同机制[5]。本实验通过链脲佐菌素建立糖尿病大鼠模型,并应用坎地沙坦酯干预治疗。观察坎地沙坦酯对糖尿病大鼠氧化应激及尿MCP-1 的水平、肾组织MCP-1 蛋白表达及肾脏结构、功能的影响,探讨坎地沙坦酯肾脏保护作用及可能机制。实验中DM 组大鼠血清尿素水平升高,肾脏质量指数增加;应用坎地沙坦酯后,各剂量组血清尿素水平降低,肾脏质量指数下降,提示坎地沙坦酯对糖尿病大鼠肾脏损伤具有保护作用。
在正常情况下,活性氧产生和活性氧的清除处于平衡状态,当活性氧产生能力超过清除能力时,蓄积过多的活性氧就会攻击机体,产生氧化应激。氧化应激对糖尿病肾病的影响包括活性氧对肾小球血管通透性及血流动力学的影响,对肾细胞的损伤以及对肾组织内细胞外基质的影响等。本实验中DM 组大鼠肾组织及血清MDA 含量增加,SOD 活性下降,提示氧化应激损伤参与了糖尿病肾病的发生发展。
MCP-1 是趋化性细胞因子C-C 亚家族成员之一,由单核细胞及其他非白细胞所分泌[6],其主要功能是趋化单核/巨噬细胞至炎症部位[7]。正常肾组织中系膜细胞、肾小管上皮细胞、肾小球内皮细胞等均可分泌微量的MCP-1,其表达依赖于细胞核因子κB 及转录因子AP-1 的协调作用[8]。近年研究认为[9],肾小球中由于单核细胞趋化蛋白l (MCP-l)合成和分泌增加,从而趋化和激活单核/巨噬细胞和部分T 淋巴细胞,吸引其向病变部位的聚集、浸润,经一系列炎症反应,形成免疫复合物、以及补体活化等,参与了DN 的发生、发展。糖尿病时肾脏固有细胞分泌MCP-1 增强,大量MCP-1 可促使单核/巨噬细胞在肾脏广泛积聚,促进肾脏表达多种生长因子,诱导肾脏固有细胞增生、活化,产生大量胶原和细胞外基质沉积,最终导致糖尿病肾病的发生[10-11]。本实验中糖尿病大鼠肾组织中MCP-1 表达水平升高,进一步证实了糖尿病状态下MCP-1 分泌增加。
坎地沙坦酯作为一种血管紧张素Ⅱ1 型受体拮抗剂,可在受体水平完全阻断AngⅡ的作用,对肾脏有保护作用[12]。许多证据已经证明,ARB 类能够通过阻断肾素-血管紧张素醛固酮系统减少糖尿病肾病尿蛋白排泄[13]。血管紧张素Ⅱ1 型受体拮抗剂坎地沙坦可延缓糖尿病肾脏损伤,但其作用机制目前仍不完全明确。本研究应用坎地沙坦酯干预后,糖尿病大鼠肾脏病理变化较轻,肾功能明显改善,提示坎地沙坦酯对延缓糖尿病肾病具有一定的保护作用。且坎地沙坦酯能减少MDA 含量,升高SOD 活性,降低糖尿病大鼠肾脏MCP-1 蛋白表达,提示坎地沙坦酯对DN 的保护作用可能与抑制氧化应激及下调MCP-1 的表达有关。

图1 各组大鼠肾脏MCP-1 蛋白表达(western Blot 法)

图2 各组大鼠肾脏MCP-1 蛋白表达(免疫组化法×400)
[1]Nam JS,Cho MH,Lee GT,et al.The activation of NF-kap-paB and AP-1 in peripheral blood mononuclear cells isolated from patients with diabetic nephropathy [J].Diabetes Res Clin Pract,2008,81 (1):25-32.
[2]Westermann D,Rutschow S,Van Linthout S,et al.Inhibition of p38 mitogen-activated protein kinase attenuates left ventricular dysfunction by mediating pro-inflammatory cardiac cytokine levels in a mouse model of diabetes mellitus [J].Diabetologia,2006,49 (10):2507-2513.
[3]Aneja A,Tang WH,Bansilal S,et al.Diabetic cardiomyopathy:insights into pathogenesis,diagnostic challenges,and therapeutic options [J].Am J Med,2008,121 (9):748-757.
[4]Juan F,Gonzalez N,Mora-Fernandez CM.The role of inflammatory cytokines in diabetic nephropathy [J].J AmSoc Nephrol,2008,19 (3):233-234.
[5]Evans JL,Goldfine ID,Maddux BA,et al.Oxidative stress and stress- activated signaling pathways:a unifying hypothesis of type 2 diabetes [J].Endocr Rev,2002,23 (5):599-622.
[6]Fujita H,Morii T,Koshimura J,et al.Possible relationship between adiponectin and renal tubular injury in diabetic nephropathy [J].Endocr J,2006,53 (6):745-752.
[7]Chiarelli F,Cipollone F,Mohn A,et al.Circulating monocyte chemoattractant protein-1 and early development of nephropathy in type 1 diabetes [J].Diabetes Care,2002,25 (10):1829-1834.
[8]Mezzano S,Aros C,Droguett A,et al.NF-Κb activation and overexpression of regulated genes in human diabetic nephropathy[J].Nephrol Dial Transplant,2004,19 (10):2505-2512.
[9]Zheng D,Wolfe M,Cowley BD Jr,et al.Urinary excretion of monocyte chemoattractant protein-1 in autosomal dominant polycystic kidney disease [J].J Am Soc Nephrol,2003,14(10):2588-2595.
[10]Ichinose K,Maeshima Y,Yamamoto Y,et al.Antiangiogenic endostatin peptide ameliorates renal alterations in the early stage of a type 1 diabetic nephropathy model [J].Diabetes,2005,54 (10):2891-2903.
[11]Gruden G,Setti G,Hayward A,et al.Mechanical stretch induces monocyte chemoattractant activity via an NF- Κb- dependent monocyte chemoattractant protein-1- mediated pathway in human mesangial cells:inhibition by rosiglitazone [J].J Am SocNephrol,2005,16 (3):688-696.
[12]Sasaki M,Uehara S,Ohta H,et al.Losartan ameliorates progression of glomerular structural changes in diabetic KKAy mice[J].Life Sci,2004,75 (7):869-880.
[13]Andersen S,Jacobsen P,Tarnow L,et al.Time course of the antiproteinuric and antihypertensive effect of losartan in diabetic nephropathy [J].Nephrol Dial Transplant,2003,18 (2):293-297.

