聚乙二醇-b-聚α-羟基辛酸载药胶束的制备
刘晓娟,蔡东,王志伟,王浩
(辽宁医学院药学院,辽宁 锦州 121000)
基于胶体制剂的渗透保留效应的被动靶向是提高药物治疗指数的一种重要方法,这样的胶体粒子表面是亲水的并且尽可能避免血浆中调理素的结合,一般用亲水的高分子对粒子表面进行覆盖或修饰。聚乙二醇是最常见的一类结构简单的亲水高分子,直接将其与疏水链段键合后形成胶束是形成亲水修饰粒子较简单的方法之一[1-2]。
脂肪族聚酯是一类在药剂学中非常重要的疏水高分子,其可作为微球、水凝胶、胶束、植入小棒、电纺纤维等多种药物控制释放系统[3],现研究较多的为人工合成的α-羟基聚酯和ε-羟基聚酯[4],此外还有β-羟基聚酯,γ-羟基聚酯等亦有所研究,但该两者只能通过发酵方法制备很难控制聚合度重现性[5]。α-羟基脂肪酸可以通过开环聚合精确地控制分子量,但是现有的研究局限在分子中只有2、3 个碳原子的即聚乙醇酸,聚乳酸及其共聚物[6],碳原子数较多的α-羟基聚酯的研究还较少,仅有数篇文献报道[7-8]。本文合成聚乙二醇嵌段的聚α-羟基辛酸,亲水与亲脂部分嵌段比相等,可在水中形成胶束,并且试采用此高分子胶束包裹一系列常见的药物,发现对蒿甲醚,α-亚麻酸两者增溶效果好,且制备所得胶束在4 ℃,25℃和37 ℃条件下分别在4 d 和1 w 内稳定。
1 材料和仪器
3,6-二己基-1,4-二氧杂-2,5-二酮(辛交酯,纯度>98%,按文献[9]合成),聚乙二醇单甲氧基醚2000 (MePEG2000), (Mw =2000,Fluka 公 司,日 本);2- 乙 基 己 酸 亚 锡 (Sn(OCt)2,Sigma 公司,纯度>95%,日本);甲苯(化学纯,天津大茂化工有限公司);无水乙醇(分析纯,天津大茂化工有限公司);丙酮(分析纯,天津永晟精细化工有限公司),三氯甲烷(分析纯,天津永晟精细化工有限公司),二氯甲烷(分析纯,天津永晟精细化工有限公司),正己烷(分析纯,天津康科德化工有限公司)。蒿甲醚(上海DESANO公司,纯度>97%),α-亚麻酸(按文献[10]自制,纯度>98%),吲哚美辛(宁波大红鹰制药,纯度>98%),全反式维甲酸(山东良福制药有限公司,纯度>98.5%),布地奈德(上海医药工业研究院有限公司,纯度>98%),槲皮素(中国药品生物制品检定所,纯度>97.5%),紫杉醇(上海DESANO 公司,纯度>98%)。
核磁共振光谱仪 (1HNMR,Bruker,300 MHz,美国),凝胶渗透色谱(GPC,Wyatt Technology Inc.,DAWN HELEOS,Waters 泵,Shodex 804 凝胶柱,Optilab rEX 示差检测器,美国),场发射扫描电子显微镜(JSM-6301F,日本电子株式会社,分辨率1.5nm,加速电压10 kV),电热套(ZDHW 型,河北黄骅中兴仪器有限公司),离心机(80-2 型,江苏金坛中大仪器厂),真空干燥箱(ZDF-6050 型,上海精宏实验设备有限公司),旋片真空泵(ZXZ-2 型,浙江黄岩求精真空泵厂),旋转蒸发仪(RE-52ASHZ-Ⅲ型,上海亚荣生化仪器厂),去离子水(1810-B 型石英自动双重纯水蒸馏器,江苏金坛宏华仪器厂),电冰箱(BCD- 216YH 型,青岛海尔股份有限公司),高效液相色谱仪(包括UV-975 型紫外检测器,PU-980 型泵,日本SHIMADZU 公司),甲醇(色谱纯,天津康科德化工有限公司),乙腈(色谱纯,天津康科德化工有限公司)。
2 方法与结果
2.1 聚乙二醇嵌段聚α-羟基辛酸的合成
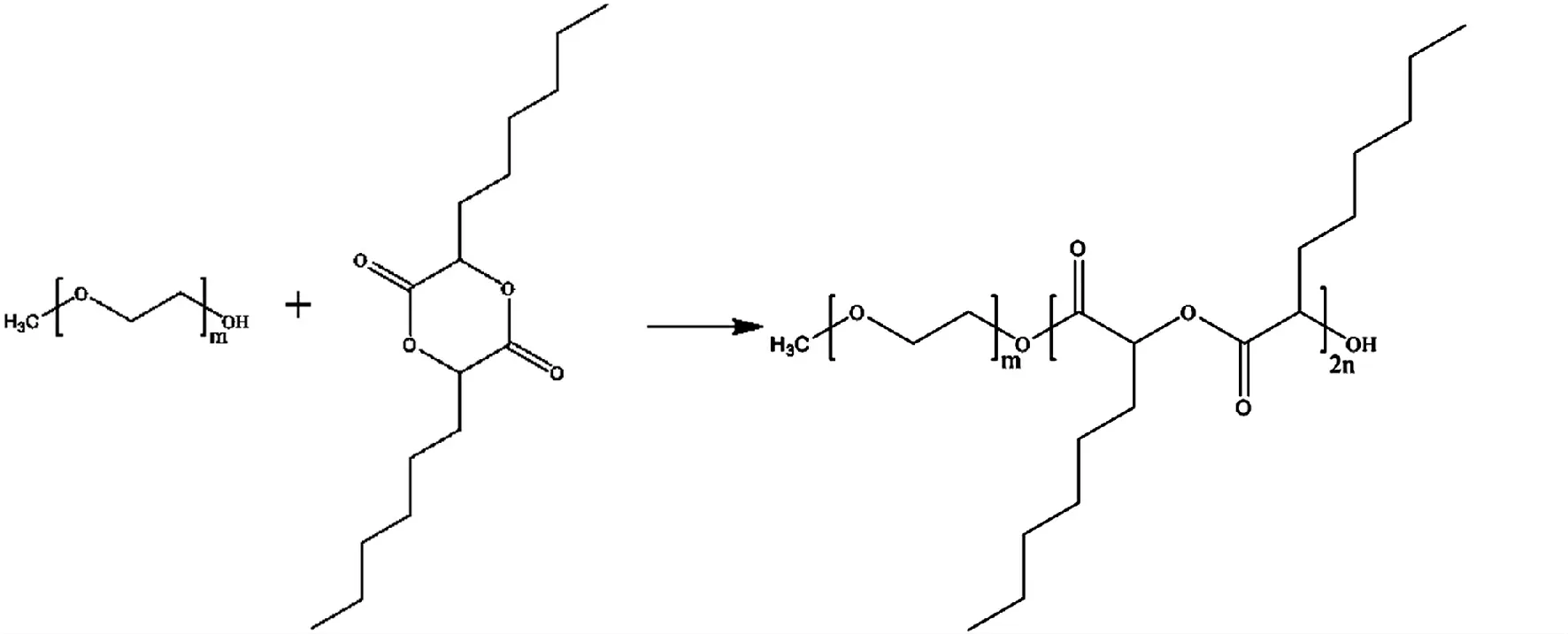
图1 聚乙二醇-b-聚α-羟基辛酸的开环聚合法制备过程
并加以改进[9],无水氮气氛条件下将5 g 用无水乙酸乙酯重结晶的辛交酯置于干燥反应瓶中,110 ℃磁力搅拌20 min 挥干残余的水分和有机溶剂,将5 g 的MePEG2000 和2 滴催化剂Sn(Oct)2溶解在100 mL 无水甲苯溶液中后注入辛交酯的反应瓶中并连接分水器。在120 ℃磁力搅拌条件下,反应物呈溶液状态并进行开环聚合反应,3 h 后停止加热并旋蒸浓缩残液至30 mL 左右,室温下放冷后,将冷冻的1 ∶1 正己烷—乙醚混合液倒入并剧烈搅拌使聚合物析出。将此混合液在2000转/min 条件下离心,弃去上清液将底部白色沉淀用冷的1 ∶1 正己烷—乙醚混合液再混悬,除去残留的未反应辛交酯,低聚合度产物和催化剂Sn(Oct)2,重复3 次后将底部白色沉淀在40 ℃真空抽干至恒重得纯品PEG-PHO。
由图2 和3 可知,得到了聚乙二醇嵌段的聚α-羟基辛酸,所得高分子的质均分子量Mw,数均分子量Mn 和多分散系数PDI 由凝胶渗透色谱测定,以氯仿为流动相。结果为Mw:4.96 × 103,Mn:4.73 ×103,PDI 为1.07。
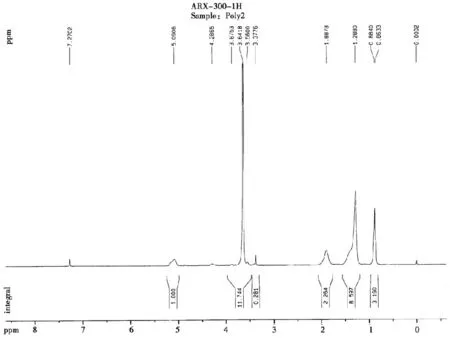
图2 聚合度约为15 的聚乙二醇嵌段聚α-羟基辛酸的1H 核磁共振光谱
2.2 干膜—水化法制备载药胶束及药物增溶结果
制备胶束的方法较多,将干膜水化法是速度最快的一种,可用于筛选药物与成胶束材料的亲和性[11]。具体将PEG-PHO 溶解于丙酮中,可得到澄清,均一,透明,微带淡蓝色乳光的溶液。所选择的药物均溶解于丙酮,药物溶解于丙酮中。所选药物均溶解在丙酮中。将药物和PEG-PHO 溶解在丙酮中形成无色均一的溶液,在旋转蒸发仪下,40℃,10 min 左右,蒸除溶剂,所有样品均在瓶壁上形成无色,均一,透明,无泡点的薄膜,在室温下用纯净水水化,可以发现载有蒿甲醚,α-亚麻酸和吲哚美辛的胶束溶液均为澄清,均一,透明,微带淡蓝色乳光的溶液,全无无固体物质析出。
图4 中A 和B 是两种载药胶束的显微形态及其粒径大小及分布测量结果,可以发现,载有蒿甲醚的PEG-PHO 胶束外观圆整,粒径较小,平均约在90 nm;载有蒿甲醚的PEG-PHO 胶束外观亦较圆整,但是由于α-亚麻酸可能是油状物,PEG-PHO 作为一种表面活性剂对其增溶时与其的结合,粒径较前者,平均约在170 nm。
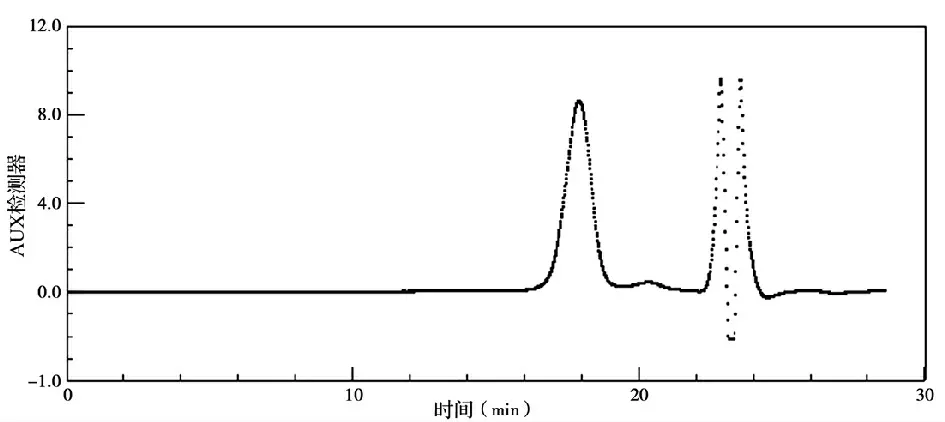
图3 聚乙二醇-b-聚α-羟基辛酸的凝胶渗透色谱图
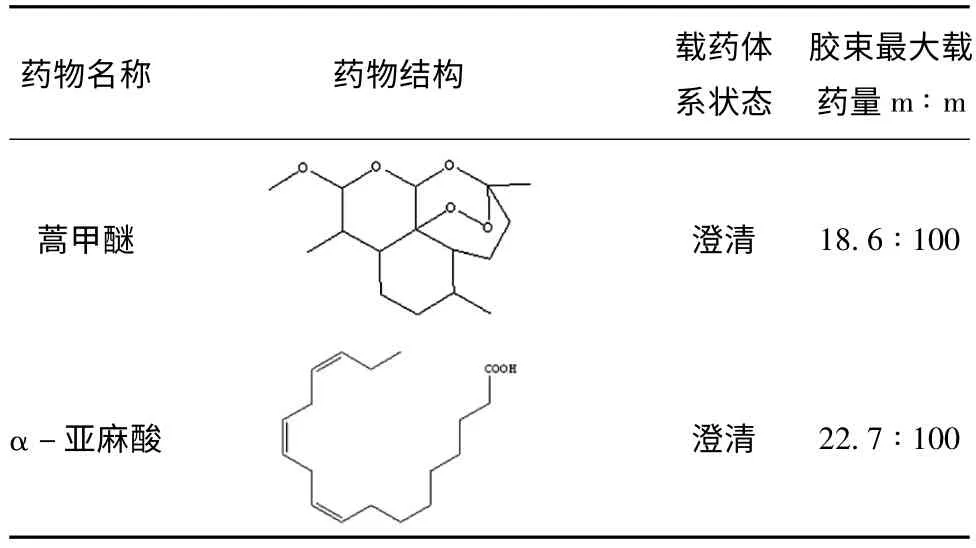
表1 PEG-POH 胶束增溶效果较好的药物
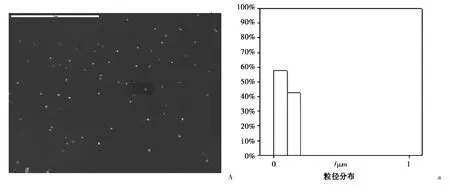
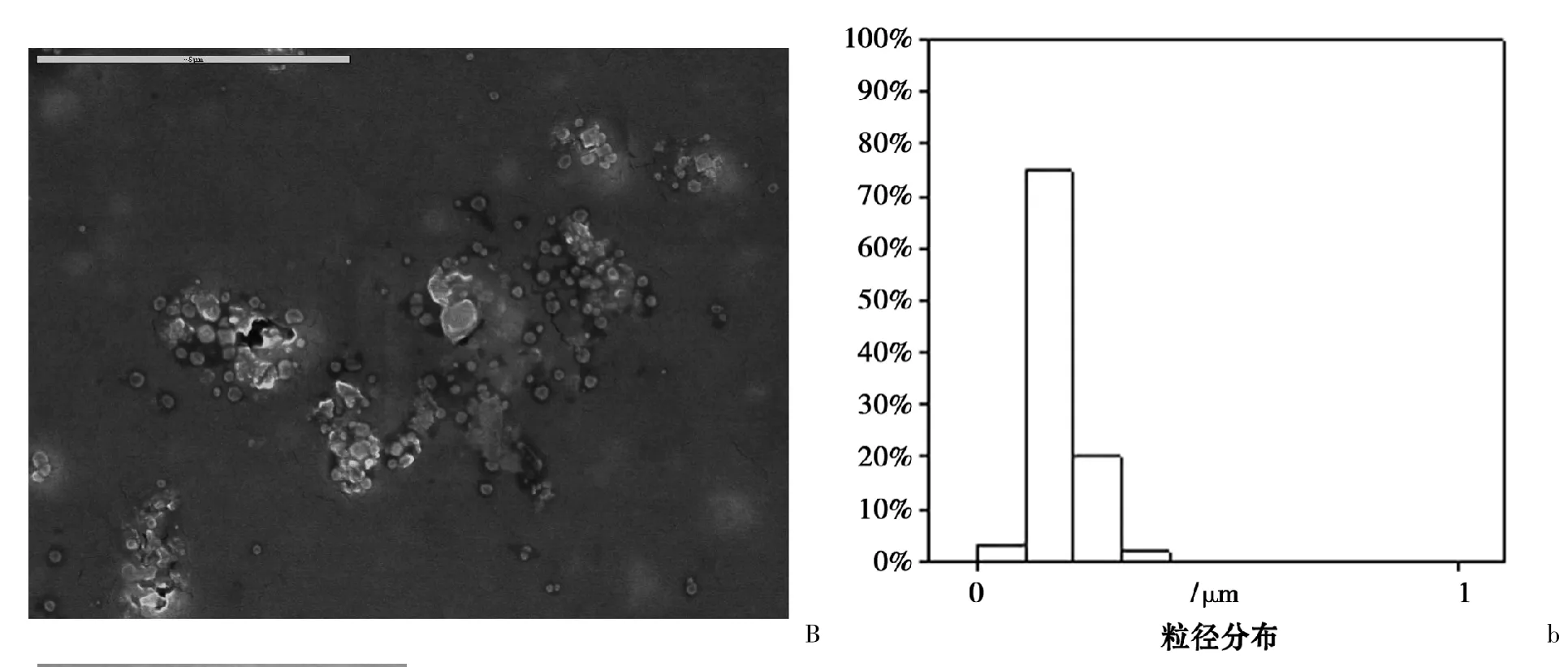

图4 载药胶束的形态表征
图4C 给出了溶解蒿甲醚后的胶束溶液外观,可以发现溶液澄清,无沉淀析出,微显淡蓝色乳光,说明有胶体存在。同时,实验中亦采用干膜—水化法制备了载有其它药物的胶束,比如紫杉醇、全反式维甲酸、槲皮素、布地奈德、吲哚美辛等。这些载药薄膜在药物:PEG- PHO 为3 ∶100 时,在水化后即有大量的白色沉淀析出,可能是未被溶解的药物或药物与PEG-PHO 的混合物析出。很明显在这种制备方法下,药物不能够被很好地包裹,原因可能为这些化合物的化学结构不适合包裹。观察PEG-PHO 的化学结构可以发现,PHO部分相当于把正己烷键合到聚酯链上,能够很好增溶的2 个化合物的结构一个为醚萜类,一个为烷酸类,化学结构相似故相溶,实际上,紫杉醇、槲皮素等化合物在水中的溶解度很低,在正己烷这种非极性有机溶剂中的溶解度也低。这也证明了聚酯侧链的化学基团性质对药物增溶有影响。
全反式维甲酸,布地奈德,槲皮素,紫杉醇等均难溶于水,分子中含有较多的杂原子,全反式维甲酸虽然具有一个环状烷基端且整个分子杂原子所占比例较少,但长链部分为全反式的多共轭双键结构可能是影响其在胶束中增溶的原因之一;布地奈德整个分子虽为亲脂性,但为4 个并联环状结构能是影响其增溶的原因;槲皮素难溶于水,但在常见的有机溶剂中的溶解度尚可,分子中完全为芳香结构,提示芳香结构与n-己基侧链的相容性很差,同样的还有吲哚美辛可能也是由于分子中芳香结构占主要比例所以增溶效果亦不佳,其在分子中的绝大部分是由5 个双键和一个羰基形成的π- π 结构,所以在胶束内核的包裹欠佳。药物的化学结构对其溶解性的影响以及非离子型表面活性剂对药物的增溶的影响因素复杂[12-13],本文仅作直观观察和简单推测,具体原因还要通过其它方法进一步阐释和确证。
表2 PEG-POH 胶束增溶效果较差的药物
这些化合物中,吲哚美辛可以以15 ∶100 的两包裹在胶束中形成澄清溶液,但只能保持约30 min,随后便逐渐析出大量的白色沉淀,取澄清状态下的溶液迅速滴于载玻片上自然晾干后观察可发现如图5 中的结构。
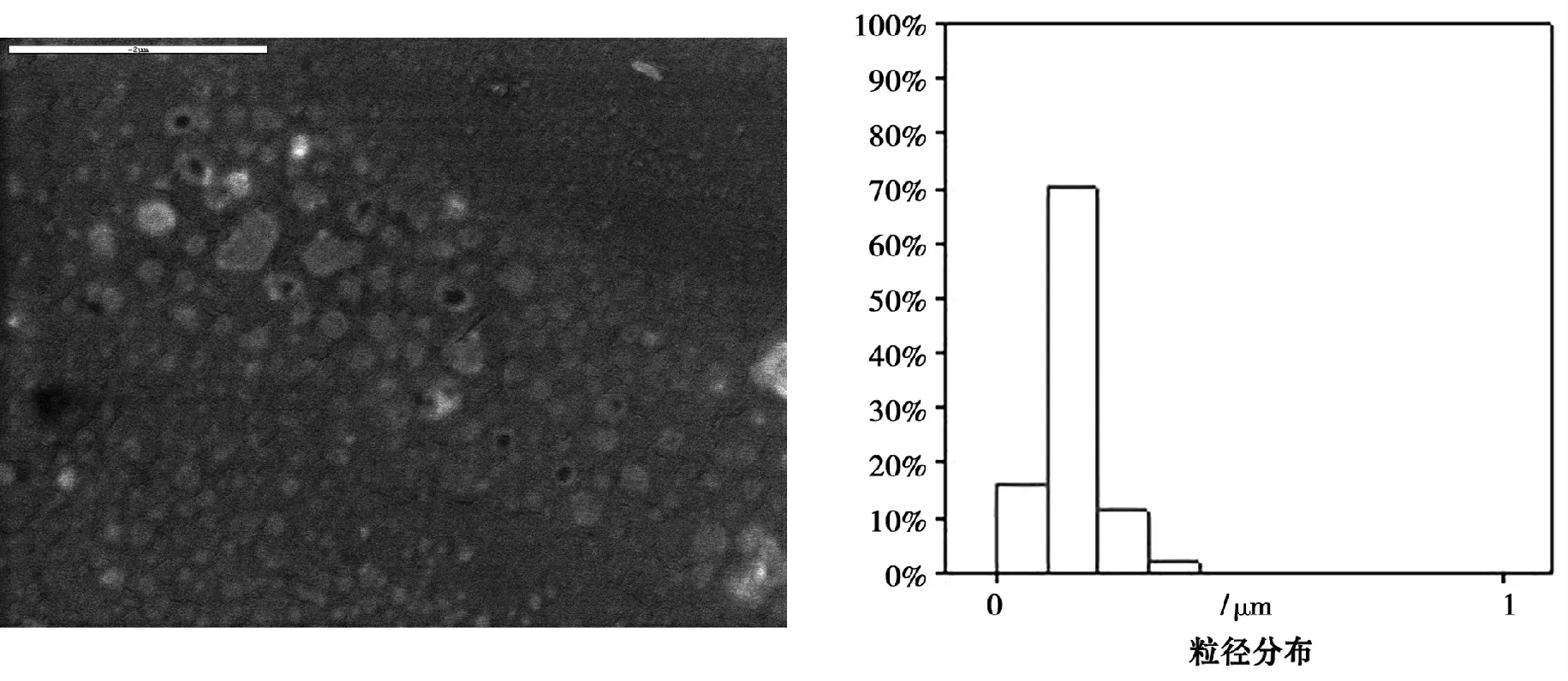
图5 载有吲哚美辛的PEG-PHO 胶束
2.3 载蒿甲醚,α-亚麻酸和吲哚美辛胶束的含量稳定性
理论上胶束为自发形成的热力学稳定体系,但载药胶束会受到被包载药物的影响而产生合并,絮凝等现象,最终导致体系中沉淀的出现。评价载药胶束稳定性的方法很多,其物理稳定性可以通过评价其粒径随时间变化的方法来实现[14],但本法要求电子显微镜照片,对于长时间产生的大样本实验来说费时且成本极高。本实验发现载药胶束溶液在一段时间后会析出沉淀,故采用评价上清液中未析出药物的含量占原有载药量百分比随时间变化的方法来评价其稳定性,因为含量测定所需时间较短且成本较低。具体实验方法为将15 ∶100 载药量的蒿甲醚,α-亚麻酸和吲哚美辛的胶束避光置于4 ℃,25℃和37 ℃的环境下,在不同的时间点,观察胶束溶液中是否有结晶或其它形态固体物质析出,同时采用3000转离心1 min 的方法将固体物质离心后测定上清中液中药物的含量,以其对时间作图得图6。
实验中采用高效液相色谱-紫外分光光度法测定胶束中药物含量,蒿甲醚流动相为甲醇/水=90/10;α-亚麻酸的流动相为乙腈/水=85/15;吲哚美辛的流动相为:6 mmol 磷酸/乙腈=50/50。其中三者均采用Diamonsil C18柱,柱长250 cm,填料粒径5 μm,流动相的流速均为1 mL/min,检测波长均为210 nm,柱温均为35 ℃,测定时采用相应流动相稀释载药胶束溶液。

图6 不同温度下,蒿甲醚(A),α-亚麻酸(B),吲哚美辛(C)PEG-PHO 胶束中的药物含量随储存时间的变化
对于蒿甲醚胶束,含量在4 d 之后开始有明显的下降,且体系中出现细小的结晶,该结晶在光线下能够反光,2 w 后上清胶束中药物含量小于初始含量的20%,容器底部含有较多结晶和白色絮状物质;对于α-亚麻酸胶束,含量在7 d 之后开始有明显的下降,同时体系中有细小白色絮状物质出现,2 w 后上清胶束中药物含量均在50%以下,容器底部含有较多白色絮状物质;对于吲哚美辛胶束,30 min 后体系中既有大量白色细小碎片状物质析出,1 h 后上清中吲哚美辛含量为初始含量的60%多左右,2 h 后只剩下20%多的药物包裹在胶束中,24 h 后各个温度下上清液中含量均不到原有的5%。
综上,可以发现α-亚麻酸胶束较之蒿甲醚胶束含量大幅下降起始时间延后4 d,且下降的速率慢,并且在实验结束点,仍然留在上清胶束中的药物保存量也多。蒿甲醚胶束在25 ℃和37 ℃储存温度时较4 ℃储存温度时含量稳定,而α-亚麻酸胶束相反。蒿甲醚胶束和α-亚麻酸胶束的含量稳定性能维持数天而吲哚美辛胶束只能够维持数小时。这些现象是由药物本身的化学结构决定的,聚α-羟基辛酸相当于把n-己烷连接在聚酯侧链上,如果药物的化学结构与n-己烷相容性差,则药物很难增溶在聚α-羟基辛酸部位。蒿甲醚和β-榄香烯均为萜类化合物,前者分子中除氧原子外无杂原子,含有碳-碳键和醚键两种亲脂的化学键,后者分子中只含有碳-碳键并且无杂原子,是能够溶解在n-己烷中的,而其它的化合物由于带有杂环和环系,则在n-己烷中溶解度差而导致在聚α-羟基辛酸部位增溶效果差,小分子对药物的溶解能力一定程度上决定其键合到高分子上后对药物的溶解能力,这在以往的文献中亦有所报道[15-16]。
3 讨 论
3.1 根据本实验可知除文献报道的灰黄霉素外[8]417,PEG-PHO 所形成的胶束还对水难溶的蒿甲醚,α-亚麻酸有包载增溶作用,所形成的胶束分别为颗粒状和液滴状。尽管所形成的胶束仅能够在数天内稳定,不能够较长期保存,但可以使用时现用现配,即水化能够长期保存的载药干膜得到胶束溶液,故具有实用价值。
3.2 采用干膜—水化法制备载药胶束时,该嵌段共聚物对全反式维甲酸,布地奈德,槲皮素,紫杉醇等的包裹能力较差。对吲哚美辛虽能包裹,但所得载药胶束溶液在2 h 后内析出将近80%的被载药物,实用价值差。说明胶束内核化学结构对被载药物的化学结构有要求。分子中无共轭体系的化合物能够被较好包裹,当然此结论还有待继续实验加以充实。
3.3 本文采用的包裹药物的方法为将嵌段共聚物/药物/有机溶剂体系旋转蒸发除去有机溶剂,值得注意的是这种方法可能并不是完好包裹药物的一种较好方法,并且制备胶束不止干膜水化这一种方法,亦可以采用高分子/药物混合有机溶液水透析法制备[10]202-204,而该方法下PEG-PHO 能否完好包裹本研究未被包裹的药物需要进一步的研究。
参考文献:
[1]李珺婵,方晓玲.嵌段共聚物胶束作为抗肿瘤药物载体的研究进展[J].国外医学—药学,2004,31 (1):48-49.
[2]李爱贵,邓联东,董岸杰.聚乙二醇在新型药物制剂中的应用[J].高分子通报,2004,8:96-101.
[3]Leong KW,Langer R.Polymeric controlled drug delivery [J].Advanced Drug Delivery Review,1988,1 (3):199-233.
[4]刘潇,李彦锋,崔彦君,等.脂肪族聚酯类生物可降解医用高分子材料的研究进展[J].化学通报,2010,3:220-226.
[5]李爱萍,李光吉.聚羟基脂肪酸酯生物合成的研究进展[J].高分子通报,2004,(5):20-27.
[6]Lutz RAsmus,Robert Gurny,Michael Möller.Solutions as solutions-Synthesis and use of a liquid polyester excipient to dissolve lipophilic drugs and formulate sustained- release parenterals[J].European Journal of Pharmaceutics and Biopharmaceutics,2011,79 (3):584-591.
[7]Trimaille T,Mondon K,Gurny R,et al.Novel polymeric micelles for hydrophobic drug delivery based on biodegradable poly(hexyl- substituted lactides) [J].International Journal of Pharmaceutics,2006,319 (1-2):147-154.
[8]Wang H,Song H,Chen X,et al.Ibuprofen release from PEG-PLLA electrospun fibers containing PEG blocked poly α-hydroxyl octanoic acid as an additive [J].Chinese Journal of Polymer Science,2010,67 (3):417.
[9]王浩,邓英杰,王玉玲,等.α-羟基辛酸及其交酯的合成工艺改进[J].合成化学,2008,16 (1):53-55.
[10]宋宏锐,洪盈.高纯度γ-亚麻酸及其衍生物的制备[J].沈阳药学院学报,1990,7 (3):202-204.
[11]施斌,方超,裴元英.两亲性嵌段共聚物胶束的研究进展[J].中国医药工业杂志,2005,36 (4):239-243.
[12]苏德森,王思玲.物理药剂学[M].北京:化学工业出版社,2004:78-84.
[13]崔福德,龙晓英.药剂学[M].第7 版.北京:人民卫生出版社,2011:44-46.
[14]崔福德,龙晓英.药剂学[M].第7 版.北京:人民卫生出版社,2011:50-52.
[15]Lee J,Lee SC,Acharya G,et al.Hydrotropic solubilization of paclitaxel [J].analysis of chemical structures for hydrotropic property,2003,20 (7):1022-1030.
[16]Huh K M,Lee SC,Cho YW,et al.Hydrotropic polymer micelle system for delivery of paclitaxel [J].Journal of Controlled Release,2005,101:59-68.

