TGF-β1、Serpine1、vWF、PF4在深静脉血栓患者血白细胞和血小板中的表达
胡继红,赵学凌,李宏昆,吴雪梅,王兵
深静脉血栓形成(deep venous thrombosis,DVT)指血液在深静脉内异常凝集。随着预防和治疗方法的发展,其发生率已明显下降,但对于严重创伤或大手术后的老年患者,卧床或制动时间较长,下肢静脉血流淤滞,易发生DVT而阻塞静脉,严重者可发生下肢股青肿、缺血坏死,若血栓脱落,可导致大面积肺栓塞(pulmonary embolism,PE)而危及生命,慢性期常伴发DVT后综合征[1]。因此,DVT的早期预测诊断和预防显得非常重要,但对于血栓形成早期,静脉内皮细胞调控、白细胞和血小板功能变化、诱导凝血/抗凝、纤溶/抗纤系统失衡及促进血栓形成的机制尚不完全清楚,目前仍未发现较可靠的预诊标志物[2-3]。本研究拟检测白细胞聚集、血小板活化相关基因转化生长因子(TGF)-β1、纤溶酶原激活物抑制因子1(Serpine1)、血管性血友病因子(vWF)、血小板第4因子(PF4)在DVT患者血液中的表达变化,为探寻预诊标志物提供依据。
1 材料与方法
1.1 研究对象与分组
选取下肢静脉曲张患者58例为DVT观察对象,其中10例患者术前发生股静脉血栓者纳入血栓形成组,行抗凝加溶栓规范治疗,待血栓消退,深静脉血流通畅,能保证肢体静脉回流后,再行浅静脉抽剥术,48例术前未发现深静脉血栓者均行浅静脉抽剥术,术后5例发生DVT,亦纳入血栓形成组,故血栓形成组共纳入15例患者。43例未发生DVT者,随机选取15例纳入无血栓形成组。另选15名健康志愿者作为正常对照组。
DVT观察、诊断考虑以下几个方面及要点:由一组高年资医生实施,系统掌握深静脉血栓相关理论;能够准确动态观察症状变化及进行正确的体格检查;掌握相关手术技术,能保证手术质量;结合相应情况及时行超声检查,筛查有无血栓形成;必要时再行静脉造影确诊,确保所采集到的血液样本与相应状态尽可能相符。
1.2 方法
1.2.1 血液样本采集、保存和总RAN的提取确保所采集血液样本与相应状态尽可能相符,按不同组别采血,每例研究对象在相应状态,每次从肘静脉采集静脉血10 ml(真空枸橼酸钠抗凝抽血管,每管约2.7 ml),立即颠倒混匀20次以便充分混匀,避免血液部分凝固、血栓形成。采用血液样本保存试剂盒(PAXgene Blood RNA Tube,BRT,美国QIAGEN公司)保存样本,并于30 min内将血样(2.5 ml)倒入BRT管中,立刻盖上盖颠倒20次充分混匀血样。然后,将BRT管置室温(18~25℃)静置2 h以上(但不超过24 h),以便血样与BRT管中试剂充分反应,达到最佳RNA提取效率。采用血白细胞和血小板中总RNA提取试剂盒(PAXgene Blood RNA Kit,美国QIAGEN公司)提取血白细胞和血小板中总RAN约45μl,具体操作按说明书进行。从每份RNA样本中取5μl按1∶200稀释,检测吸光度260/280(A260/A280)比值均在1.8~2.0。
1.2.2 cDNA合成取8μl RNA模板,加入实时-PCR反应体系,低温(4℃)离心15 s(3 000 g)后放入PCR仪,实时-PCR反应条件为37℃60 min,将RNA反转录为cDNA(Quantscript RT kit Quant cDNA第一链合成试剂盒,天根生化科技公司)。从每份cDNA中取出0.5μl为模板,行PCR扩增内参基因GAPDH,经凝胶电泳检测,条带较亮、大小正确,然后将剩余的cDNA模板(约19μl)置于-80℃储存备用。
1.2.3 PCR和实时-PCR引物设计引物设计采用Primer 5.0软件,要求必须跨越内含子,避免基因组污染,由上海生工生物工程技术服务有限公司合成(表1)。
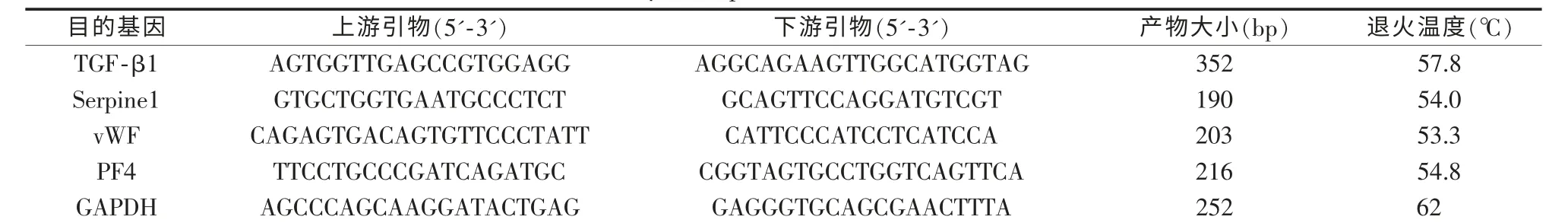
表1 人TGF-β1、Serpine1、vWF、PF4基因引物序列
1.2.4 PCR检 测TGF-β1、Serpine1、vWF、PF4表达采用PCR试剂盒(2×Taq PCR MasterMix,天根生化科技公司)检测血白细胞和血小板中TGFβ1、Serpine1、vWF、PF4表达。将血液0.5μl cDNA模板,加入RCR反应体系,PCR反应条件为:预变性95℃,3 min;扩增条件:变性95℃30 s,退火60°30 s,72℃,延伸30 s,循环35次;72℃,10 min充分延伸。
1.2.5 实时-PCR检测TGF-β1、Serpine1、vWF、PF4表达采用荧光实时-PCR试剂盒(Platinum®SYBR®Green qPCR试剂盒,美国Invitrogen公司)检测血白细胞和血小板中TGF-β1、Serpine1、vWF、PF4表达。采用荧光实时定量PCR仪7300(美国ABI公司)和Power SYBR®Green实时-PCR Master Mix进行实时-PCR,操作按试剂盒说明书进行,设定扩增程序如下:预变性95℃2 min;变性95℃5 s,退火60℃30 s,循环40次。溶解曲线阶段:变性95℃15 s;退火60℃30 s;延伸72℃30 s。以GAPDH作为内参照。TGF-β1等目的基因的相对表达量按公 式2-△△CT=2[CtN(T-gene)-CtN(GAPDH)]-[CtA(T-gene)-CtA(GAPDH)]计算[4]。
1.3 统计学方法
重复检测3次,用SPSS11.5统计学软件进行分析,组间比较采用单因素方差分析(q检验)。P<0.05为差异有统计学意义。
2 结果
2.1 PCR检测TGF-β1、Serpine1、vWF、PF4 mRNA在各组中的表达
从凝胶电泳结果可见,血栓形成组中所检测TGF-β1、Serpine1、vWF、PF4 RNA条带灰度值明显较正常对照组及无血栓形成组增高,提示TGF-β1、Serpine1、vWF、PF4在血栓形成组表达明显增高。
2.2 各组PCR电泳结果A值分析
TGF-β1、Serpine1、vWF、PF4的A值在血栓形成组中明显高于正常对照组和无血栓形成组,差异有统计学意义(P<0.05,表2),提示TGF-β1、Serpine1、vWF、PF4在血栓形成组表达升高。

表2 TGF-β1、Serpine1、vWF、PF4 mRNA在各组中的表达
2.3 实时-PCR检测TGF-β1、Serpine1、vWF、PF4 mRNA在各组中的表达
TGF-β1、Serpine1、vWF、PF4 mRNA在血栓形成组中的表达明显高于无血栓形成组和正常对照组(P<0.05),后两组间差异无统计学意义(P>0.05),见表3、4;图2~3)。
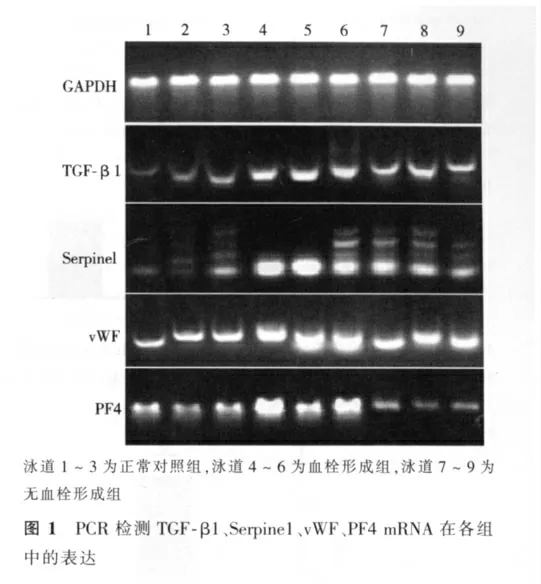
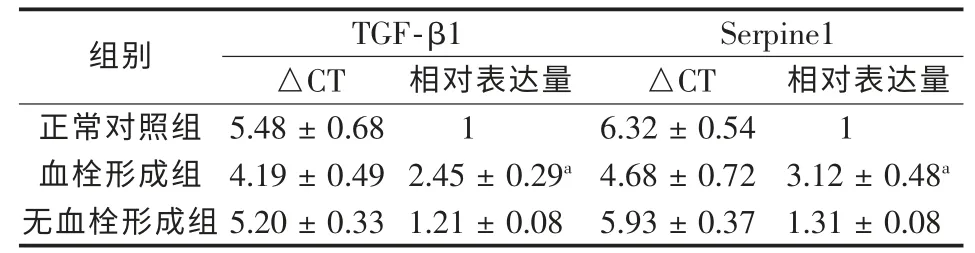
表3 TGF-β1和Serpine1在各组间的相对表达量

表4 vWF和PF4在各组间的相对表达量
3 讨论
DVT形成过程是动态变化过程,涉及多系统、多因素,调控机制复杂。参与DVT形成的血管内皮细胞、血白细胞、血小板、粘附因子、炎症因子、血流动力学等因素彼此相互影响,错综复杂,凝血/抗凝、纤溶/抗纤溶系统生理状态下保持动态稳定并相互制约,一旦平衡打破,在分泌的各种细胞因子调控下,内皮细胞、血白细胞、血小板之间相互粘附、聚集,启动凝血级联反应,促使局部分子微环境向血栓形成方向发展,致血栓形成[3]。其中TGF-β1、Serpine1、vWF、PF4对白细胞粘附聚集、血小板活化具有重要调控作用。本研究探讨它们在DVT患者血白细胞和血小板中表达变化及在血栓形成中的作用。

vWF主要在内皮细胞和巨核细胞内合成,在血小板α颗粒、血浆和内皮下连接组织也能产生。vWF能与血小板糖蛋白Ⅰb-Ⅸ和内皮下胶原结合,成为血小板粘附在内皮下的桥梁,桥接血小板与静脉内皮间的粘附;还能与血小板糖蛋白Ⅱb/Ⅲa结合,桥接血小板与血小板间的粘附,诱导血小板聚集,参与血栓形成。最近的研究发现,vWF水平增加与动脉粥样硬化、急性冠状动脉综合征、心肌梗死的发生密切相关[5-6],但在DVT中的研究较少。本研究发现vWF mRNA在DVT患者血白细胞和血小板中表达上调,可能通过诱导血小板粘附、聚集,促进了DVT形成。
血小板α颗粒中25%的蛋白质是PF4,它是血小板活化后释放最多的蛋白,被认为是血小板活化的标志物,活化的血小板可以分泌PF4,并诱导CD40L释放,通过CD40-CD40L结合促进内皮细胞与血小板间的相互粘附,进而介导内皮细胞从静息状态转化为活化状态。PF4可通过上调TLR2表达激活核转录因子(NF)-κB,从而促进内皮细胞表达粘附分子(ICAM-1、E-slectin、VCAM-1)、趋化因子(MCP-1、MIP-1)和炎性因子(TNF、IL-1)促进炎症反应,进而通过趋化因子诱导单核细胞、中性粒细胞募集、粘附于静脉壁内皮,通过E-selectin/ESG-L介导血小板与内皮细胞间的粘附作用,进而促进血栓形成及动脉粥样硬化[7-8],但在DVT形成中的研究较少。本研究发现PF4 mRNA在DVT患者血白细胞和血小板中表达上调,可能通过介导白细胞粘附和血小板活化,促进了血栓形成。
纤溶系统由纤维蛋白溶解酶(纤溶酶),纤溶酶激活物和纤溶酶抑制物组成。纤溶抑制物包括纤溶酶原激活抑制剂(PAI)、α2抗纤溶酶(α2-AP)和凝血酶激活的纤溶抑制物(TAFI)。Serpine1也称纤溶酶原激活物抑制因子1(PAI-1),主要由血管内皮细胞、脂肪细胞、巨噬细胞、心肌细胞、成纤维细胞和肝细胞合成,近来发现血小板也能合成和储存PAI-1,且当血小板活化后可以释放PAI-1,它通过抑制u-PA和t-PA的活性,阻断或减缓纤溶酶原活化为纤溶酶,抑制血栓降解,促进稳定血栓的形成[9]。近来发现,血清PAI-1升高所导致的低纤溶能力,可能是DVT的高危因素之一且Serpine1基因4G/5G的多肽性与DVT发生密切相关[10-11]。前期动物实验发现,DVT模型大鼠股静脉内皮组织中Serpine1表达水平明显上调[12]。本研究发现Serpine1 mRNA在DVT患者血白细胞和血小板中表达明显上调,可能通过抑制纤溶而促进了血栓形成。Serpine1在不同组织中的产生和释放受到多种刺激因素,如内毒素、炎症因子(IL-1等)、TGF-β家族、TNF所调节。
其中,TGF-β家族重要成员TGF-β1可刺激血管平滑肌细胞分泌PAI-1[13]。TGF-β可以通过调控一些相关基因的表达,参与高血压、糖尿病、动脉粥样硬化和心肌肥厚及纤维化等心脑血管疾病的病理进程。但在DVT中的作用研究较少,而本研究发现TGF-β1及其下游基因Serpine1、vWF、PF4 mRNA在DVT患者血白细胞和血小板中表达上调,TGFβ1可能通过调控下游基因Serpine1、vWF、PF4表达,参与白细胞粘附、血小板活化而促进血栓形成。
[1]顾建平,徐克,滕皋军.下肢深静脉血栓形成介入治疗规范的专家共识[J].介入放射学杂志,2011,20:505-510.
[2]李炯,唐博.静脉血栓栓塞生物标志物的研究进展[J].重庆医学,2012,41:2326-2328.
[3]Esmon CT.Basic mechanisms and pathogenesis of venous thrombosis[J].Blood Rev,2009,23:225-229.
[4]Schmittgen TD,Livak KJ.Analyzing real-time PCR data by the comparative C(T)method[J].Nat Protoc,2008,3:1101-1108.
[5]Xu AG,Xu RM,Lu CQ,et al.Correlation of von willebrand factor gene polymorphism and coronary heart disease[J].Mol Med Report,2012,6:1107-1110.
[6]van Galen KP,Tuinenburg A,Smeets EM,et al.Von willebrand factor deficiency and atherosclerosis[J].Blood Rev,2012,26:189-196.
[7]Aidoudi S,Bikfalvi A.Interaction of PF4(CXCL4)with the vasculature:a role in atherosclerosis and angiogenesis[J].Thromb Haemost,2010,104:941-948.
[8]Kowalska MA,Rauova L,Poncz M.Role of the platelet chemokine platelet factor 4(PF4)in hemostasis and thrombosis[J].Thromb Res,2010,125:292-296.
[9]Brogren H,Karlsson L,Andersson M,et al.Platelets synthesize large amounts of active plasminogen activator inhibitor 1[J].Blood,2004,104:3943-3948.
[10]Meltzer ME,Lisman T,de Groot PG,et al.Venous thrombosis risk associated with plasma hypofibrinolysis is explained by elevated plasma levels of TAFI and PAI-1[J].Blood,2010,116:113-121.
[11]Akhter MS,Biswas A,Ranjan R,et al.Plasminogen activator inhibitor-1(PAI-1)gene 4G/5G promoter polymorphism is seen in higher frequency in the Indian patients with deep vein thrombosis[J].Clin Appl Thromb Hemost,2010,16:184-188.
[12]胡继红,吴雪梅,李兴国,等.转化生长因子β1和纤溶酶原激活物抑制因子1促进创伤性深静脉血栓形成的实验研究[J].介入放射学杂志,2011,20:890-894.
[13]Samarakoon R,Higgins SP,Higgins CE,et al.TGF-beta1-induced plasminogen activator inhibitor-1 expression in vascular smooth muscle cells requires pp60(c-src)/EGFR(Y845)and Rho/ROCK signaling[J].J Mol Cell Cardiol,2008,44:527-538.

