尾悬吊模拟失重对大鼠血清GAS 含量和胃黏膜Hsp70及其基因表达的影响
郭 彪,李正鹏,杨建武,周金莲,杨鹤鸣,董满库,王 平,张宏文,李成林,崔 彦
1.安徽医科大学解放军306 临床学院普通外科,北京 100101;2.解放军第306 医院普通外科;3.解放军第306 医院病理科
进入21 世纪以来,我国载人航天事业飞速发展,探索和明确失重状态下航天员机体各器官系统的变化愈加紧迫和重要[1]。研究已证实,微重力状态会导致心血管功能障碍、骨质丢失、肌肉萎缩、免疫能力下降、内分泌功能紊乱及空间运动病等多种病理生理的改变,但对消化系统尚缺乏系统研究[2]。胃是机体最大的消化和分泌器官之一,了解失重对胃黏膜结构及功能造成的应激影响有重要意义。本文研究尾悬吊模拟失重环境对大鼠血清胃泌素(gastrin,GAS)含量、腺胃区胃黏膜组织中热休克蛋白70(heat shock protein 70,Hsp70)及其基因表达的变化,探讨胃黏膜组织对尾悬吊模拟失重的应激反应特点,为航天员的医监医保提供参考依据。
1 材料与方法
1.1 实验动物与分组 经医院伦理委员会批准后进行动物实验。采用SPF级健康成年雄性Wistar 大鼠64只,体质量(200±20)g,由中国农业大学动物实验研究所提供。经适应性饲养1周后进行实验,按随机数字表法将实验大鼠分为8组(n=8),分别为悬尾6 h、12 h、1 d、2 d、3 d、5 d、7 d和0 h(地面对照组)。
1.2 动物模型与取材 采用尾吊法建立模拟失重动物模型[3]。大鼠单笼饲养,实验组大鼠尾部悬于笼顶,前肢踏于笼底,呈-30°头低位;对照组大鼠置于相同鼠笼中。动物饲养条件为人工控温(23±2)℃,保持12 h 光照与黑暗交替循环,均可自由活动、饮水采食。各实验组结束时,腹腔注射10%水合氯醛(300 mg/kg)将动物麻醉,无菌操作,经腹正中线剖腹,显露下腔静脉抽取血样本,切取腺胃区胃黏膜组织两份,一份超低温保存于液氮罐中,另一份浸于4%多聚甲醛(pH 7.4)中固定,常规石蜡包埋。
1.3 放免法检测大鼠血清GAS 含量 静脉血4℃过夜,离心3 000 r/min×10 min,分离血清,-80℃冰箱保存。血清GAS 含量采用放射免疫法测定,碘(125I)胃泌素放射免疫分析药盒[Iodine (125I)Gastrin Radioimmunoassay Kit]购自北京北方生物技术研究所,具体操作步骤按试剂盒说明书及相关步骤进行。
1.4 免疫组化法检测大鼠胃黏膜组织中Hsp70 表达 (1)取石蜡包埋的胃黏膜组织,4μm 切片,常规脱蜡水化;(2)3%过氧化氢灭活内源性过氧化物酶20 min,TCA 溶液微波抗原修复4 min×4次,冷却至室温;(3)10%羊血清室温下孵育1 h,封闭非特异性抗原;(4)稀释Hsp70 多克隆抗体(BA0928,武汉博士德生物工程有限公司),PBS 代替一抗作为阴性对照,4℃孵育过夜,PBS 洗5 min×3次;(5)加入生物素标记的羊抗兔IgG(Zymed,USA),常温下孵育3 h,PBS洗5 min×3次;(6)滴加辣根过氧化物酶标记的链霉亲和素(Zymed,USA),37℃温箱中孵育30 min,PBS洗涤5 min×5次;(7)DAB 显色,复染,脱水,透明,封片,显微镜下观察摄像;(8)Hsp70 结果判定:以细胞核和(或)胞浆中有明显的棕黄色颗粒为阳性。Image-Pro Plus 7.0 图像处理软件对Hsp70的表达进行定量分析,测定免疫组化照片光密度值,计算平均光密度值(mean density=IOD SUM/area)的高低来反映Hsp70蛋白表达量的变化。IOD(integrated optical density)SUM为免疫组化照片阳性着色(棕黄色)的累积光密度值,area为整个照片区域的面积。以每组(n=8)平均光密度的平均值作为该组的测量值。
1.5 RT-PCR 检测大鼠胃黏膜组织中Hsp70 mRNA表达 取液氮罐中保存的胃黏膜组织,用Trizol 法(美国Inventory 公司)提取总RNA,应用RT-PCR 技术检测胃黏膜组织中Hsp70 mRNA 表达,引物序列(根据Genebank 设计)、循环条件和扩增片段长度见表1。PCR 产物用2%琼脂糖凝胶电泳分离,使用Gel Image System 凝胶成像系统观察并拍照,应用AlphaImger 2200 software对扩增产物进行表达强度分析,以Hsp70 mRNA/GAPDH 灰度值比值作为Hsp70 mRNA的相对表达水平。

表1 PCR 引物序列、循环条件和扩增片段长度Tab 1 PCR primer sequence,reaction condition and amplified fragment length
1.6 统计学分析 采用SPSS 17.0 统计软件进行数据分析,数据用表示,多个样本的比较采用单因素方差分析,组间两两比较采用t 检验。P<0.05为差异有统计学意义。
2 结果
2.1 实验动物观察 本实验过程中无实验动物死亡现象。尾悬吊初始,大鼠躁动不安,部分大鼠眼结膜有充血现象;悬吊1 d 时,动物转为精神萎靡,饮食较对照组减少,稀便排泄物增多;悬吊2~3 d 以后各组大鼠逐渐恢复平静,饮食、饮水逐渐恢复。悬吊1 d、2 d和3 d组大鼠的体质量较悬吊前下降(P<0.05,见表2)。
2.2 大鼠血清GAS 含量 与对照组相比,实验组大鼠血清GAS 含量(pg/ml)在模拟失重早期(6~12 h)明显升高(55.73±4.86 vs 64.99±4.95、67.73±3.66,P<0.05)。随着尾悬吊时相的延长,血清GAS 含量呈逐渐下降趋势,5 d(55.16±2.92)时与对照组水平相近,之后继续下降,7 d的GAS 含量(48.73±2.99)低于对照组,但差异无统计学意义。
表2 尾悬吊模拟失重大鼠体重变化(g,)Tab 2 Changes of rats weight under simulated weightlessness(g,)

表2 尾悬吊模拟失重大鼠体重变化(g,)Tab 2 Changes of rats weight under simulated weightlessness(g,)
注:与尾悬吊前比较,* P<0.05。
2.3 免疫组化检测结果 Hsp70 阳性表达着色为棕褐色。实验各组大鼠胃黏膜组织中均有Hsp70 阳性表达。悬吊6 h~2 d各组大鼠胃黏膜组织中着色明显变深,尤其胞核在模拟失重早期即深染,期间胞浆染色亦增强(见图1A、1B);悬吊3~7 d组大鼠的胞核染色又逐渐变浅,部分胞核中染色消失,但细胞浆内仍有比较明显的Hsp70 染色(见图1C、1D);对照组仅胞质有弱表达,胞核无表达(见图1E、F);阴性对照图组胃黏膜组织细胞胞核和胞浆中均未见着色(见图1G、1H)。各实验组平均光密度值的变化表现为:尾悬吊6 h组Hsp70 蛋白表达水平(0.2229±0.0073)显著升高,12 h(0.2034±0.0091)、1 d(0.1994±0.0076)、2 d(0.1735±0.0057)组的Hsp70 蛋白持续高表达,与对照组(0.1137±0.0051)比较,差异有统计学意义(P<0.05);模拟失重3 d 后Hsp70 表达水平(0.1394±0.0083)下 降 较 明 显;3 d组、5 d组(0.1307±0.0043)、7 d组(0.1158±0.0069)大鼠的Hsp70 表达水平与对照组基本相同,差异无统计学意义(P>0.05)。

图1 尾悬吊模拟失重大鼠胃黏膜组织中Hsp70 表达情况 A~B:6 h组;C~D:3 d组;E~F:对照组;G~H:阴性对照组Fig 1 Hsp70 expression in gastric mucosa of tail-suspended rats A~B:suspension for 6 h;C~D:suspension for 3 d;E~F:suspension for 0 h;G~H:negative control
2.4 RT-PCR 检测结果 检测结果表明,模拟失重各组及对照组大鼠胃黏膜组织中均有Hsp70 mRNA 表达(见图2),表现为早期上升后期回落的特点。模拟失重6 h 大鼠胃黏膜组织中Hsp70 mRNA 表达水平即明显上调,与对照组比较,差异有统计学意义(P<0.05)。12 h、1 d、2 d各组的Hsp70 mRNA 表达逐渐回落,3 d组降至接近对照组水平,其后又出现一短时相升高现象(见图3)。
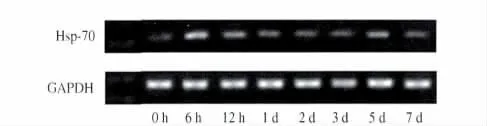
图2 RT-PCR 分析模拟失重大鼠胃黏膜组织中Hsp70 mRNA表达水平变化Fig 2 Hsp70 mRNA were detected in gastric mucosa of both suspended and control rats by RT-PCR analysis
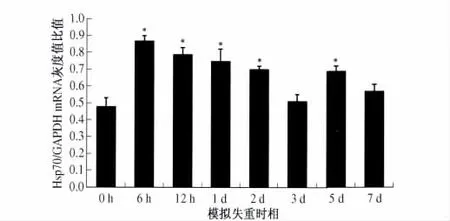
图3 半定量RT-PCR 显示各组大鼠胃黏膜组织中Hsp70/GAPDH mRNA的灰度比值Fig 3 The semi-quantitative RT-PCR analysis showed the features of Hsp70 mRNA expression in gastric mucosa tissue of both suspended and control rats
3 讨论
胃肠道功能庞大而复杂,微重力环境下的胃肠生理病理学研究,一直是一个焦点和难点问题[2]。本实验检测尾悬吊模拟失重大鼠胃黏膜中Hsp70及其基因表达的变化,研究失重对胃黏膜造成的应激反应特点。Hsp70 是最重要的应激反应分子伴侣,参与应激情况下细胞内蛋白质的合成、运输、降解及调节等一系列过程,其表达水平与组织细胞损伤及自身保护能力密切相关,并具有双刃剑样作用[4]。失重环境下胃黏膜组织中Hsp70 表达的相关研究尚未见文献报道。根据胃黏膜组织的不同,大鼠的胃分为皮区(cutaneous zone)和腺区(glandular zone)两部分,皮区上皮的角化与食管相似,腺区黏膜为单层柱状上皮,充满腺体。本研究免疫组化结果显示,模拟失重大鼠胃黏膜组织中Hsp70 表达呈现早期上升后期回落并有波动的特点;RT-PCR 结果显示,大鼠胃腺区胃黏膜组织中Hsp70 mRNA 表达有类似的先升高后降低的变化特点,与Hsp70的表达变化既有同步趋势,又有一定差异性,分析这种差异产生的原因,可能一方面符合基因转录激活先于下游蛋白合成的规律,同时是否存在应激原对Hsp70 mRNA 上下游基因信号调控和对Hsp70 mRNA前体影响的特殊机制,尚需要进一步研究。尾悬吊大鼠胃腺区Hsp70及其基因表达变化的特点,充分说明Hsp70 参与了模拟失重大鼠胃黏膜的应激反应,并在应激反应及失重耐受形成过程中可能发挥重要作用。胃黏膜应激反应发展到一定程度上,直接的后果是应激性溃疡。航天员地面模拟失重训练乃至航天飞行过程中,胃黏膜应激反应情况是一个值得受到关注的问题。根据Hsp70 既具双刃剑样作用又有交叉耐受和记忆功能的特性[4],理论上可以认为,失重及各种非失重应激原诱导表达的Hsp70 在一定程度上均能提高失重应激耐力,这与航天员通过地面模拟失重训练以期提高失重耐力的实际情况相吻合。这种机制在失重强化训练过程中的作用并加以充分利用极具重要的现实意义。
失重环境是一种特殊的应激原,可导致机体在局部和整体上均产生一系列应激反应。研究证实,失重可激活下丘脑-垂体-肾上腺轴及交感、副交感神经系统,而人体胃肠道激素的分泌受中枢和外周神经系统的调节[5]。本研究在观察尾悬吊模拟失重对胃黏膜应激效应的同时检测血清GAS 含量变化。GAS 又称促胃液素,是一种最早为人们所认识的胃肠肽类激素,主要由胃窦及十二指肠近端黏膜的G 细胞分泌,具有促进胃酸和胃蛋白酶原分泌等生理功能。本研究发现,在模拟失重早期大鼠血清GAS 含量明显升高,而随着尾悬吊时相的延长,血清GAS 含量呈逐渐下降趋势,7 d 时的GAS 含量低于对照组,这与Riepl等[6]的研究结果近似。分析认为,在应激状态下GAS 表达量升高,将导致胃酸和胃蛋白酶分泌增多,可能会影响胃黏膜,促发消化性溃疡的形成。相关研究发现,模拟失重环境可降低大鼠胃黏膜结构再生,延迟大鼠实验性胃溃疡的愈合[7],这也从另一角度印证了模拟微重力可影响胃黏膜屏障功能。但也有研究表明,GAS 还具有增加胃肠黏膜细胞DNA、RNA 合成及胃黏膜血流量,促进黏膜生长的作用[8]。显然,GAS对胃黏膜的多重作用及调节机制尚有待深入研究。实验动物在失重暴露急性期后,血清GAS的下降应属于机体的一种适应性变化,而较长时间失重环境下血清GAS的变化规律及机制和意义亦需进一步研究。
综上所述,尾悬吊模拟失重环境中的大鼠,无论其血清GAS 含量的波动,还是胃黏膜腺区Hsp70 表达的变化,均提示在尾悬吊早期胃黏膜屏障会受到源自局部和全身性的应激因素的损伤,而在失重暴露急性期以后机体则可通过各种机制对失重得以适应。这种多因素多层面相互作用和时相不同特点各异的具体机制,意义深远,有待深入探讨。
[1]Guo YH.Research and prospect of space life science[J].Med J Chin PLA,2011,36(4):416-417.郭英华.空间生命科学研究与展望[J].解放军医学杂志,2011,36(4):416-417.
[2]Guo B,Li CL,Cui Y.Pogress in the effects of weightlessness on digestive system[J].Chin J Gastroenterol Hepatol,2013,22(5):482-487.郭彪,李成林,崔彦.失重对消化系统影响的研究进展[J].胃肠病学与肝病学杂志,2013,22(5):482-487.
[3]Morey-Holton ER,Globus RK.The hindlimb unloading rodent model:technical aspects[J].J Appl Physiol,2002,92(4):1367-1377.
[4]Silver JT,Noble EG.Regulation of survival gene hsp70 [J].Cell Stress Chaperones,2012,17(1):1-9.
[5]Chu S,Schubert ML.Gastric secretion[J].Curr Opin Gastroenterol,2012,28(6):587-593.
[6]Riepl RL,Drummer C,Lehnert P,et al.Influence of microgravity on plasma levels of gastroenteropancreatic peptides:a case study [J].Aviat Space Environ Med,2002,73(3):206-210.
[7]Zhang W,Li J,Han QL,et al.The study of the effects and mechanism on the quality of gastric ulcer healing in rats under simulated weightlessness[J].World Chinese Journal of Digestology,2011,19(27):2863-2868.张雯,李静,韩全利,等.模拟失重对大鼠实验性胃溃疡愈合的影响[J].世界华人消化杂志,2011,19(27):2863-2868.
[8]Palileo C,Kaunitz JD.Gastrointestinal defense mechanisms[J].Curr Opin Gastroenterol,2011,27(6):543-548.

