中国蓝藻植物的新记录属—拟甲色球藻
刘 洋 朱梦灵 徐 瑶 虞功亮 李仁辉
(中国科学院水生生物研究所, 武汉430072)
拟甲色球藻(Chroococcidiopsis)是 Geitler 在1933年建立的单细胞群体蓝藻, 在现代四目蓝藻分类系统中[1], 它属于色球藻目、异球藻科(Xenococaceae)。拟甲色球藻在全球分布广泛, 从南极的岩石缝隙到印度尼西亚的热泉, 以及世界各地的炎热沙漠或山洞中都曾发现过[2—6], 而且在热带的草原上发现它们存在于地衣共生系统中[7]。拟甲色球藻的一些种类能长期抗干旱和电离辐射[8], 为此美国国家航空航天局的一些科学家就希望通过研究使其成为火星的拓荒者。另外, 一些拟甲色球藻种类则生活在水体中, 包括淡水、海水、高盐度水体[9]。目前,国际上对拟甲色球藻的关注多集中在对荒漠等极端环境下的研究, 水体中也是以温泉为主的报道。我们最近在太湖进行蓝藻水华的调查和研究时, 发现了拟甲色球藻存在于太湖水体中, 通过对野外水体样品的分离培养, 获得了拟甲色球藻单种培养藻种。通过对野外样品以及单种培养藻种的形态观察和聚类分析, 确认为拟甲色球藻(Chroococcidiopsis)的藻种, 这是尚未在中国报道过的新记录属。
1 材料与方法
1.1 样品的采集
采集地点为地处于江苏省宜兴大浦镇附近的西太湖, 坐标为N31°06′8.70″E 120°0′5.90″, 用 25号筛绢制作的浮游生物网采集藻类样品。
1.2 藻种分离
用毛细管分离法: 将灭菌后的巴斯德吸管制作成毛细管(Pasteur Micropipette), 在解剖镜下挑取单个群体, 清洗6—8次后[10], 最后放入含有2 mL CT培养基[11]的24孔细胞培养板(无菌)中, 培养温度为25, ℃白色灯光为光源, 光照强度为25 µE/(m2·s),光照周期为12h∶12h (L∶D)。本研究使用的藻株编号为 CHAB1690, 藻种保存于中国科学院水生生物研究所有害藻类学科组藻种库。
1.3 形态观察和测量
藻细胞形态的观察使用Nikon eclipse 80i型光学显微镜, 外接数码相机(DS-Ri1)与台式计算机。数码拍照和数据测量通过其附带的图像分析软件NIS-Elements D 3.2实行。选取50个以上的藻体进行各项数据的测量统计。
1.4 16S rRNA基因序列测定和分子系统分析
对分离的藻株培养富集后, 进行DNA提取, 方法参考Lin,et al.[12]。用于扩增16S rDNA的引物为:27F1(5′-AGAGTTTTGATCCTGGCTCAG-3′)[13]和B23S (5′-CTTCGCCTCTGTGTGCCTAGGT-3′)[14],由上海英骏生物技术有限公司合成。PCR反应体系为 50 µL, 包含 200 mmol/L dNTP; 1.5 mmol/L MgCl2;1×bufferPCR缓冲液; 10 pmol引物; 1 UTaqDNA聚合酶。PCR反应条件为: 94℃预变性5min; 94℃变性30s, 55℃退火30s, 72℃延伸2min, 35个循环; 72℃延伸5min。PCR扩增产物用1%的琼脂糖凝胶电泳检测, 通过胶回收试剂盒回收(BioFlux), 克隆到载体pMD18-T上(Takara, Japan)。将克隆载体转入感受态细胞E.coliDH5α中, 菌液送北京华大基因科技有限公司进行双向测序, 测序后得到两段序列用BioEdit软件拼接。序列通过NCBI的BLAST进行比对, 并将获得序列和从GenBank数据库中下载的基因序列用Clustal X1.83软件进行对位排列。运用分子进化遗传分析软件 MEGA5.0基于 Kimura two-parameter模型构建邻接法关系树(NJ tree), 步展值(Bootstrap value)设为1000, 空位或缺失位点均当作配对删除(Pairwise deletion)处理, 以Gloeobacter violaceusPCC 7421 为外类群。
2 结果
2.1 拟甲色球藻属Chroococcidiopsis形态特征
拟甲色球藻属(Chroococcidiopsis)由 Geitler建立于 1933年, 现在的分类系统中隶属于蓝藻门(Cyanophyta)、蓝藻纲(Cyanophyceae)、色球藻目(Chroococcales)、异球藻科 (Xenococcaceae), 以温泉拟甲色球藻(Chroococcidiopsis thermalis)为模式种。本属目前共报道过13个种[1]。
单细胞或形成规则或不规则的球状群体。群体具有薄而坚实的无色胶被(图 1B中箭头所指, 子细胞逃逸后留下的胶被)。群体常常聚集成肉眼可见的片状。群体直径为31—57 μm, 平均直径为40 μm。细胞球形、半球形或类多边形, 直径4—10 μm, 平均直径为 6.5 μm, 细胞不规则分裂, 母细胞分裂出的子细胞通常大小形态各异(图1C箭头所指)。原生质体绿色, 无气囊。同一群体中的细胞尺寸大小不一, 排列紧密(图1)。
有些细胞之后会变成内生孢子(或者某个群体中的部分细胞), 不同种类, 其内生孢子数量不同。绝大部分拟甲色球藻的内生孢子无运动特征, 但偶有出现, 且运行型内生孢子的出现取决于环境因子。分裂后的细胞或单细胞会从裂开的胶被中释放出来, 群体胶被通常透明。
2.2 分子系统分析
利用上述引物扩增 16S rRNA 基因, 获得了2127 bp的序列, GenBank号为 JX494785。但与GenBank藻株序列进行比对处理后, 截取了最大可使用的 1182 bp构建系统树。 将测序结果和通过Blast比对得到的相似序列以及目前Genbank中已有的拟甲色球藻16S rRNA基因序列构建分子系统树(图2)。太湖的ChroococcidiopsisCHAB1690藻株同两株欧洲的Chroococcidiopsis藻株(AJ344552和AJ344555)相似度很高(相似度均达到 99%), 从而聚在一起(图2)。而目前Genbank收集的拟甲色球藻种类在分子系统树上归属于两个类群(I和II), 太湖的藻株则聚在了类群 I, 该类群藻株的最低相似度为88%。另有少数藻株聚在了较远的另一个类群 II。两个类群的最低相似度为86%。
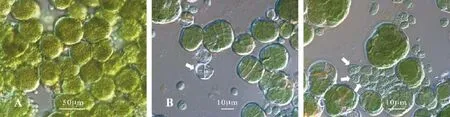
图1 显微镜下Chroococcidiopsis CHAB1690的形态Fig.1 Morphological image of Chroococcidiopsis CHAB1690
3 讨论
单细胞群体蓝藻异球藻科(Xenococcaceae)在以前五目蓝藻分类系统(色球藻目、厚皮藻目、颤藻目、念珠藻目和真枝藻目)中归属于厚皮藻目, 但是最近的蓝藻分类系统还是以四目系统为主流[1]。与拟甲色球藻属同属于异球藻科的还有另外 5个属(Chroococcidium、Myxosarcina、Xenococcus、Chroococcopsis、Xenotholos), 该属区别于其他藻属的特征是群体具有薄而坚固且清晰的胶鞘, 并且群体内的细胞不会出现排成一列的假丝形态或阶段[1]。中国拟甲色球藻虽然尚未得到详细描述, 但在个别文献中也有提及, 且在一些文献中被译为拟色球藻[15]。根据藻属拉丁名的词根含义,Chroococcopsis才是拟色球藻, 且已有资料可考[16]。从两属的形态特征比较来看, 拟甲色球藻属群体内的细胞不会出现成列细胞的假丝形态或阶段, 而在拟色球藻属(Chroococcopsis)藻株的群体中则会呈现出成列细胞扇形分布的现象[1]。拟甲色球藻属目前报道有13个种, 但详细描述的仅有 2个种,其中温泉拟甲色球藻(Chroococcidiopsis thermalis)为淡水种, 常在温泉中发现,Chroococcidiopsis fissurarum则生活在海水中。根据形态特征, 太湖的拟甲色球藻类似于温泉拟甲色球藻, 但是此太湖藻种的16S rRNA基因序列同温泉拟甲色球藻(Chroococcidiopsis thermalisPCC7203)的相似度仅为91%。而同本太湖藻种最为相似的两欧洲藻种并没有确定种名, 并且它们的形态特征也无法查阅。所以从生活习性和16S rRNA基因的序列来看, 此太湖的种类基本可以排除在Chroococcidiopsis thermalis和Chroococcidiopsis fissurarum之外, 但它是否为一新种, 还是其他的种类还需要大量的深入研究。总之, 以形态特征为界定的拟甲色球藻属并不是一个单系类群。分子系统学分析表明, 拟甲色球藻属的类群 I和类群II中藻株的最低相似度仅为86%, 而类群I内部中藻株的最低相似度也不到 90%。根据属内 16S rRNA序列相似度不低于 95%的原则[17,18], 这两个类群中的藻株可能不属于同一个属, 所以目前的拟甲色球藻属(Chroococcidiopsis)中可能包含了多个种。对拟甲色球藻属分类学的整理, 需要对此属的模式种类(Type species)和模式藻种(Type strain)的准确确定, 通过大量的多种特征的比较, 才能建立起一个自然的拟甲色球藻的分类系统, 为异球藻科分类系统的梳理提供条件。我们期待中国境内更多拟甲色球藻属的藻类的发现, 为其分类学和其他生物学的研究提供更多的材料。
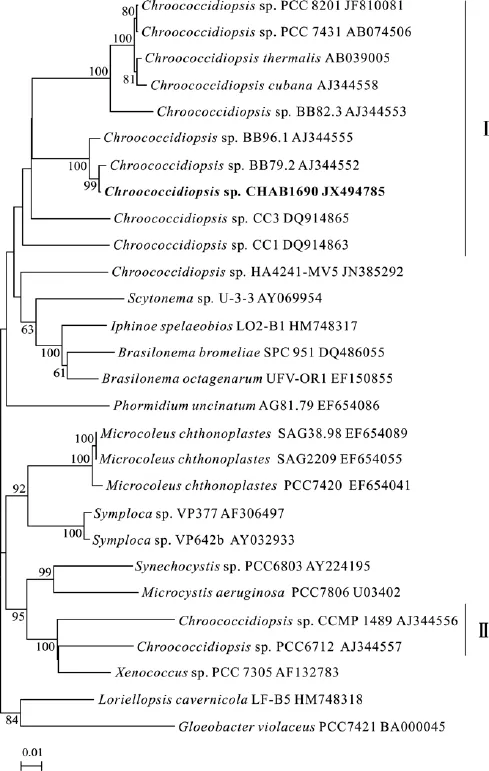
图2 基于16S rRNA基因序列的NJ分子系统树Fig.2 Phylogenetic tree (NJ) based on 16S rDNA sequences
[1] Komárek J, Anagnostidis K.Cyanoprokaryota-2.Teil: Oscillatoriales [M].Heifelberg: Elsevier GmbH.2005, 419—435
[2] Büdel B.Ecology and diversity of rock inhabiting cyanobacteria in tropical regions [J].EuropeanJournal of Phycology,1999, 34: 361—370
[3] Friedmann E I.The ecology of the atomphytic nitrate algaChroococcidiopsiskashaii Friedmann Studies on cave algae from Israel [J].Archiv fur Mikrobiologie, 1962, 42: 42—45
[4] Friedmann E I, Ocampo R.Endolithic blue-green algae in the dry valleys: Primary producers in the Antarctic desert ecosystem [J].Science, 1976, 193: 1247—1249
[5] Friedmann E I, Ocampo-Friedmann R.Endolithic Microorganisms in Extreme Dry Environments: Analysis of a Lithobiontic Microbial Habitat [M].In: M J Klug, C A Reddey(Eds.), Current Perspectives in Microbial Ecology.1984,177—185
[6] Geitler L.Diagnosen neuer Blaualgen von den Sunda-Inseln[J].Archiv fur Hydrobiologie,Supplementband, 1933, 8: 622
[7] Büdel B, Henssen A.Chroococcidiopsis(Cyanophyceae), a phycobiont in the lichen family Lichinaceae [J].Phycologia,1983, 22: 367—375
[8] Billi D, Friedmann E I, Hofer K G,et al.Ionizing-radiation resistance in the desiccation-tolerant cyanobacteriumChroococcidiopsis[J].Applied and Environment Microbiology,2000, 66: 1489—1492
[9] Dor I, Carl N, Baldinger I.Polymorphismand salinity tolerance as a criterion for differentiation of three new species ofChroococcidiopsis(Chroococcales) [J].Algological Studies,1991, 64: 411—421
[10] Watanabe M M, Hiroki M.NIES-collection: List of Strains,Microalgae and Protozoa [M].5th ed.Tsukuba: National Institute for Environmental Studies.1997, 140
[11] Yang L, Yu G L, Li R H.Eight newly recorded species of Anabaena Bory (Nostocaceae, Cyanophyta) from China [J].Acta Hydrobiologica Sinica, 2009, 33(5): 917—923 [杨丽,虞功亮, 李仁辉.中国鱼腥藻属的八个新记录种.水生生物学报, 2009, 33(5): 917—923]
[12] Lin S, Shen J, Liu Y,et al.Molecular evaluation on the distribution, diversity, and toxicity ofMicrocystis(Cyanobacteria) species from Lake Ulungur—a mesotrophic brackish desert lake in Xinjiang, China [J].Environmental Monitoring and Assessment, 2011, 175(1—4): 139—150
[13] Neilan B A, Jacobs D, Del Dot T,et al.rRNA sequences and evolutionary relationships among toxic and nontoxic cyanobacteria of the genusMicrocystis[J].International Journal of Systematic Bacteriolology, 1997, 47: 693—697
[14] Taton A, Grubisic S, Brambilla E,et al.Cyanobacterial diversity in natural and artificial microbial mats of Lake Fryxell (McMurado Dry Valleys, Antarctica): a morphological and molecular approach [J].Applied and Environment Microbiology, 2003, 69: 5157—5169
[15] Hu H J, Wei Y X.The Freshwater Algae of China.Systematics, Taxonomy, and Ecology [M].Beijing: Science Press.2006, 28 [胡鸿钧, 魏印心.中国淡水藻类——系统、分类及生态.北京: 科学出版社.2006, 28]
[16] Zeng C K, Bi L J.Aglossary of Terms and Names of Algae(2nd edition) [M].Beijing: Science Press.2005, 101 [曾呈奎,毕列爵.藻类名词及名称(第二版).北京: 科学出版社.2005, 101]
[17] Ludwig W, Strunk O, Klugbauer S,et al.Bacterial phylogeny based on comparative sequence analysis [J].Electrophoresis,1998, 19: 554—568
[18] Stackebrandt E, Goebel B M.A place for DNA–DNA reassociation and 16S ribosomal–RNA sequence–analysis in the present species definition in bacteriology [J].International Journal of Systematic and Evolutionary Microbiology, 1994,44: 846—849

