不同糖源及糖水平对大菱鲆糖代谢酶活性的影响
聂 琴 苗惠君 苗淑彦 陈尘悦李 静 张文兵 麦康森
(1.中国海洋大学水产动物营养与饲料农业部重点实验室, 海水养殖教育部重点实验室, 青岛 266003;2.中国石油大学(华东)生物技术与生物工程中心, 青岛 266580)
水产饲料中适当提高糖水平可以起到节约蛋白质、降低饲料成本、减少氨和氮的排泄、减轻水体污染的作用[1,2]。与大多数哺乳动物是以葡萄糖为主要的能量来源不同, 鱼类对饲料中糖的利用率较差,特别是一些肉食性鱼类, 饲喂富含糖的饲料后会出现持久的高血糖现象[3]。虽然研究已证明鱼体内存在利用糖的一系列酶和代谢途径[4], 但鱼类对糖利用能力低下的机制尚不完全清楚。糖分子结构是影响鱼类对饲料中糖的利用的因素之一[1,5—7], 一般而言, 鱼类对多糖和寡糖的利用要好于单糖和二糖[8—14]。可能原因是单糖易于消化吸收, 促使血糖含量迅速升高, 而鱼体内的糖代谢酶活力尚未充分增加, 导致鱼体对糖的分解和转化滞后, 降低了鱼体对糖的利用[15]。但在大鳞大麻哈鱼(Onchorhynchus tshawytscha)、虹鳟(Oncorhynchus mykiss)、白鲟(Acipenser transmontanus)、草鱼(Ctenopharyngodon idella)和金头鲷(Sparus aurata)中的研究结果表明,这些鱼类对葡萄糖或麦芽糖的利用能力好于糊精或淀粉[16—21]。不同鱼类对饲料中糖的利用能力也存在差异, 研究证明金头鲷摄食添加 20%糊化淀粉的饲料后, 其生长不受影响; 当淀粉水平进一步增加时, 则生长减缓、摄食率下降[22]。在饲料中添加10%或 20%的生淀粉或糊化淀粉时, 欧洲海鲈(Dicentrarchus labrax)的生长和饲料利用率与不含糖对照组均无显著差异[23]。在印度野鲮(Labeo rohita)幼鱼饲料中添加 43%的淀粉(生淀粉∶糊化淀粉 = 80∶20)时, 仍然有显著促进生长和提高蛋白质利用率的效果[24]。一般认为, 草食性和杂食性鱼类比肉食性鱼类对糖的利用能力强, 淡水、温水性鱼类比海水、冷水性鱼类利用糖的能力强, 海水、冷水性鱼类饲料的适宜糖水平应低于20%[3]。
大菱鲆(Scophthalmus maximusL.)属鲆科(Bothidae), 菱鲆属(Scophthalmus), 原产于欧洲北海、波罗的海、地中海等海域, 属冷水性鱼类。我国从1992年引进至今, 已形成一定规模的大菱鲆养殖, 尤其是在北方的养殖, 创造了巨大的经济效益和社会效益[25]。大菱鲆摄食习性为肉食性。迄今, 关于大菱鲆配合饲料中糖适宜添加量的报道较少, 且由于实验用大菱鲆的生长阶段、实验方法的不同,结果存在差异。李晓宁等[26]研究表明大菱鲆幼鱼[(4.30 ± 0.01) g]饲料中糖的适宜含量为15.0%或更低, 而中鱼[(89.57 ± 0.32) g]和大鱼[(208.30 ± 0.29)g]阶段饲料中糖含量可达25.5%。但马爱军等[6]认为大菱鲆幼鱼(27 g)对糖的需求量仅为4%。上述研究都未从糖代谢酶的角度进一步探讨大菱鲆的糖代谢,也没有系统研究糖源和糖水平的交互作用对大菱鲆糖代谢的影响。本研究拟通过在饲料中添加不同糖源及糖水平, 分析两者对大菱鲆糖代谢酶活性的影响, 为探讨大菱鲆幼鱼对不同糖源的利用差异, 为确定其饲料糖的适宜添加量提供基础数据。
1 材料与方法
1.1 饲料配方与制作
本研究设计为3 × 4的双因素实验, 即3种糖源(葡萄糖、蔗糖和糊精)和 4个糖水平(0、5%、15%和28%)。以白鱼粉、酪蛋白、明胶为蛋白源, 鱼油、大豆卵磷脂为主要脂肪源配制等氮等能的实验饲料。其中, 一种为不添加糖的饲料(Diet 1), 其他饲料组分别添加5%、15%、28%的葡萄糖(Diet 2、Diet 3、Diet 4)、蔗糖(Diet 5、Diet 6、Diet 7)、糊精(Diet 8、Diet 9、Diet 10), 共10种实验饲料。饲料原料先粉碎, 并过80目筛。将粉碎好的原料按饲料配方逐级放大混合, 再加入大豆卵磷脂和鱼油, 手工搓油,并在高效混合机(0.5-V型, 上海天祥健台制药机械有限公司)中混匀后, 加入30%左右的蒸馏水揉成软面团, 用制粒机(EL-260, 山东威海友谊机械厂)挤压出直径为1.5 mm的颗粒饲料。饲料在恒温50℃下干燥 12h, 烘干后存于−20℃的冰柜中待用。饲料配方及成分分析(表1)。
1.2 养殖过程与管理
养殖实验在中国海洋大学鳌山卫实验基地流水式养殖系统中进行, 实验用大菱鲆为青岛胶南市古镇营村养殖厂人工培育的同一批苗种。在正式实验前, 用商品饲料(青岛七好生物科技有限公司)饱食驯养 2周, 以适应养殖环境。饥饿 24h后分组, 平均初始体重为(8.06 ± 0.08) g, 每个玻璃钢桶(500 L)放养28尾大菱鲆, 每个饲料处理设 3个重复。养殖实验持续9周, 每天07: 00和18: 00分别进行1次饱食投喂。实验所用海水经沉淀、沙滤后进入养殖系统, 实验期间水温(19 ± 1), pH℃为 7.7 ± 0.1, 盐度(25.2 ± 1.0)‰, 溶氧含量 ≥ 7.0 mg/L。
1.3 样品收集与分析
在实验结束时, 实验鱼饥饿 24h, 每桶随机选取 3尾, 解剖分离出肝脏, 液氮速冻后保存样品于−80℃冰箱用于酶活性分析。
饲料常规成分测定: 水分采用恒温干燥法(105), ℃粗蛋白用凯氏定氮法(N × 6.25), 粗脂肪用索氏抽提法, 灰分用马弗炉灰化法(550), ℃总能用氧弹仪(Parr 6100, USA)测定。实验饲料中糖含量以饲料中可利用糖含量计量, 采用蒽酮比色法测定[27]。
大菱鲆肝脏己糖激酶(HK)和丙酮酸激酶(PK)采用试剂盒测定(南京建成生物工程研究所)。葡萄糖激酶(GK)、磷酸果糖激酶(PFK)、磷酸烯醇式丙酮酸羧激酶(PEPCK)、1, 6 - 二磷酸果糖酶(FBPase)的活性采用Polakof,et al.[28]方法: 取0.5 g肝脏, 在4℃下, 加入10倍缓冲液匀浆, 缓冲液参照文献 [28]配制。匀浆液于10000 r/min离心30min后, 取上清, 在30℃、用酶标仪(Thermo Scientific Multiskan Spectrum, USA)340 nm波长下完成测定。肝脏匀浆上清液蛋白质含量采用 Bradford法测定, 以牛血清蛋白为标准蛋白[29]。酶的活性表示为: 在 30℃条件下,每毫克蛋白每分钟水解 1 μmol 底物为 1个活力单位U。
1.4 计算及统计方法
数据用平均值±标准误(X±SE)表示, 采用SPSS 17.0 分析软件对实验数据进行双因素方差分析(Two-way ANOVA)。当差异显著(P< 0.05)时, 用Duncan 检验进行多重比较分析[30]。
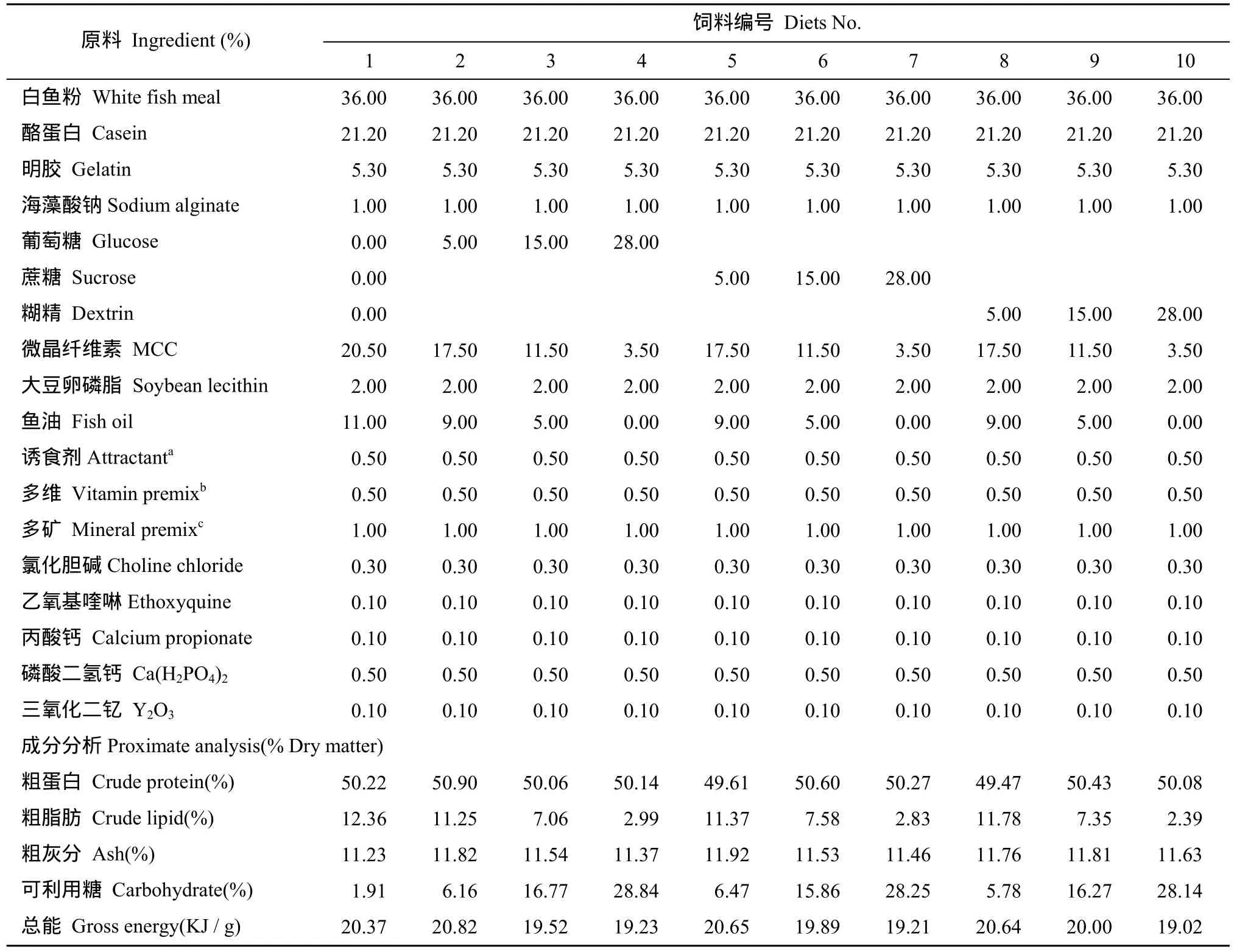
表1 实验饲料配方及营养组成Tab.1 Formulation and proximate composition of the experimental diets
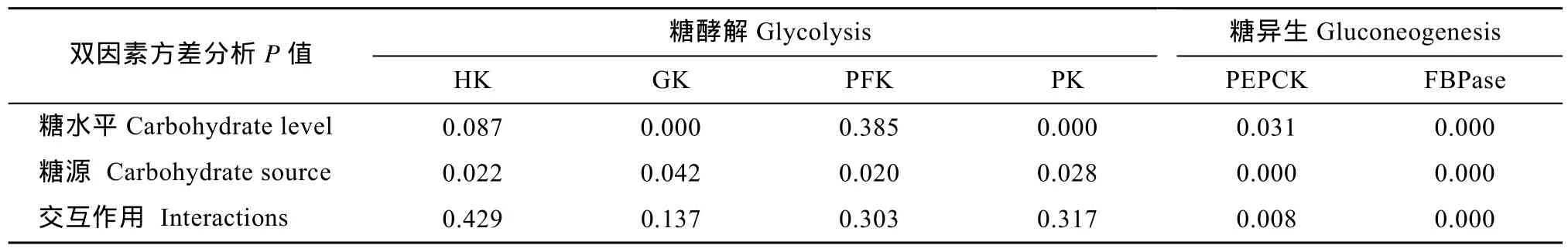
表2 不同糖源及糖水平对大菱鲆肝脏糖酵解和糖异生酶活性的影响Tab.2 Effects of dietary carbohydrate sources and levels on the activities of glycolytic and gluconeogenetic enzymes in the liver of turbot
2 结果
2.1 不同糖源及糖水平对大菱鲆肝脏糖酵解酶活性的影响
大菱鲆肝脏中HK活性不受饲料中糖水平的显著影响(P> 0.05, 表2), 但不同糖源对HK活性的影响显著(P< 0.05)。当饲料中糖添加量为28%时, 葡萄糖组HK活性显著高于糊精组, 蔗糖组HK活性与葡糖糖组和糊精组之间均没有显著差异(图 1A); 在其他糖水平下, 糖源对HK活性的影响均不显著。
大菱鲆肝脏中GK活性受饲料中糖源及水平的显著影响(P< 0.05), 但糖源和糖水平的交互作用不显著(P> 0.05)。在葡萄糖组中, 和对照组相比, GK活性随葡萄糖水平的升高呈增加趋势, 当葡萄糖添加量为15%和28%时GK活性都显著高于对照组(P<0.05)。在蔗糖组中, 蔗糖含量的增加促进GK活性,但仅在添加量为 28%时 GK活性显著高于对照组(P<0.05)。在糊精组中, 糊精添加量为15%时GK活性显著高于对照组和添加量为 5%组(P<0.05), 但与添加量为28%组无显著差异(图1B)。当饲料中糖添加量为 28%时, 葡萄糖组和蔗糖组 GK活性显著高于糊精组(图 1C); 在其他糖水平下, 糖源对 GK活性的影响均不显著。
大菱鲆肝脏中PFK活性没有受到饲料中糖水平的显著影响(P>0.05), 但不同糖源对 PFK活性的影响显著(P<0.05)。当饲料中糖添加量为28%时, 蔗糖组PFK活性显著高于糊精组, 葡萄糖组PFK活性与糊精组和蔗糖组之间无差异(图 1D); 在其他糖水平下, 糖源对PFK活性的影响均不显著。
大菱鲆肝脏中 PK活性受饲料中糖源及糖水平的显著影响(P<0.05), 但糖源和糖水平的交互作用不显著(P>0.05)。在葡萄糖组中, 当葡萄糖添加量为15%时, PK活性为最高(40.44 ± 3.47) mU/mg且显著高于对照组(P<0.05)。在糊精组中, PK活性呈先升高后降低趋势, 当糊精添加量为5%时, PK活性显著高于对照组和含糊精 28%组(P<0.05), 但与含糊精15%组无显著差异。在蔗糖组中, PK活性不受蔗糖水平的影响(P>0.05)(图 1E)。当饲料中糖添加量为15%时, PK活性在葡萄糖组显著高于蔗糖组(P<0.05), 但与糊精组无差异(图 1F); 在其他糖水平下,糖源对PK活性的影响均不显著。
2.2 不同糖源及糖水平对大菱鲆肝脏糖异生酶活性的影响
饲料中糖源及糖水平均显著影响大菱鲆肝脏中PEPCK的活性(P<0.05), 且交互作用显著(P<0.05)。在糊精组中, PEPCK呈先显著降低后升高再降低的波动趋势, 对照组(28.23 ± 1.17) mU/mg和含糊精15%组(23.53 ± 3.81) mU/mg的PEPCK显著高于含糊精5%组(11.75 ± 1.13) mU/mg(P<0.05), 同时对照组的PEPCK活性也显著高于含糊精28%组(16.82 ±2.35) mU/mg(P<0.05), 而含糊精 15%和 28%组PEPCK活性无显著差异; 饲料葡萄糖或蔗糖水平都不影响 PEPCK的活性(图 2A)。当饲料中糖添加量为5%时, 葡萄糖组和蔗糖组PEPCK活性显著高于糊精组(P<0.05); 当饲料中糖添加量为28%时, 蔗糖组 PEPCK活性显著高于葡萄糖组和糊精组(P<0.05); 在其他糖水平下, 糖源对PEPCK活性无显著影响(图 2B)。
饲料中糖源及糖水平均显著影响大菱鲆肝脏中FBPase的活性(P<0.05), 且交互作用显著(P<0.05)。在葡萄糖组中, FBPase活性先增加后降低, 当葡萄糖添加量为5%时, FBPase活性显著高于其他组(P<0.05); 在糊精组中, 对照组的FBPase活性显著高于其他 3组(P<0.05); 在蔗糖组中, 蔗糖水平不影响FBPase活性(图2C)。当饲料中糖添加量为5%时, 葡萄糖组的 FBPase活性显著高于蔗糖和糊精组(P<0.05); 当饲料中糖添加量为 15%时, 葡萄糖组的FBPase活性显著高于糊精组(P<0.05), 但与蔗糖组无差异; 在其他糖水平下, 糖源对FBPase活性无显著影响(图2D)。
3 讨论
糖酵解与糖异生在生理功能上分别是糖的分解与糖的合成, 前者能在鱼体摄入过多糖分时降解血糖, 避免血糖高造成的生理负担; 后者则是在鱼体血糖降低时合成葡萄糖, 维持血糖内稳态, 鱼体需要二者的共同调节才能正常地分解和转化糖分[31]。与哺乳动物糖代谢机制类似, 调节鱼类糖酵解的关键酶为己糖激酶(HK)、葡萄糖激酶(GK)、磷酸果糖激酶(PFK)、丙酮酸激酶(PK), 调节糖异生的关键酶为磷酸烯醇式丙酮酸羧激酶(PEPCK)、1, 6-二磷酸果糖酶(FBPase)、葡萄糖-6-磷酸酶(G6Pase)。饲料添加不同糖源及水平对大菱鲆 G6Pase活性的影响将在后续实验中展开研究。
3.1 不同糖源及糖水平对大菱鲆糖酵解酶活性的影响
在欧洲海鲈、虹鳟、鲤鱼(Cyprinus carpio)、草鱼和金头鲷等鱼类中已证实了 GK的存在, 且在肝脏中活性最高, 并随饲料糖水平的增加而显著升高[8,19,23,32,33]。本研究也发现, 饲料中葡萄糖、蔗糖、糊精添加量与大菱鲆肝脏 GK活性呈正相关, 支持上述观点。但当饲料葡萄糖或糊精添加量从15%增加至28%时, GK值不再增加或有降低趋势, 推测可能是大菱鲆肝脏 GK对糖的适应能力有限, 添加15%的葡萄糖或糊精已促进GK活性达到饱和状态。欧洲海鲈的 GK活性随饲料淀粉含量的变化亦有相似的趋势[34]。不同糖源对鱼类GK活性的诱导能力也存在差异, 与分子量较大的糖类相比, 分子量较小的糖类更能促进鱼体内GK活性的增高。Enes,et al.[7]研究发现, 在饲料中添加 20%的葡萄糖、麦芽糖、糊精、淀粉后金头鲷体内GK活性在葡萄糖组和麦芽糖组最高。饲料添加葡萄糖对欧洲海鲈 GK活性的诱导作用较淀粉明显[8]。在本研究中, 糖添加水平为28%时, 葡萄糖组、蔗糖组对大菱鲆体内GK的诱导作用显著高于糊精组, 支持上述观点。
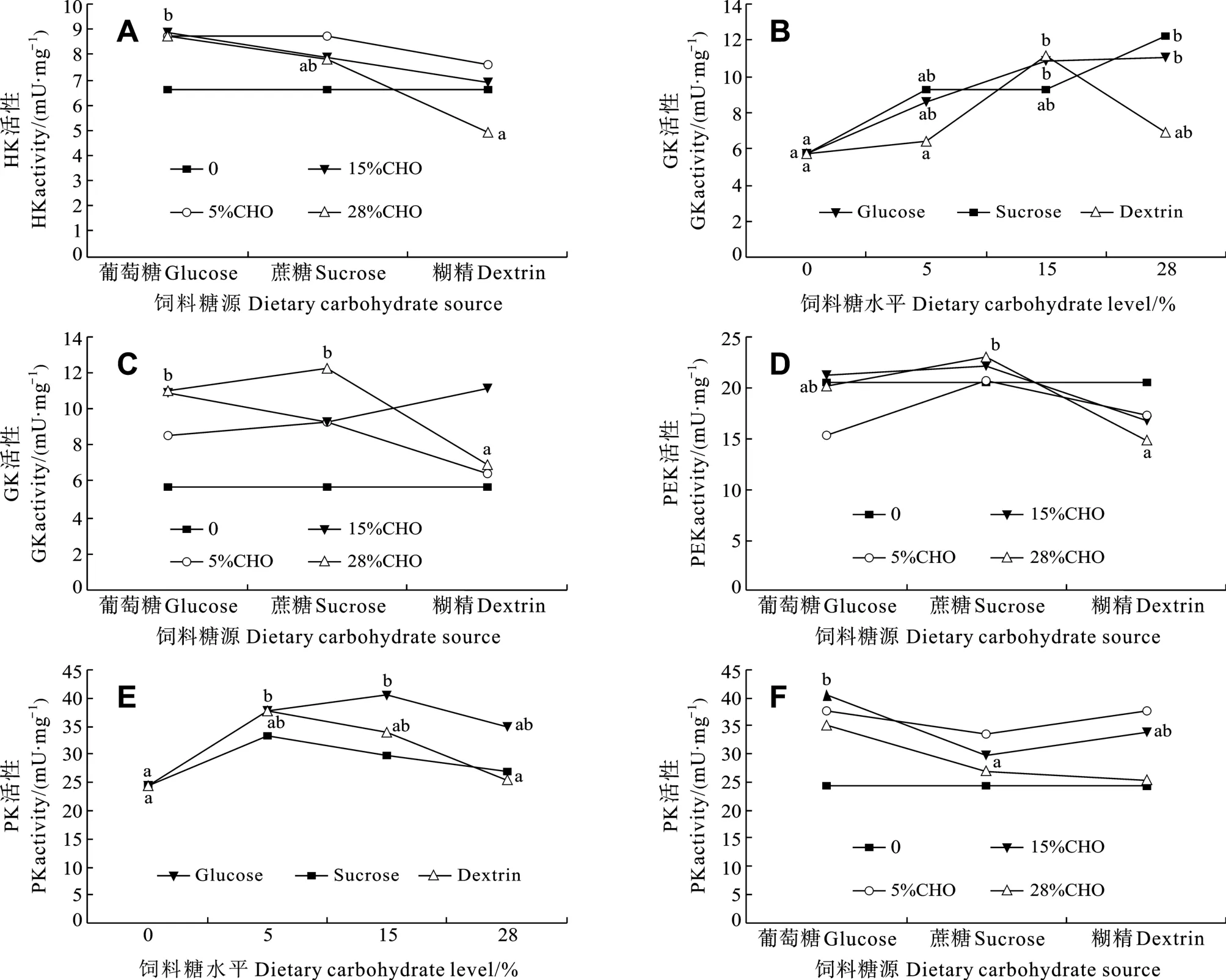
图1 饲料中不同糖源及糖水平对大菱鲆肝脏中己糖激酶(HK)、葡萄糖激酶(GK)、磷酸果糖激酶(PFK)和丙酮酸激酶(PK)活性的影响Fig.1 Effects of dietary carbohydrate sources and levels on activities of hexokinase (HK), glucokinase (GK), 6-phosphofructokinase-1(PFK) and pyruvate kinase (PK) in the liver of turbot
有关 PK的研究表明, 高糖饲料能诱导鱼类肝脏 PK的活性增加[1,2,23,35]。饲料中糖源为葡萄糖或糊精时, 大菱鲆体内 PK活性随葡萄糖或糊精水平增加而升高, 当葡萄糖添加量为 15%或糊精水平为5%时, PK活性呈最大值并显著高于对照组。但随葡萄糖或糊精水平的进一步增加, PK出现了类似GK在高糖情况下(添加量为 28%)活性降低的变化, 这也与Meton,et al.[1]研究不同水平淀粉对金头鲷PK活性的影响时变化趋势一致。同时, 大菱鲆肝脏PK活性也受饲料中糖源的显著影响, 当糖添加量为15%时, 葡萄糖组PK活性显著高于蔗糖组, 但与糊精组无显著差异。Enes,et al.发现, 金头鲷PK活性不受饲料添加20%葡萄糖、麦芽糖或糊精的影响[6],但欧洲海鲈摄食含20%糖的饲料后PK活性在葡萄糖组显著高于淀粉组[8]。产生这种差异的原因是否是由于物种的不同或实验条件差异, 导致对 PK活性的影响不同, 有待于进一步证实。
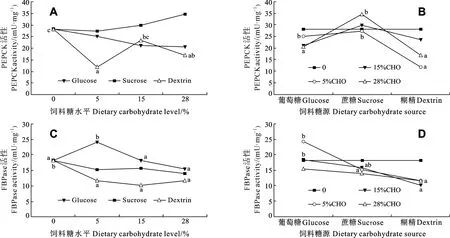
图2 饲料中不同糖源及水平对大菱鲆中肝脏中磷酸烯醇式丙酮酸羧激酶(PEPCK)和1,6-二磷酸果糖酶(FBPase)活性的影响Fig.2 Effects of dietary carbohydrate sources and levels on activities of phosphoenolpyruvate carboxykinase (PEPCK) and fructose-1,6-bisphosphatase (FBPase) in the liver of turbot
在大菱鲆肝脏糖酵解途径中, HK和PFK不受饲料中糖水平的显著影响, 即HK和PFK活性不受饲料糖含量的诱导, 这分别与在欧洲海鲈[8,23,34]、金头鲷[22]、虹鳟[36]和南方鲇(Silurus meridionalisChen)[31]等中的研究结果一致。相比之下, GK和PK受糖源和糖水平的显著影响, 显示GK和PK是决定大菱鲆肝脏糖酵解能力的两个重要因素。在饲料糖水平低于 15%时, 大菱鲆的糖酵解能力随之出现适应性的增强, 这也合理解释了大菱鲆肝糖原含量随饲料糖水平增加而增加这一结果(未发表数据)。但饲料糖含量继续增加至 28%时, 大菱鲆肝脏的糖酵解能力没有继续增强, 反而有下降的趋势。在研究糖源和糖水平对大菱鲆生长的影响时也发现, 饲料含较低水平的糖时不影响大菱鲆的生长, 但高水平的糖(添加量为 28%)导致大菱鲆特定生长率显著降低(未发表数据)。这表明了大菱鲆对饲料糖水平的适应能力有限, 饲料添加 15%的糖可能已达到了大菱鲆机体代谢利用糖的最大限度。比较3种糖源对大菱鲆糖酵解的促进作用, 葡萄糖的促进作用最强,糊精次之。
3.2 不同糖源和糖水平对大菱鲆糖异生酶活性的影响
本研究发现, 在大菱鲆的糖异生途径中,PEPCK和FBPase两种酶都受饲料糖源及水平的显著影响, 且交互作用显著。当饲料添加葡萄糖或蔗糖时, PEPCK活性不受影响。在糊精组中, 随饲料糊精水平的增加, PEPCK活性虽有波动变化, 但整体呈下降的趋势。戈贤平等[37]鲌对翘嘴红 (Eryghroculter ilishaeformis)摄食添加不同水平淀粉的饲料后 12h取样分析表明, 中糖组(14.45%)、高糖组(23.98%)比无糖组显著降低了 PEPCK活性, 与本研究结果一致。但Kirchner,et al.[38]研究认为虹鳟摄食含20%糊精的饲料后 PEPCK的活性和基因表达量与无糖对照组之间均无显著差异。同时, 本研究还发现在葡萄糖组中, FBPase活性仅随饲料中添加低水平葡萄糖(5%)的诱导而升高, 但葡萄糖水平进一步增加时, FBPase活性与不含糖的对照组之间无显著差异。在糊精组中, FBPase活性则受到饲料添加糊精的显著抑制。Panserat,et al.[39]研究发现金头鲷摄食含20%糖的饲料后, FBPase基因表达水平显著低于摄食不含糖的饲料, 即饲料含较高水平的糖时显著抑制了FBPase的基因表达。但Kirchner,et al.[38]研究认为虹鳟的 FBPase活性和基因表达量在摄食含 20%糊精和不含糖的饲料之间无显著差异, 并认为虹鳟体内的葡萄糖稳态失衡可能与糖异生酶活性或基因表达不受饲料糖含量的调节有关。在本研究中大菱鲆肝脏糖异生关键酶PEPCK和FBPase活性受饲料添加糊精的抑制, 这一结果说明了其体内可能存在较为完善的糖异生调节机制。但同时, 本研究所采用的实验饲料为等氮等能设计, 因此在饲料糖水平增加时脂肪含量随之降低。Panserat,et al.[40]报道含高脂肪(25%)的饲料显著促进了虹鳟肝脏G6Pase基因表达和酶活性, 但对PEPCK和FBPase基因表达并无影响。这表明饲料中脂肪含量的变化在一定程度上也影响了鱼体的糖异生能力, 这是否也是本研究中PEPCK和FBPase活性变化的一个影响因素, 有待于进一步研究。
综上所述, 饲料添加 15%的葡萄糖或糊精时,可以有效促进大菱鲆肝脏糖酵解酶的活性, 同时低水平的葡萄糖促进糖异生酶活性; 糊精在促进糖酵解的同时对糖异生作用存在一定程度的抑制。在本实验条件下, 较添加其他糖源或糖水平, 饲料添加15%的糊精更有利于维系大菱鲆机体内葡萄糖的动态平衡。
[1] Meton I, Mediavilla D, Caseras A,et al.Effect of diet composition and ration size on key enzyme activities of glycolysis-gluconeogenesis, the pentose phosphate pathway and amino acid metabolism in liver of gilthead sea bream (Sparus aurata) [J].British Journal of Nutrition, 1999, 82:223—232
[2] Fernández F, Anna G M, Córdoba M,et al.Effects of diets with distinct protein-to-carbohydrate ratios on nutrient digestibility, growth performance, body composition and liver intermediary enzyme activities in gilthead sea bream(Sparus aurataL.)fingerlings [J].Journal of Experimental Marine Biology and Ecology, 2007, 343: 1—10
[3] Wilson R P.Utilization of dietary carbohydrate by fish [J].Aquaculture, 1994, 124: 67—80
[4] Dabrowski K, Guderley H.Intermediary metabolism [A].In:Halver J E, Hardy R W (Eds.), Fish Nutrition, 3rd edn [C].Academic Press, London.2002, 309—365
[5] Aikins K F, Hung S S O, Hughes S G,et al.Effects of feeding a high level of D-glucose on liver function in juvenile white sturgeon(Acipenser transmontanus) [J].Fish Physiology and Biochemistry, 1993, 12(4): 317—325
[6] Ma A J, Chen S Q, Lei J L,et al.Influences of the main energy matter in feed on the growth of young turbot,Scophthalmus maximus[J].Oceanologia Etlimnologia Sinica,2001, 32(5): 527—533 [马爱军, 陈四清, 雷霁霖, 等.饲料中主要能量物质对大菱鲆幼鱼生长的影响.海洋与湖沼, 2001, 32(5): 527—533]
[7] Enes P, Peres H, Couto A,et al.Growth performance and metabolic utilization of diets including starch, dextrin, maltose or glucose as carbohydrate source by gilthead sea bream(Sparus aurata) juveniles [J].Fish Physiology and Biochemistry, 2010, 36: 903—910
[8] Enes P, Panserat S, Kaushik S,et al.Rapid metabolic adaptation in European sea bass (Dicentrarchus labrax) juveniles fed different carbohydrate sources after heat shock stress [J].Comparative Biochemistry and Physiology,Part A, 2006,145: 73—81
[9] Lin J H, Shiau S Y.Hepatic enzyme adaptation to different dietary carbohydrates in juvenile tilapiaOreochromis niloticus × O.aureus[J].Fish Physiology and Biochemistry, 1995,14(2): 165—170
[10] Shiau S Y, Lin Y H.Utilization of glucose and starch by the grouperEpinephelus malabaricusat 23°C [J].Fisheries Science, 2002, 68: 991—995
[11] Shikata T, Iwanaga S, Shimeno S.Effects of dietary glucose,fructose, and galactose on hepatopancreatic enzyme activities and body composition in carp [J].Fisheries Science, 1994,60(5): 613—617
[12] Shiau S Y, Peng C Y.Protein-sparing effect by carbohydrates in diets for tilapia,Oreochromis niloticus×O.aureus[J].Aquaculture, 1993, 117: 327—334
[13] Lee S M, Kim K D, Lall S P.Utilization of glucose, maltose,dextrin and cellulose by juvenile flounder (Paralichthys olivaceus) [J].Aquaculture, 2003, 221: 427—438
[14] Tan Q, Xie S Q, Zhu X,et al.Effect of dietary carbohydrate sources on growth performance and utilization for gibel carp(Carassius auratus gibelio) and Chinese longsnout catfish(Leiocassis longirostrisGünther) [J].Aquaculture Nutrition,2006, 12: 61—70
[15] Panserat S, Capilla E, Gutierrez J,et al.Glucokinase is highly induced and glucose-6-phosphatase poorly repressed in liver of rainbow trout (Oncorhynchus mykiss) by a single meal with glucose [J].Comparative Biochemistry and Physiology,Part B, 2001, 128: 275—283
[16] Bergot F.Carbohydrate in rainbow trout diets: effects of the level and source of carbohydrate and the number of meals on growth and body composition [J].Aquaculture, 1979, 18:157—167
[17] Buhler D R, Halver J E.Nutrition of salmonid fishes [J].The Journal of Nutrition, 1961, 74: 307—318
[18] Hung S S O, Storebakken T.Carbohydrate Utilization by Rainbow Trout Is Affected by Feeding Strategy [J].Journal of Nutrition, 1994, 124: 223—230
[19] Enes P, Panserat S, Kaushik S,et al.Hepatic glucokinase and glucose-6-phosphatase responses to dietary glucose and starch in gilthead sea bream (Sparus aurata) juveniles reared at two temperatures [J].Comparative Biochemistry and Physiology,Part A, 2008, 149: 80—86
[20] Hung S S O, Fynn A K, Lutes P,et al.Ability of juvenile white sturgeon (Acipenser transmontanus) to different carbohydrate sources [J].Journal of Nutrition, 1989, 119:727— 733
[21] Tian L X, Liu Y J, Hung S S O.Utilization of glucose and corn starch by juvenile grass carp [J].North American Journal of Aquaculture, 2004, 66: 141—145
[22] Couto A, Enes P, Peres H,et al.Effect of water temperature and dietary starch on growth and metabolic utilization of diets in gilthead sea bream (Sparus aurata) juveniles [J].Comparative Biochemistry and Physiology,Part A,2008,151: 45—50
[23] Enes P, Panserat S, Kaushik S.Effect of normal and waxy maize starch on growth, food utilization and hepatic glucose metabolism in European sea bass (Dicentrarchus labrax) juveniles [J].Comparative Biochemistry and Physiology,Part A, 2006, 143: 89 —96
[24] Kumar V, Sahu N P, Pal A K,et al.Modulation of key enzymes of glycolysis, gluconeogenesis, amino acid catabolism,and TCA cycle of the tropical freshwater fi shLabeo rohitafed gelatinized and non-gelatinized starch diet [J].Fish Physiology and Biochemistry, 2010, 36: 491—499
[25] Hanson R W, Reshef L.Regulation of phosphoenolpyruvate carboxykinase (GTP) gene expression [J].Annual Review of Biochemistry, 1997, 66: 581—611
[26] Li X N.Effects of dietary carbohydrate levels on growth performance, physiological status and body composition of turbot (Scophthalmus maximusL) and Japanese flounder(Paralichthys olivaceus) [D].Thesis for Master of Science.Ocean University of China, Qingdao.2011 [李晓宁.饲料糖水平对大菱鲆和牙鲆生长、生理状态参数及体组成的影响.硕士学位论文, 中国海洋大学.青岛.2011]
[27] He J H.Analyse and Check of Feedstuff [M].Beijing: China Agricultural Press.2005, 47 [贺建华.饲料分析与检测.北京: 中国农业出版社.2005, 47]
[28] Polakof S, Míguez J M, Soengas J L.Dietary carbohydrates induce changes in glucosensing capacity and food intake of rainbow trout [J].American Journal of Physiology Regulatory Integrative and Comparative Physiology, 2008, 295:478—489
[29] Bradford M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle dye binding [J].Analytical Biochemistry, 1976, 72: 248—254
[30] Hamid N K A, Mahayat M, Hashim R.Utilization of different carbohydrate sources and starch forms by bagrid catfish(Mystus nemurus) (Cuv&Val) [J].Aquaculture Nutrition,2011, 17: 10—18
[31] Lin X Z, Luo Y P, Xie X J.Effects of dietary carbohydrate level on glycolytic enzymes and serum glucose concentrations in the juvenile southern catfish,Silurus meridionalisChen after feeding [J].Acta Hydrobiologica Sinica, 2006,30(3): 304—310 [林小植, 罗毅平, 谢小军.饲料碳水化合物水平对南方鲇幼鱼餐后糖酵解酶活性及血糖浓度的影响.水生生物学报, 2006, 30(3): 304—310]
[32] Panserat S, Medale F, Blin C,et al.Hepatic glucokinase is induced by dietary carbohydrates in rainbow trout, gilthead sea bream, and common carp [J].American Journal of Physiology Regulatory Integrative and Comparative Physiology, 2000, 278: 1164—1170
[33] Zhang S L, Ai Q H, Xu W,et al.Effects of dietary carbohydrate to lipid ratio on growth, feed utilization, plasma glucose and glycolytic enzyme activities of juvenile darkbarbel catfish,Pelteobagrus vachelli[J].Acta Hydrobiologica Sinica, 2012, 36(3): 466-473 [张世亮, 艾庆辉, 徐玮, 等.饲料中糖/脂肪比例对瓦氏黄颡鱼生长、饲料利用、血糖水平和肝脏糖酵解酶活力的影响.水生生物学报, 2012,36(3): 466-473]
[34] Moreira I S, Peres H, Couto A,et al.Temperature and dietary carbohydrate level effects on performance and metabolic utilisation of diets in European sea bass (Dicentrarchus labrax)juveniles [J].Aquaculture, 2008, 274: 153—160
[35] Borrebaek B, Christophersen B.Hepatic glucose phosphorylating activities in perch (Perca fluviatilis) after different dietary treatments [J].Comparative Biochemistry and Physiology,Part B, 2000, 125: 387—393
[36] Panserat S, Médale F, Brèque J E,et al.Lack of significant long-term effect of dietary carbohydrates on hepatic glucose-6-phosphatase expression in rainbow trout (Oncorhynchus mykiss) [J].The Journal of Nutritional Biochemistry, 2000,11: 22—29
[37] Ge X P.Effects of different carbohydrate and lipid levels in diets on carbohydrate metabolic enzymes in Topmouth Culter (Eryghroculter ilishaeformisbleeker) [D].Thesis for Doctor of Science.Nanjing Agricultural University, Nanjing.2006 [戈贤平.不 同糖、脂含量日粮对翘嘴红鲌 相关糖代谢酶的调节研究.博士学位论文, 南京农业大学, 南京.2006]
[38] Kirchner S, Panserat S, Lim P L,et al.The role of hepatic,renal and intestinal gluconeogenic enzymes in glucose homeostasis of juvenile rainbow trout [J].Journal of Comparative Physiology B, 2008, 178: 429—438
[39] Panserat S, Plagnes-Juan E, Kaushik S.Gluconeogenic enzyme gene expression is decreased by dietary carbohydrates in common carp (Cyprinus carpio) and gilthead seabream(Sparus aurata) [J].Biochimica et Biophysica Acta, 2002,1579: 35—42
[40] Panserat S, Perrin A, Kaushik S.High dietary lipids induce liver glucose-6-phosphatase expression in rainbow trout(Oncorhynchus mykiss) [J].Biochemical and Molecular Action of Nutrients, 2002, 132(2): 137—141

