首发强迫障碍血清细胞因子水平与临床症状的相关性
吴义高江芹许平储照虎王瑞权黄慧兰
细胞因子不仅具有免疫调节作用,而且具有广泛的中枢调节作用,对神经递质的合成和代谢产生影响。近年研究表明,细胞因子的改变可能与精神障碍密切相关[1-3]。有文献报道细胞因子白细胞介素-1β(interleukin-1 beta,IL-1β)在相关脑区通过激活一氧化氮(nitric oxide,NO)减少多巴胺(dopamine,DA)的合成水平[4]。脑内白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)通过信号转导子、转录活化子等多种通路,激活吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO),阻断5-羟色胺(5-hydroxy tryptamine,5-HT)前体色氨酸的合成,减少5-HT生成[5]。强迫障碍(obsessive-compulsive disorder,OCD)DA增多、5-HT减少的发病机制假说[6]与此机制紧密相关。目前国外对OCD的精神免疫学研究表明,OCD与免疫系统改变有关[7]。但不同研究之间的结果不尽相同。国内对OCD与细胞因子相关性研究少见报道。本研究探讨首发OCD患者细胞因子水平变化及其与临床症状的相关性,为进一步了解OCD发病机制和治疗提供一些理论依据。
1 对象和方法
1.1 研究对象 2011年6月至2012年12月期间在皖南医学院弋矶山医院医学心理科门诊患者中招募OCD患者参加本研究。患者组入组标准:①符合《美国精神障碍诊断与统计手册第四版》(Diagnostic and Statistical Manual of Mental Disorders,Fourth Edition,DSM-IV)的强迫障碍诊断标准,且2位精神科医师(主治医师或以上职称)的诊断一致;②年龄18~55周岁;③耶鲁-布朗强迫量表(Yale-BrownObsessive-CompulsiveScale,YBOCS)总分≥16分;④首次发病,无缓解,发病后未用过任何精神药物或其他影响中枢神经系统功能的物质。排除标准:①存在强迫障碍以外其他符合DSM-IV轴I诊断的疾病;②有严重躯体疾病史,或者生化、血液、尿液检查结果异常者;③有精神病性症状或既往有精神障碍史;④半年内使用过免疫调节剂或激素制剂。共入组患者36例,其中男性21例,女性15例;年龄为18~55岁,平均年龄(26.00±9.70)岁;未婚23例,已婚13例;受教育年限 3~21年,平均(12.50±3.78)年;病程为3~18月,平均(9.58±4.57)月。
对照组为来自于本单位的工作人员、进修医师、学生等。入组标准:①无强迫障碍,Y-BOCS总分<7分;②年龄18~55周岁。排除标准与患者组相同。共收集36名对照,其中男性23名,女性13名;年龄为18~55岁,平均年龄(27.47±9.53)岁;已婚9名,未婚26名,离异1名;受教育年限6~21年,平均(12.97±3.57)年。
患者组与对照组的年龄(t=-0.649,P=0.518)、性别分布(χ2=0.234,P=0.629)、婚姻状况(χ2=0.575,P=0.448)和受教育年限(t=-0.546,P=0.587)差异均无统计学意义。
所有入组对象及家属均被告知此项研究的获益及风险情况,均签署知情同意书。本研究经皖南医学院弋矶山医院伦理委员会审批批准。
1.2 研究方法
1.2.1 测定血清细胞因子 研究组与对照组入组时于早晨7~8时空腹取肘静脉血5mL,低温离心后分离血清,置于-70oC条件下进行免疫指标的测定。采用酶联免疫吸附法检测血清IL-1β、IL-6及TNF-α的水平,具体实验操作和结果判定均按照试剂盒说明进行。3种试剂盒均为深圳晶美生物工程有限公司提供。
1.2.2 评定强迫症状 采用Y-BOCS评定患者组临床症状。Y-BOCS共10项,包括强迫思维(0~20分)和强迫行为(0~20分)2个因子,强迫总分为2因子的累计得分,得分越高提示强迫症状越重。该量表为他评量表,中文版信度效度较好,是目前常用的强迫症状严重程度评定量表[8]。量表评分由2位精神科主治或以上医师完成,结果取其平均值,2位医师对36例患者评定的组内相关系数ICC值为0.926。
1.2.3 统计学方法 采用SPSS16.0进行统计分析。2组间血清细胞因子水平的比较采用独立样本t检验。以各细胞因子水平为因变量,对细胞因子水平与强迫总分、强迫思维评分、强迫行为评分分别进行单因素线性回归分析;在此基础上控制年龄、性别、病程因素,对各细胞因子水平与强迫思维评分和强迫行为评分进行多因素线性回归分析。检验水准α为0.05。
2 结果
2.1 患者组与对照组血清细胞因子水平 患者组的血清IL-1β水平低于对照组,差异具有统计学意义(t=-8.267,P<0.001),患者组的血清 IL-6(t=8.884,P<0.001)、TNF-α(t=7.999,P<0.001)水平高于对照组,差异具有统计学意义。见表1。
2.2 患者组Y-BOCS量表得分 患者组Y-BOCS强迫总分为16~35分,平均(23.56±5.86)分。其中强迫思维维度4~18分,平均(11.67±3.08)分;强迫行为维度6~18分,平均(11.89±3.80)分。
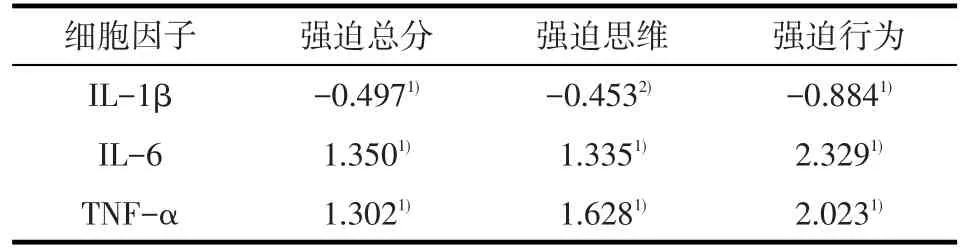
表2 患者组细胞因子与Y-BOCS量表单因素线性回归分析(β)
2.3 患者组细胞因子水平与Y-BOCS量表线性回归分析 单因素线性回归分析示,患者组各细胞因子水平与强迫总分、强迫思维评分、强迫行为评分的关联均有统计学意义(均P<0.05)。见表2。
控制年龄、性别、病程,多因素线性回归分析示,患者组的血清IL-1β、IL-6水平与强迫行为评分有关联(均P<0.001),2组回归方程确定系数R2分别为0.938和0.871。而患者组的血清TNF-α水平与强迫思维评分(P=0.002)、强迫行为评分(P<0.001)均有关联,回归方程确定系数R2为0.913。见表3。
3 讨论
强迫障碍患者细胞因子水平可能受其病情反复发作、病程及使用精神药物等多种因素的影响[9-10],故本研究选择首发未服用精神药物的OCD患者为研究对象,观察血清IL-1β、IL-6和TNF-α水平。
IL-6和TNF-α均由单核细胞和B淋巴细胞分泌。它们不仅参与免疫反应,而且对中枢神经系统有重要的营养支持作用,通过介导自身免疫影响中枢神经元功能。本研究显示首发OCD患者血清IL-6、TNF-α水平较对照组升高,提示OCD患者伴有单核巨噬细胞或淋巴细胞的免疫激活。这与Konuk等[11]和Petitto等[12]研究结果一致。外周循环血液中的IL-6、TNF-α可能通过脑内缺乏血脑屏障的区域进入中枢神经系统,而产生中枢效应。IL-6、TNF-α参与神经递质的调节,可使海马和额叶前部皮层DA和5-HT活动加强[13]。由于免疫系统和中枢神经系统之间的相互联系,强迫障碍DA增多而5-HT减少的发病机制假说[5]已经得到证实,Konuk等[11]认为,OCD免疫功能的变化可能是5-HT、DA等神经递质改变的结果。据此推测强迫障碍血清IL-6、TNF-α水平增高可能是其中枢DA和5-HT功能亢进的原因之一。但Petitto等[12]研究认为,OCD可能是链球菌感染后自身免疫反应的一种表现,它与其他自身免疫性疾病一样,表现出促炎性细胞因子(如IL-6和TNF-α)的增多。

表3 患者组各细胞因子水平与强迫思维评分、强迫行为评分的多因素线性回归分析
IL-1β主要产生于单核-巨噬细胞、树突状细胞,主要作用为增加自然杀伤细胞(natural killer cell,NK)和单核巨噬细胞的活性。Park等[14]认为IL-1β可以调节神经递质的代谢,影响精神运动、睡眠和行为障碍。而本研究发现,首发OCD患者血清IL-1β水平明显低于对照组,提示OCD患者的NK细胞活性降低,这与Gray等[15]通过Meta分析研究发现OCD患者IL-1β水平降低的结果一致。Brydon等[4]研究认为,IL-1β在相关脑区通过激活NO减少DA的合成水平。动物实验研究表明,在小鼠侧脑室注射IL-1受体拮抗剂,可以使海马和额叶皮层DA神经元活性增高[16]。由此推测强迫障碍血清IL-1β水平降低可能是DA功能亢进的原因之一。Gabbay等[17]认为,虽然目前还不清楚为什么OCD患者细胞因子的分泌有相反模式,但大量的研究表明神经免疫途径参与了OCD的病理生理机制。不过,也有早期的研究认为OCD患者不存在免疫激活现象[18]。
本研究通过多因素线性回归分析显示,首发OCD患者的血清IL-1β、IL-6水平与强迫行为评分相关,强迫行为评分越高,IL-1β水平越低,IL-6水平越高。血清TNF-α水平与强迫思维评分和强迫行为评分两者均相关,强迫思维评分和强迫行为评分越高,血清TNF-α水平越高。以上结果可能提示随OCD患者强迫症状严重程度的增加,尤其强迫行为维度评分越高,免疫功能的改变越明显。也可能提示细胞因子血清IL-6、IL-1β和TNF-α水平在一定程度上可反映OCD的严重程度。另外一方面,也可能说明强迫思维和强迫行为在首发OCD患者的免疫作用机制不同。本研究进一步支持Fontenelle等[19]研究的结果,该研究认为细胞免疫功能的改变可能与OCD的临床症状类型有关。但细胞因子与强迫障碍临床症状(强迫思维与强迫行为)的具体免疫作用机制需要进一步深入地研究。
本文初步探讨首发OCD患者的细胞因子IL-6、IL-1β和TNF-α水平变化及相关性,结果提示细胞因子IL-6、IL-1β和TNF-α可能参与OCD发病的病理机制,随OCD患者的强迫症状严重程度增加,免疫功能的改变可能越明显。由于样本量过小,区域局限,并且本研究仅检测了受试者的血清细胞因子水平,是否能完全代表中枢神经系统细胞因子水平,这有待以后同时检测外周血及脑脊液中细胞因子水平的大样本研究加以证实。
[1]Gibney SM,Drexhage HA.Evidence for a dysregulated immune system in the etiology of psychiatric disorders[J].J Neuroimmune Pharmacol,2013,8(4):900-920.
[2]师天元,郭新胜,张红亚,等.首发精神分裂症和首发抑郁症患者血浆白细胞介素及其可溶性受体的对照研究[J].中国神经精神疾病杂志,2009,35(1):26-29.
[3]李则挚,张晨,方贻儒.细胞因子在抑郁症中的作用机制[J].中国神经精神疾病杂志,2013,39(2):115-118.
[4]Brydon L,Harrison NA,Walker C,et al.Peripheral inflammation is associated with altered substantia nigra activity and psychomotor slowing in humans[J].Biol Psychiatry,2008,63(11):1022-1029.
[5]O'Connor JC,Lawson MA,Andre C,et al.Lipopolysaccharide induced depressive-like behavior is mediated by indoleamine 2,3-dioxygenase activation in mice[J].Mol Psychiatry,2009,14(5):511-522.
[6]Aljeshi A.Obsessive-compulsive disorder[J].Neurosciences(Riyadh),2011,16(4):313-319.
[7]Rao NP,Reddy MS,Reddy JY.Is there a role for immunological mechanisms in etiopathogenesis of obsessive compulsive disorder?[J].Indian J Psychol Med,2013,35(1):1-3.
[8]徐勇,张海音.Yale-Brown强迫量表中文版的信度和效度[J].上海精神医学,2006,18(6):321-323.
[9]Fontenelle LF,Barbosa IG,Luna JV,et al.A cytokine study of adult patients with obsessive-compulsive disorder[J].Compr Psychiatry,2012,53(6):797-804.
[10]Miller AH,Haroon E,Raison CL,et al.Cytokine targets in the brain:Impact on neurotransmitters and neurocircuits[J].Depress Anxiety,2013,30(4):297-306.
[11]Konuk N,Tekin IO,Ozturk U,et al.Plasma levels of tumor necrosis factor-alpha and interleukin-6 in obsessive-compulsive disorder[J/OL].Mediators Inflamm[2013-6-25].http://dx.doi.org/10.1155/2007/65704.
[12]Petitto JM,Repetto MJ,Hartemink DA.Brain-immune interactions in neuropsychiatry:highlights of the basic science and relevance to pathogenic factors and epiphenomena[J].CNS Spectr,2001,6(5):383-388,391.
[13]Dunjic-Kostic B,Jasovic-Gasic M,Ivkovic M,et al.Serum levels of interleukin-6 and tumor necrosis factor-alpha in exacerbation and remission phase of schizophrenia[J].Psychiatr Danub,2013,25(1):55-61.
[14]Park HJ,Shim HS,Kim KS,et al.Protective effect of IL-4 on IL-1β-induced behavioral,biochemical and immunological alterations[J/OL].Neurosci Res[2013-6-25].http://dx.doi.org/10.1016/j.neures.2013.01.008.
[15]Gray SM,Bloch MH.Systematic review of proinflammatory cytokines in obsessive-compulsive disorder[J].Curr Psychiatry Rep,2012,14(3):220-228.
[16]Mitra S,Chakrabarti N,Bhattacharyya A.Differential regional expression patterns of α-synuclein,TNF-α,and IL-1β;and variable status of dopaminergic neurotoxicity in mouse brain after Paraquat treatment[J].J Neuroinflammation,2011,8:163.
[17]Gabbay V,Coffey BJ,Guttman LE,et al.A cytokine study in children and adolescents with Tourette's disorder[J].Prog Neuropsychopharmacol Biol Psychiatry,2009,33(6):967-971.
[18]Monteleone P,Catapano F,Fabrazzo M,et al.Decreased blood levels of tumor necrosis factor-alpha in patients with obsessivecompulsive disorder[J].Neuropsychobiology,1998,37(4):182-185.
[19]Fontenelle LF,Barbosa IG,Luna JV,et al.A cytokine study of adult patients with obsessive-compulsive disorder[J].Compr Psychiatry,2012,53(6):797-804.

