肺炎克雷伯杆菌致大鼠重症肺炎模型的改良与评估*
卢伟波, 赵子文, 钟维农, 赵祝香, 李裕军, 方昌全
(广州医学院附属广州市第一人民医院呼吸内科,广东广州510180)
重症肺炎是呼吸科临床常见的危重疾病,动物模型的成功制备对该病的发病机制和临床研究有重要意义。但文献报道的重症肺炎动物模型很少,有Sprague-Dawley(SD)大鼠模型[1],也有 Piglet小猪模型[2];而且都存在一定缺陷,前者不能对患病大鼠进行实时大鼠血氧情况监测,后者实验过程复杂,设备要求高等。本研究拟在原报道的SD大鼠模型的基础上进行改良,采用无创动脉血氧饱和度仪监测大鼠血氧饱和度(oxygen saturation,SaO2)情况,寻求更为理想的重症肺炎动物模型,并提出重症肺炎动物模型的诊断标准。
材料和方法
1 材料
1.1 病原 肺炎克雷伯杆菌标准株(ATCC700603)由广州市第一人民医院检验科细菌室提供。实验前1 d将菌株接种于羊血琼脂糖平板上,于CO2恒温培养箱中37℃培养18~24 h后,收集细菌。根据比浊法,用无菌生理盐水将其稀释成含菌量400个麦氏浊度单位(相当于1.2×1014CFU/L,1个麦氏浊度单位=3×1011CFU/L)和3个麦氏浊度单位的混悬液备用。
1.2 主要仪器 生物梅里埃细菌比浊计(法国生物梅里埃公司);迈瑞PM-50掌式血氧饱和度监测仪,迈瑞新生儿包裹血氧传感器518B64-4(深圳迈瑞生物医疗电子股份有限公司);i-STAT(300型)血气分析仪(美国雅培公司);T1800血球分析仪(日本东亚公司);郑州豪润奇HRQ-A2兽用电子体温计;美国INNOVET E7239X兽用 X光机,德国 PROTEC PROSCAN 35 CR机(华南农业大学动物医院提供)。
2 方法
2.1 动物与分组 健康SPF级雄性SD大鼠25只,鼠龄为6~8周,体重180~200 g,由广东省实验动物中心提供[使用许可证号为SCXK(粤)2008-0002,合格证编号 No.0100760]。随机分为对照组、观察组和模型组,对照组和观察组各5只,模型组15只。不同组别,分笼饲养于广州医学院动物实验中心恒温(25℃)房间内,光照和黑暗各12 h交替,自由进食标准颗粒饲料及饮水,适应环境7 d。
2.2 模型建立 腹腔注射10%水合氯醛(3 mL/kg)麻醉,麻醉后固定,颈部备皮消毒,无菌操作,切开颈部皮肤,暴露上段气管,用24G的Y型静脉留置针经气管插管,拔出针芯,使导管完全进入气管,由留置针白色帽端处注入。模型组注入含菌量为400个麦氏浊度单位的细菌混悬液0.35 mL,将固定大鼠的手术台竖立起来后缓慢注射,每注射0.1 mL后竖立大鼠,左右旋转大鼠固定台1 min后再继续。观察组和对照组分别以相同方法注入含菌量为3个麦氏浊度单位[3]的细菌混悬液0.35mL和等量的无菌生理盐水。接种完后继续竖立大鼠固定台,使大鼠先后分别保持直立位和倒立位各约2 min,尽量使菌液均匀分布于双肺各个肺叶。缝合伤口,局部消毒。
2.3 建模成功诊断标准 参考2006年中华医学会呼吸病分会发表的“社区获得性肺炎诊断和治疗指南”[4]和2007年美国感染疾病学会/美国胸科学会(Infectious Diseases Society of America/American Thoracic Society,IDSA/AT)发表的成人重症获得性肺炎诊断标准[5],以及国外学者 Luna等[6]关于重症耐甲氧西林金黄色葡萄球菌肺炎动物模型诊断标准,我们提出大鼠重症肺炎模型成功的无创诊断标准:(1)出现反应迟钝、呆滞等意识障碍表现;(2)呼吸急促(可见双侧胸廓急速运动);(3)严重的低氧血症,SaO2<90%或动脉血氧分压≤60 mmHg;(4)胸部X线检查出现两肺弥漫性渗出影。
2.4 大鼠排除标准及宰杀时间 术后24 h内死亡的排除出实验,并被重新注菌的大鼠替代入组,进行后续观察。对照组和观察组于术后72 h[3,7]时,模型组在达到预定的诊断标准后,腹腔注射10%水合氯醛(3 mL/kg)麻醉后,脊椎脱臼法处死大鼠。
2.5 相关观察指标
2.5.1 大鼠行为学观察 观察大鼠反应情况,是否竖毛、嗜睡,观察尿量和粪便变化,观察鼻腔及眼眶有无分泌物、有无气促,有无喘鸣音,观察肢端皮肤颜色变化等。
2.5.2 体重变化监测 术前3 d及术后每天固定于早上8点钟测量大鼠体重变化,处死大鼠之前再一次记录大鼠体重。
2.5.3 体温及SaO2变化监测 术前3 d及术后每6 h监测大鼠体温和SaO2。探测体温时,操作时让大鼠尽可能处于自然状态,避免过于紧张,恐惧,用兽用电子体温计软头部位插入直肠约5~8 cm。连续读数3次后,取其平均值;测SaO2变化时,将动脉血氧饱和度仪传感器包裹在大鼠右后肢膝关节以上腿部(剃去毛发),每次监测3 min,取读数稳定≥30 s的值记录为实测SaO2值。
2.5.4 血常规变化观察 所有大鼠分别于术后的第24 h和处死前眼眶后静脉丛取血,每次约收集0.1 mL行血常规分析,观察白细胞计数,中性粒细胞计数百分比。
2.5.5 动脉血气分析 所有大鼠在处死前,麻醉后无菌操作分离腹主动脉,结扎动脉远端,取血约1 mL后立即用血气分析仪进行血气分析。
2.5.6 肺组织病理变化 实验结束时,麻醉后处死所有大鼠,完整取下双侧肺组织,观察肺组织大体变化情况。沿着气管、血管走向,将其切成5~10 mm厚的小块,保证肉眼可辨别支气管、血管和肺实质;参考肺炎评分标准[8],进行肺组织大体病理学评分,0分:肺部没有炎症出现;1分:支气管出现脓性黏液栓,未出现管壁破坏;2分:支气管炎,表现为脓性黏液栓并出现支气管破坏;3分:肺炎,指次级肺段出现实变;4分:融合性肺炎,表现为相邻几个次级肺段出现实变;5分:化脓性肺炎,肺实变灶有脓性坏死物溢出。留取病灶较明显的组织于4%甲醛溶液充分固定24 h后,常规脱水、透明、包埋、切片,苏木精-伊红(HE)染色后,病理显微镜下观察组织变化。
2.5.7 胸部X线检查 术后处死前随机抓取对照组和观察组鼠各2只,进行胸部X线检查。模型组大鼠在无创血氧饱和度仪测得数值小于90%时进行。
3 统计学处理
采用SPSS 17.0软件进行统计学处理,各组数据在分析前进行正态性检验和方差齐性检验,正态分布数据以均数±标准差(mean±SD)表示,非正态分布数据用中位数表示。两组均数比较采用t检验,多组均数比较采用单因素方差分析,两样本相关性分析采用Pearson相关分析;以P<0.05为差异有统计学意义。
结 果
1 死亡现象
模型组1只在注菌过程中死亡;2只在注菌术后12 h突然死亡;这3只后来重新注菌后补做。15只大鼠存活时间>24 h,在术后30~36 h及36~42 h分别自发死亡1只,42~48 h和48~54 h之间各有2只自发死亡;其余9只大鼠分别在36 h时处死2只,42 h时处死1只,48 h处死3只,54 h处死1只,66 h处死2只。对照组和观察组大鼠在实验期间未出现自发死亡现象。
2 行为学变化
模型组大鼠在注菌后的前24 h,活动明显减弱,蜷缩于鼠笼一侧,反应迟钝,鼻腔和眼眶周边可见少许分泌物,偶见竖毛,呼吸急促,双侧胸廓呼吸动度增强,无发绀,鼠笼中粪便少,垫料干洁。24~48 h,出现大鼠死亡,存活者出现嗜睡,体型较前瘦小,鼻腔及眼眶分泌物增多,呼吸急促情况较前明显,有些能闻及喘鸣音,偶可见大鼠排稀烂样便;第48 h后,存活大鼠眼眶和鼻腔分泌物减少,呼吸急促,有喘鸣音,可见大鼠四肢及阴囊出现紫绀,竖毛明显,触摸之觉背部肌肉松垮。观察组在前24 h,可见大鼠活动及进食减少、蜷缩,呼吸频率增多等,但逐渐好转,到72 h处死前,未见明显行为学异常;对照组活动自如,反应灵敏,无气促,无喘鸣音,无异常分泌物,无嗜睡,大便形状正常。
3 体重变化
术前3组大鼠体重无降低,每天增加(5±3)g,术前3 d共增加(20±5)g。模型组术后第1 d下降明显,约下降(12±3)g,存活大鼠第2、3 d体重下降减缓,为(6±2)g;处死时体重较注菌前下降(25±5)g。观察组术后1 d体重基本不变,处死前约增加(10±3)g。对照组体重变化趋势如术前。处死前各组进行体重比较,均有显著差异(P<0.05)。
4 体温变化
术前3组大鼠体温无明显差异(P>0.05),波动于(37.8±0.5)℃。术后6 h即开始出现体温下降,模型组为(34.5±0.5)℃,观察组(34.7±0.3)℃,对照组为(35.2±0.8)℃,尔后3组大鼠体温逐渐回升,注菌后 24 h,模型组(36.7±1.0)℃,观察组(36.9±0.7)℃,对照组(37.8±0.5)℃之间,观察组和模型组比较,未见明显差异(P>0.05),观察组、模型组与对照组相比,可见显著差异(P<0.05)。处死前各组体温为:模型组(37.7±0.5)℃,观察组(37.9±0.4)℃,对照组(38.0±0.5)℃,3组大鼠组间比较,均未见明显差异(P>0.05)见图1。

Figure 1.Temperature comparison of the three groups at different time points.图1 各组大鼠术后体温变化曲线
5 无创SaO2变化
术前3组大鼠无创方法测得SaO2无明显差异(P>0.05),波动在(94~100)%之间。模型组在注菌后的24 h内,无明显下降;术后第24 h开始下降,为(91±3)%。术后第36~66 h之间,模型组大鼠陆续出现 SaO2明显下降,波动于(83.5±3.5)%。对照组及观察组手术前后无明显变化(P>0.05);模型组分别与观察组和对照组进行比较,均有显著差异(P <0.05)。
6 血常规变化
对照组观察不同时点,血常规观察指标未见明显差异(P>0.05)。观察组和模型组在术后第24 h和处死时白细胞和中性粒细胞计数、中性粒细胞百分数逐渐升高,尤以模型组变化明显;观察组、模型组分别与对照组比较,均有显著差异(P<0.05);观察组和模型组组间、不同时点比较差异均有统计学意义(P <0.05),见表1。
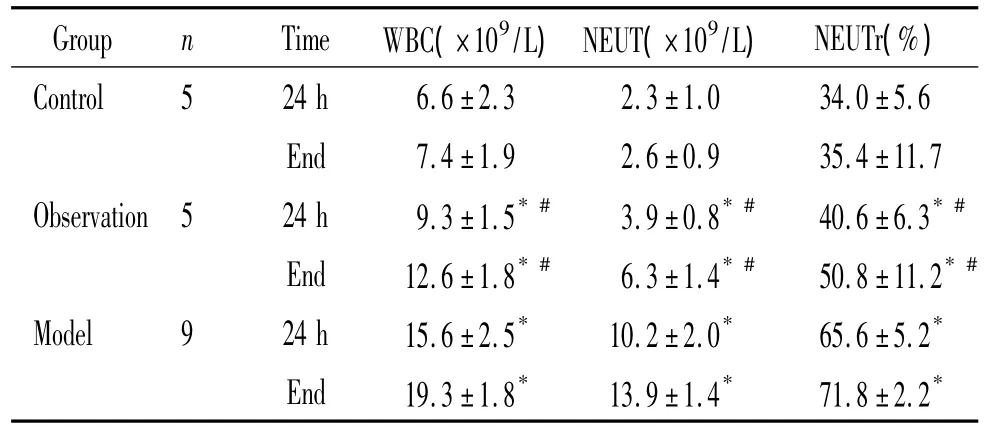
表1 3组大鼠不同时间外周血血常规变化情况Table 1.Peripheral blood changes in each group at different time points(mean±SD)
7 动脉血气分析比较
与对照组和观察组相比,模型组在术后处死前动脉血氧饱和度、动脉血氧分压和二氧化碳分压下降明显,差异均有统计学意义(P<0.05);观察组和对照组比较无统计学意义(P>0.05),见表2。

表2 处死前各组大鼠动脉血气分析结果Table 2.Arterial blood gas analysis in each group when sacrificed(mean±SD)
8 处死前血氧饱和度仪读数和动脉血气分析中血氧饱和度值相关性分析
血氧饱和度仪读数和动脉血气分析中血氧饱和度值呈线性趋势,Pearson相关系数r=0.977(P<0.01),具有统计学意义。两者几乎表达于同一线上,见图2。

Figure 2.Distribution of SaO2detected by the two different methods.They are almost on the same line.图2 所有大鼠分别用无创血氧饱和度仪和有创动脉血气分析得到的2组SaO2值分布曲线图
9 各组大鼠胸部X线照片变化
对照组大鼠胸片无明显异常,双肺肺纹理清晰,无增粗,未见实变影,未见浸润阴影,双侧肺门清晰,双侧肋隔角锐利,双侧膈面光滑低平;观察组大鼠双肺透亮度减低,肺纹理稍粗乱,双肺散在少量小斑片影,边界稍模糊;模型组大鼠见双肺透亮度剧降,双下肺可见散在斑片状模糊影,整个肺野为“大白肺”,见图3。
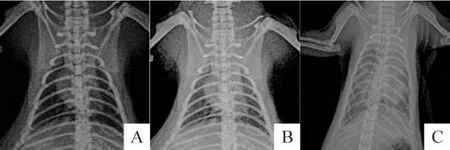
Figure 3.Changes of chest X-ray of the rats in the three groups when sacrificed.A:control group;B:observation group;C:model group.图3 各组大鼠胸部X光片结果
10 大鼠双肺组织病理学变化
肺组织大体如图4:对照组双侧肺组织表面光滑,颜色粉红,无出血点,无浸润灶,质地软嫩,弹性良好;观察组大部分肺组织光滑,偶见小片实变灶,包膜有充血,未见化脓灶;模型组双侧肺组织不同肺叶均出现散在的出血点,肺包膜下充血明显,肺组织呈暗红色,有大片实变灶,甚至可见化脓灶,肺组织弹性差,触摸之有实质感;肺组织大体评分:每只大鼠有5个肺叶(左侧1个,右侧4个),根据肺炎分级标准[8],对每个肺叶进行评分。其中,模型组大鼠多个肺叶达到3分及以上改变,具体见表3。肺组织病理切片HE染色,镜下见对照组大鼠肺组织形态正常,肺泡结构完整,肺泡腔内无炎性渗出物浸润,肺泡间质无充血,水肿;观察组大鼠肺泡结构不一,肺泡间隔增宽、断裂,肺泡间隔内血管充血,可见红细胞和炎症细胞浸润;模型组大鼠仅见少量完整肺泡,余肺泡结构破坏,腔内见浆液性渗出物,少量红细胞,大量中性粒细胞和肺泡巨噬细胞浸润,甚至肺泡腔完全实变,见图5。

Figure 4.Pathological changes of rat lung tissues in the three groups.A:control group;B:observation group;C:model group.图4 各组大鼠肺组织大体变化

表3 3组大鼠肺叶组织大体评分Table 3.Lung pathology score of the three groups of rats
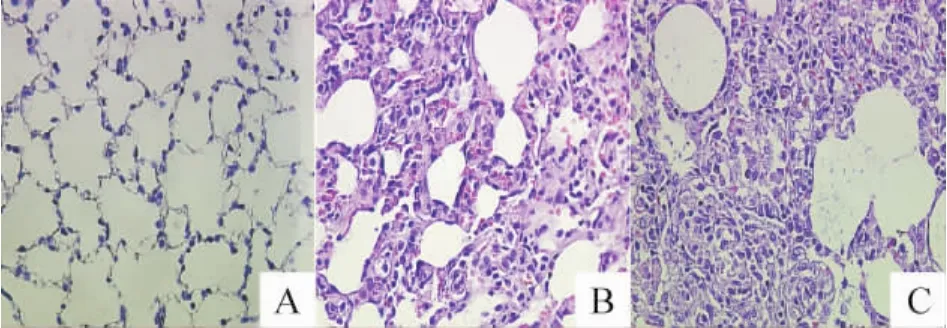
Figure 5.HE staining changes of lung tissue under microscope(×200).A:control group;B:observation group;C:model group.图5 各组大鼠镜下肺组织病理改变
讨 论
重症肺炎是呼吸科临床常见的危重症疾患,除外肺炎常见的呼吸系统临床表现外,常伴有急性呼吸衰竭、严重的中毒症状和(或)脓毒性休克,甚至多器官功能衰竭综合征等危及生命的并发症[9]。尽管近年来医疗设备和抢救技术水平不断提高,许多广谱、高效抗生素相继问世,其临床治疗效果仍不理想,在重症监护病房的死亡率在28% ~50%之间[10],并没有下降的趋势[11]。故重症肺炎动物模型的成功制备对该病发病机制和临床研究有重要意义。然而,国内外关于重症肺炎动物模型建立的文章较少。陈业民等[1]于2005年建立了肺炎克雷伯杆菌重症肺炎动物模型。该模型中将浓度为3个麦氏浊度单位的肺炎克雷伯杆菌悬液,通过暴露气管、穿刺气管注射的方式注入肺内,于注菌后第5、6 d模型建立成功。而国外学者Luna等[2]于2007年利用Piglet小猪建立了第一个铜绿假单胞菌重症肺炎模型。该模型是模拟呼吸机获得性肺炎模型改良的,需要在配备有心血管监视器、呼吸机、电子输注泵的重症监护实验室进行,对小猪行气管插管,股动、静脉插管和膀胱插管等,通过支气管纤维内窥镜把铜绿假单胞菌悬液均匀地分布到双肺的各个肺叶中,实验过程中需要为实验小猪提供24 h的照顾。这2个模型虽然都得到一些应用[6,12],但仍有较多不足。前者在模型的建立过程中,大鼠发病较慢,且未见有大鼠死亡的报道,这与临床上重症肺炎患者的病情快速变化和高死亡率并不相符;并且需通过有创暴露腹主动脉或颈内动脉取血来监测血氧饱和度变化,导致大鼠死亡,对后续的实验观察带来不便;后者实验虽然较为精细,但设备要求高,操作繁琐,况且该模型一开始即给予呼吸机通气支持,与临床上重症肺炎发病相悖,对重症肺炎的发病机制研究将产生一定的影响。因此,探讨建立病情发展较快,更接近临床重症肺炎患者的大鼠模型和更为简单的模型诊断标准,尤为重要。
在预实验中,我们对细菌浓度、用量和注菌方式进行深入探索,最终确定浓度为400个麦氏浊度单位的细菌悬液0.35 mL对6~8周的200 g左右的SD大鼠是比较理想的:既不会因为菌液过少,导致大鼠对感染的耐受;也不会因为浓度过高,导致菌液黏稠,堵塞呼吸道,造成模型大鼠术中死亡。注菌时,通过旋转、交替竖立和倒立大鼠手术固定台的方法,可以使菌液较均匀地分布到各个肺叶。通过用24G的Y型静脉留置针经气管插管,拔出针芯,使导管完全进入气管后注菌的方法,可以避免普通的1 mL注射器穿透气管,造成菌液外露;而且导管更深入地进入气管,菌液可以快速达到肺气管,避免菌液堵塞下段气管,造成大鼠窒息。另一方面,我们也探讨了无创动脉血氧饱和度仪监测大鼠动脉血氧饱和度的方法,并证明其跟有创的动脉血气分析所得到的血氧饱和度具有高度的一致性,可用于监测大鼠动脉血氧饱和度。但因为大鼠体表毛发和肢端形体较不规则,可能会对血氧饱和度仪传感器的敏感性产生一定的影响。因此,测量的时候,需要对毛发进行处理,并选择敏感性较强的传感器,而且要等到血氧饱和度仪器读数较稳定后才能取值记录。
实验中,我们通过连续对3组大鼠无创监测血氧饱和度,当出现SaO2<90%时,观察其神智反应、呼吸频率和胸部X线变化。如果都达到预定的标准,则认为该大鼠建模成功,立即处死建模成功大鼠,研究其血常规,血气变化和病理组织变化。在实验观察周期内,对照组和观察组大鼠无一出现SaO2<90%。而模型组大鼠在不同的时点内达到建模成功的标准,最快在注菌后的36 h出现,最迟在66 h建模成功,有6只大鼠出现自发死亡,自发死亡率为40%。与对照组和观察组相比,模型组大鼠出现反应迟钝、呆滞等神智变化;鼻腔和眼眶出现分泌物,呼吸急促,四肢及阴囊部位出现紫绀,尿量、粪便减少,体重明显减轻,可能与重症肺炎大鼠肺部感染后出现的呼吸衰竭和并发的肾功能损害、消化道功能紊乱有关。术后24 h和处死前血常规检查中,模型组白细胞计数、中性粒细胞计数及其百分数升高较为明显,这与我们前面对重症肺炎患者的研究结果相一致[13]。处死前动脉血气分析示大鼠处于呼吸衰竭状态,血氧饱和度值与无创血氧饱和度仪读数相一致。组织病理学方面,肺组织大体表现为双侧多个肺叶出现大片实变灶,甚至出现化脓性病灶,与临床重症肺炎患者多肺叶病变相似;镜下见肺泡结构破坏和大量的中性粒细胞、肺泡巨噬细胞浸润。
综上模型组大鼠行为学变化,体重变化,血常规检查,血气分析检查和肺组织病理学变化等结果,我们认为达到预定诊断标准的大鼠发病症状与临床上重症肺炎患者的发病情况相类似。因此,通过该方法能成功建立重症肺炎大鼠模型,该方法是建立重症肺炎的合适方法。我们拟定的重症肺炎动物诊断标准,可以用于建立动物模型时,对成功模型的筛选;另一方面,无创动脉血氧饱和度仪可以用于监测大鼠动脉血气变化,有助于对大鼠肢端血氧情况实时监测,大致判断大鼠病情的变化。
实验中,各组大鼠体温在术后即出现下降,而后逐渐上升,至术后24 h时大致恢复正常,可能跟手术麻醉药的使用和肺炎克雷伯杆菌的定植和入侵有关;但我们并没有发现大鼠感染后体温上升这一现象,是不是跟大鼠本身体温调节中枢有关,或是其它原因,还有待进一步研究。
[1] 陈业民,黄文杰,李胜利,等.肺炎克雷伯菌致大鼠重症肺炎模型的建立[J].第一军医大学学报,2005,25(12):1498-1552.
[2] Luna CM,Baquero S,Gando S,et al.Experimental severe Pseudomonas aeruginosa pneumonia and antibiotic therapy in piglets receiving mechanical ventilation[J].Chest,2007,132(2):523-531.
[3] 罗 源,刘朝晖,樊建勇,等.β-防御素-2 mRNA在大鼠肺炎中的表达及与白介素17F的关系[J].国际呼吸杂志,2011,31(2):94-98.
[4] 中华医学会呼吸病分会.社区获得性肺炎诊断和治疗指南[J].中华结核和呼吸杂志,2006,29(10):651-655.
[5] Mandell LA,Wunderink RG,Anzueto A,et al.Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults[J].Clin Infect Dis,2007,44(Suppl 2):S27-S72.
[6] Luna CM,Bruno DA,García-Morato J,et al.Effect of linezolid compared with glycopeptides in methicillin-resistant Staphylococcus aureus severe pneumonia in piglets[J].Chest,2009,135(6):1564-1571.
[7] Yadav V,Sharma S,Harjai K,et al.Induction and resolution of lobar pneumonia following intranasal instillation with Klebsiella pneumoniae in mice[J].Indian J Med Res,2003,118:47-52.
[8] Marquette CH,Copin MC,Wallet F,et al.Diagnostic tests for pneumonia in ventilated patients:prospective evaluation of diagnostic accuracy using histology as a diagnostic gold standard[J].Am J Respir Crit Care Med,1995,151(6):1878-1888.
[9] Ewig S,Woodhead M,Torres A.Towards a sensible comprehension of severe community-acquired pneumonia[J].Intensive Care Med,2011,37(2):214-223.
[10] Restrepo MI,Anzueto A.Severe community-acquired pneumonia[J].Infect Dis Clin North Am,2009,23(3):503-520.
[11] Suberviola B,Castellanos-Ortega A,Llorca J,et al.Prognostic value of proadrenomedullin in severe sepsis and septic shock patients with community-acquired pneumonia[J].Swiss Med Wkly,2012,142:w13542.
[12] 陈业民,黄文杰,李胜利,等.重症肺炎大鼠干扰素-γ、白细胞介素-6和肿瘤坏死因子-α含量变化[J].中国病理生理杂志,2007,23(3):492-494.
[13] 蒋明彦,赵子文,钟维农,等.重症肺炎患者外周血细胞计数与预后[J].中国医师杂志,2008,10(10):1386-1388.

