STIM1、ORAI1在外伤性癫痫大鼠中的表达☆
王文肖淳李海涛唐兆华师艺峰谢延风石全红
外伤性癫痫(post-traumatic epilepsy,PTE)是继发于颅脑损伤后的发作性功能异常,在开放性颅脑损伤中发生率可达50%甚至更高比例[1]。PTE严重影响患者生活质量,其发病机制和防治一直是神经外科医师研究的难点和热点。已有大量研究表明钙通道参与癫痫形成[2-4],钙通道异常引起Ca2+过度内流,大量神经元同步过度放电,导致癫痫发作。钙释放激活的钙(calcium release-activated calcium,CRAC)通道是钙通道中的一种位于细胞质膜上的慢钙通道。基质相互作用分子1(stromal interaction molecule 1,STIM1)和钙释放激活钙通道调节分子1(calcium release-activated calcium channel modulator 1,ORAI1/CRACM1)是CRAC通道的两个关键蛋白,介导CRAC通道的组成和激活。本实验通过建立PTE大鼠模型,研究STIM1和ORAI1在PTE大鼠脑组织中的表达变化,以期阐明CRAC通道与PTE的关系。
1 材料与方法
1.1 研究对象 清洁级健康雄性SD大鼠84只,体质量200~250g,由重庆医科大学实验动物中心提供。用抽签法随机分为对照组42只和实验组42只。试剂:100 mmol/L FeCl3溶液(美国Sigma公司),STIM1兔单克隆抗体IgG(美国Abcam公司),ORAI1兔多克隆抗体IgG(美国Proteintech Group公司),β-肌动蛋白(actin)鼠多克隆抗体IgG、辣根过氧化物酶标记羊抗兔二抗(中国北京中杉金桥公司),PCR引物由北京六合华大基因科技公司合成,Trizol RNA抽提试剂、SYBR Green PCR Master Mix及逆转录试剂盒(日本TaKaRa公司)。
1.2 PTE模型的制作 大鼠经3.5%水合氯醛溶液(10mL/kg)腹腔麻醉后固定于立体定位仪上,手术暴露颅骨。参照Golden N等[5]实验方法,在左侧冠状缝后1mm、矢状缝旁2mm处钻开颅骨。用微量注射器将5μL浓度为100mmoL/L FeCl3溶液在5min内匀速注射到大鼠皮层内,进针深度3mm,注射完后,留滞针头5min以防外溢。对照组注射等量生理盐水。2h后(麻醉完全苏醒)观察行为学表现,参照改良Racine法(无任何癫痫发作行为记0分;凝视发作记1分;规律性点头或湿狗样抖动,伴或不伴面部抽动记2分;单侧前肢抖动记3分;站立、双前肢抖动及持续性点头记4分;双侧肢体颤动加重,失去平衡跌倒而全身性强直阵挛性发作记5分;发作衰竭导致死亡记6分)对大鼠癫痫发作进行评分,癫痫发作判定:将≥3分的行为学改变定义为癫痫发作,视为制模成功,对造模不成功或死亡的动物剔出实验,并通过随机抽样原则补齐动物并重新造模。按不同时间点(伤后6h、24h、72h、7d、14d、21d、28d)随机选取6只大鼠,腹腔麻醉后断头取脑组织。
1.3 实时荧光定量PCR(RT-PCR)检测STIM1和ORAI1 mRNA表达 STIM1上游引物5'-CTGGTGGAGAAACTGCCTGAC-3',下 游 引 物 5'-GGCTAAGAGAATGGGAAGAATCC-3';ORAI1 上游 引 物5'- AGGGTTGCTCATCGTCTTTAGTG -3',下 游 引物 5'- CTCGTGGGGTGACTCTTTGAC -3';β-actin上 游 引物 5'- ACGGTCAGGTCATCACTATCG -3',下游引物5'- GGCATAGAGGTCTTTACGGATG -3'。Trizol法提取细胞总RNA,微量分光光度计检测RNA样品浓度(A值)及纯度(A260/A280值在1.7~2.0范围内)并进行标化。用逆转录试剂盒将RNA逆转为cDNA。逆转录条件如下:37℃15min,85℃ 5s,保存于-20℃。以cDNA为模板,β-actin为内参照进行实时定量PCR反应。反应条件如下:50℃ 2min,95℃ 5min;95℃ 20s,55℃ 20s,72℃30s,40个循环。反应体系为25µL。PCR结果采用Ct值比较相对定量法,β-actin为内参照。
1.4 Western blot检测STIM1和ORAI1蛋白表达按说明书提取总蛋白质,并用BCA法检测蛋白质浓度并标化。以β-actin为内参蛋白。蛋白样品加入变性缓冲液于沸水中煮5min,10000 r/min离心5min后上样。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,然后转至硝酸纤维膜。于5%脱脂牛奶中4℃封闭过夜;分别加入抗STIM1抗体(1∶2000)、抗ORAI1抗体(1:800)、抗β-actin抗体(1∶3000)置于4℃孵育过夜;加入二抗(1∶3750)于37℃孵育1 h。化学发光法进行显色。
1.5 免疫组化检测STIM1和ORAI1蛋白表达取出石蜡块,行连续冠状切片,片厚5μm,按照说明书采用SP法进行染色。以PBS代替一抗作阴性对照。STIM1一抗浓度为1:100,ORAI1一抗浓度为1:800。采用Image-Pro Plus5.0图像分析系统对免疫组化结果进行扫描,半定量分析STIM1和ORAI1在实验组和对照组皮层中的表达。
1.6 统计学方法采用SPSS17.0分析,多组间均数比较采用单因素方差分析(用LSD-t检验比较两两之间的差异),两组间均数比较采用两独立样本t检验,数据以均数±标准差(±s)表示。检测水准α=0.05。
2 结果
2.1 行为学观察 对照组未观察到癫痫发作。实验组共给50只大鼠注射FeCl3,其中42只出现典型癫痫发作,制模成功率为84.0%。伤后6h内出现程度不一的癫痫发作,如凝视、不动,重复、刻板地点头、咀嚼,湿狗样抖动,伴或不伴面部抽动,单侧前肢震颤及持续性点头,双前肢颤动加重失去平衡跌倒,全身性强直-阵挛发作,未见发作严重而死亡的大鼠。平均约30 min发作1次,每次持续1~3 min,局灶性发作多见,发作间期进食、活动减少。3d内癫痫发作仍较频繁,平均每小时发作1次,持续时间约1~2min。7d后发作次数有所减少,但每日均有2~4次的规律发作。28d癫痫发作显著减少,其中4只可见1次发作,另2只未见发作。
2.2 RT-PCR结果 实验组伤后STIM1、ORAI1各个时间点的表达与对照组比较均显著增高(F值分别为 120.829、45.882,P均<0.05),72h 组表达为最高峰(P均<0.05)。见表1。
2.3 Western blot结果 对照组与实验组各时间点STIM1、ORAI1比较有统计学意义(F分别为27.615、65.093,P均<0.05)。两两比较,实验组伤后6h STIM1的表达与对照组比较无统计学差异(P=0.322),此后6个时间点的表达与对照组比较均显著增高(伤后24h、72h、7d、14d、21d、28d的P均<0.01),72h组表达为最高峰(P均<0.01)。实验组伤后6h ORAI1表达与对照组比较无明显变化(P值为0.054),此后6个时间点的表达与对照组比较均显著增高(伤后24h、72h、7d、14d、21d、28d的P均<0.01),72h组表达为最高峰(P均<0.01)。见表1、图1~3。
2.4 免疫组化结果 在STIM1和ORAI1伤后表达高峰时间点(72h),取伤灶周边皮层做免疫组织化学法,进一步测定其蛋白的表达水平。STIM1在对照组皮层神经元中仅有弱阳性表达,实验组STIM1在细胞膜表面的表达量与对照组比较明显增加(t=16.233,P<0.05)。ORAI1在对照组皮层神经元仅有弱阳性表达,实验组ORAI1在细胞膜表面的表达量与对照组比较明显增加(t=17.339,P<0.05)。见图4、表2。

表1 大鼠皮层STIM1、ORAI1 mRNA和蛋白的表达水平

表2 PTE大鼠皮层STIM1、ORAI1阳性表达(AOD值)水平
3 讨论
目前研究认为颅脑外伤后出血分解产生的铁离子对神经细胞的损伤是PTE的启动因素[6],因此常用皮层注射铁离子致动物癫痫发作,制作PTE模型,研究PTE发作的机制[7,8]。本实验组共给50只大鼠注射FeCl3,制模42只,成功率达84.0%,伤后28d,均有癫痫发作,成功制作FeCl3外伤性癫痫模型。说明FeCl3诱导的大鼠痫性发作成功率高、稳定性好,是一种理想的PTE动物模型。
CRAC通道是位于细胞质膜上的慢钙通道,对钙离子具有高度选择性,钙库中钙浓度明显下降或清空时被激活。STIM1和ORAI1与CRAC通道的组成和激活密切相关。STIM1主要定位于内质网,其主要作用是感受内质网钙库中钙浓度的多少,并将这一信号传递至细胞膜上的CRAC通道,直接调控通道的开启和关闭[9]。ORAI1位于细胞膜上,目前认为是构成CRAC通道的主要成分。大量研究显示在自身免疫病、免疫缺陷病、支气管哮喘等诸多人类疾病中,CRAC通道活性异常。近年研究认为动物神经元也存在CRAC通道[10,11],特别是椎体神经元的胞体和树突、小脑的浦肯野和颗粒神经元。

图1 大鼠皮层STIM1、ORAI1蛋白的表达,*:与对照组比较,P<0.05

图2 Western blot显示大鼠皮层STIM1蛋白的表达,1:对照组;2:实验组6h;3:实验组24h;4:实验组72h;5:实验组7d;6:实验组14d;7:实验组21d;8:实验组28d
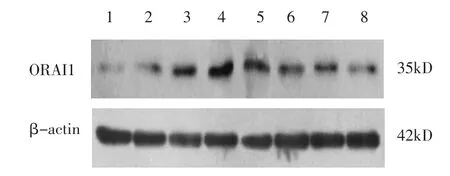
图3 Western blot显示大鼠皮层ORAI1蛋白的表达,1:对照组;2:实验组6h;3:实验组24h;4:实验组72h;5:实验组7d;6:实验组14d;7:实验组21d;8:实验组28d

图4 免疫组化检测伤后72h大鼠皮层STIM1、ORAI1的表达情况。A:STIM1对照组(400×),B:STIM1实验组(400×)C:ORAI1对照组(400×),D:ORAI1实验组(400×)
本组研究通过对大鼠行为学的观察,发现铁离子致伤后大鼠癫痫发作明显增加。同时,RT-PCR检测发现,PTE大鼠伤后不同时间点STIM1、ORAI1的mRNA表达均显著升高,Western blot检测显示STIM1、ORAI1蛋白在伤后也明显增加,免疫组化同样证实了STIM1、ORAI1蛋白在伤后的表达上调。这些结果充分说明CRAC通道异常与外伤性癫痫密切相关。目前研究认为,细胞受刺激后可激活细胞膜磷脂酶C(phospholipase C,PLC),作用于4,5-二磷酸磷脂酰肌醇(phosphatidylinositol-4,5-bisphosphate,PIP2)使其分解为三磷酸肌醇(inositol 1,4,5-triphosphate,IP3)和甘油二脂。IP3与内质网上的IP3受体结合,引起细胞内Ca2+浓度轻微升高,由此进一步引起更多IP3受体通道的开放,大量Ca2+从内质网释放到细胞质,内质网Ca2+浓度的降低激活STIM1;与此同时,质膜上的ORAI1蛋白自发的组装成四聚体CRAC通道[12]。我们推测,铁离子致伤后导致神经元过氧化反应,可能通过上述途径大量激活STIM1和ORAI1,从而使CRAC通道开放增多,导致Ca2+大量内流。Ca2+大量内流引起神经元持续去极化,形成同步性爆发性放电,导致癫痫发生[13]。
本组研究还发现在伤后28d,实验组仍有癫痫发作,且STIM1、ORAI1的表达仍显著高于对照组。Steinbeck JA等也发现在鼠类慢性癫痫模型以及人类颞叶癫痫脑标本中,STIMI的表达明显增高[14]。提示CRAC通道异常还可能参与晚期癫痫的形成。这可能与胞内钙超载致神经元凋亡,胶质细胞反应性增生,胶质瘢痕形成,引起神经元膜电位平衡性和稳定性紊乱有关[15]。此外,Gasperini R等研究发现CRAC通道与突触可塑性有关[16],PTE大鼠皮层STIM1和ORAI1表达上调,也可能通过突触重建导致晚期癫痫发生。
综上所述,本实验结果提示STIM1和ORAI1的表达上调与大鼠PTE发作密切相关。通过对国内外对CRAC通道功能及PTE相关机制研究的分析,结合本研究结果,铁离子致伤后可能通过STIM1和ORAI1的表达上调,导致CRAC通道大量开放,过度钙内流引起神经元异常放电、胶质瘢痕形成、突触重建,最终诱发外伤性癫痫。需要指出的是,本研究目前只能反映CRAC通道与PTE的相关性,这是本文的不足之处。在后期实验中,我们将通过阻断CRAC通道,观察PTE大鼠行为学的变化,并同步检测神经元膜电位、CRAC通道电位及钙离子浓度的变化等研究,来进一步探讨CRAC通道异常导致PTE发生的具体机制。
[1]Bozic K.Prophylactic use of antiepileptic drugs for posttraumatic epilepsy[J].Med Pregl,2009,62(11-12):501-503.
[2]Zamponi GW,Lory P,Perez-Reyes E.Role of voltage-gated calcium channels in epilepsy[J].Pflugers Arch,2010,460(2):395-403.
[3]Li H,Graber KD,Jin S,et al.Gabapentin decreases epileptiform discharges in a chronic model of neocortical trauma[J].Neurobiol Dis,2012,48(3):429-438.
[4]Faria LC,Parada I,Prince DA.Interneuronal calcium channel abnormalities in posttraumatic epileptogenic neocortex[J].Neurobiol Dis,2012,45(2):821-828.
[5]Golden N,Darmadipura S,Bagiada NA.The difference in seizure incidences between young and adult rats related to lipid peroxidation after intracortical injection of ferric chloride[J].Singapore Med J,2010,51(2):105-109.
[6]Willmore LJ,Hiramatsu M,Kochi H,et al.Formation of superoxide radicals after FeCl3 injection into rat isocortex[J].Brain Res,1983,277(2):393-396.
[7]Pitkanen A,McIntosh TK.Animal models of post-traumatic epilepsy[J].J Neurotrauma,2006,23(2):241-261.
[8]张高炼,黄建敏,赵邦,等.外伤性癫痫大鼠前脑PSD-95的动态表达[J].中国神经精神疾病杂志,2010,36(8):498-500.
[9]Cahalan MD.STIMulating store-operated Ca(2+)entry[J].Nat Cell Biol,2009,11(6):669-677.
[10]Skibinska-Kijek A,Wisniewska MB,Gruszczynska-Biegala J,et al.Immunolocalization of STIM1 in the mouse brain[J].Acta Neurobiol Exp(Wars),2009,69(4):413-428.
[11]Klejman ME,Gruszczynska-Biegala J,Skibinska-Kijek A,et al.Expression of STIM1 in brain and puncta-like co-localization of STIM1 and ORAI1 upon depletion of Ca(2+)store in neurons[J].Neurochem Int,2009,54(1):49-55.
[12]Spassova MA,Soboloff J,He LP,et al.STIM1 has a plasma membrane role in the activation of store-operated Ca(2+)channels[J].Proc Natl Acad Sci U S A,2006,103(11):4040-4045.
[13]Cano-Abad MF,Herrera-Peco I,Sola RG,et al.New insights on culture and calcium signalling in neurons and astrocytes from epileptic patients[J].Int J Dev Neurosci,2011,29(2):121-129.
[14]Steinbeck JA,Henke N,Opatz J,et al.Store-operated calcium entry modulates neuronal network activity in a model of chronic epilepsy[J].Exp Neurol,2011,232(2):185-194.Ma CY,Xue YJ,Li M,et al.Sodium valproate for prevention of early posttraumatic seizures[J].Chin J Traumatol,2010,13(5):293-296.
[15]Gasperini R,Choi-Lundberg D,Thompson MJ,et al.Homer regulates calcium signalling in growth cone turning[J].Neural Dev,2009,4(29):1-18.

