高压酶解大米蛋白抗氧化活性及其分子质量分布
王章存 崔胜文 袁道强 赵学伟 安广杰 李乐静
(郑州轻工业学院食品与生物工程学院,郑州 450002)
蛋白质酶解后产生的小分子肽不仅更容易被人体吸收,还具有不同的生物活性[1],如提高免疫力、抗氧化、抗疲劳、止疼、镇静等,甚至在化妆品中也有很大的的应用潜力。其中抗氧化活性肽因有利于对预防和治疗自由基诱发的各种疾病而备受关注[2]。
大米蛋白是公认的优质植物蛋白,不仅氨基酸组成合理,还具有抗糖尿病、抗胆固醇等重要的保健功能[3]。大米蛋白酶解物也表现出良好的抗氧化活性[2,4]。因此,开发利用大米蛋白质资源具有重要意义。通过传统的碱溶酸沉法直接从大米胚乳中提取蛋白质有一定的经济局限性[5]。大米淀粉糖生产中有大量的副产品——俗称米渣蛋白,但因在淀粉糖生产中,大米蛋白受到了高温处理而发生了聚集作用,在水中的溶解性较差,常规酶解方法也只能使约50%的大米蛋白溶解[5]。
大量研究表明,高压处理可以改变蛋白质颗粒的聚集状态和高级结构,从而影响蛋白质的功能性质,也影响蛋白质的酶解模式[6-8]。例如,胃蛋白酶难以水解 β-乳球蛋白(β-Lg),但 β-Lg经过200 MPa高压处理后很容易被该酶水解[9];经600 MPa处理后,可在1 min内被水解成1 500 u以下的小分子[10]。卵清蛋白经200 MPa高压处理后,用胰凝乳蛋白酶水解可加速释放具有降血压作用的3种活性肽[11]。大豆蛋白经400 MPa处理20 min后,其碱性蛋白酶水解抗氧化活性均高于未高压处理的酶解物[12]。
高压处理也可改变大米蛋白的结构,并提高其溶解性[13]。本试验研究大米蛋白经不同高压预处理后再用碱性蛋白酶水解所得产物的抗氧化活性,用正交试验法优化了酶解条件,并分析了酶解产物的分子质量分布等,为大米蛋白活性肽的进一步分离纯化和构效关系研究提供参考。
1 材料和方法
1.1 材料和试剂
大米分离蛋白(凯式定氮法测定其粗蛋白质量分数75.6%):湖北汉科生物科技公司;碱性蛋白酶Alcalase 2.4L:诺维信公司;其他试剂为分析纯。
1.2 主要仪器
UHP900×2-Z高压设备:包头文天科技公司;LC600高效液相色谱仪、UV8100B紫外可见光分光光度计:Lab-Tech公司;TSK gel G2000 SWXL凝胶色谱柱(7.8×300 mm):日本TOSOH公司。
1.3 方法
1.3.1 样品高压处理
分别准确称取大米蛋白10.0 g悬浮于100 mL的pH 8.0水溶液中,装入两层聚乙烯塑料袋(8 cm×10 cm)中真空密封(不留顶隙),置于高压装置内腔,浸没于加压介质中,于25℃、压力300、500 MPa下分别处理10 min。升压、降压均在1 min内完成。
1.3.2 酶解试验
在高压处理后的样品(pH 8.0)中加入碱性蛋白酶Alcalase后,单因素试验确定反应因素及其水平后,再按照正交试验(表1)的条件反应,其间滴加1 mol/L NaOH溶液维持pH的稳定。反应结束后,于100℃沸水浴中灭酶10 min,2 000 r/min离心10 min,将上清液适当稀释后测定其还原能力。
1.3.3 还原能力的测定
参考 Oyaizu 方法[14],并略做修改。用pH 6.6 磷酸盐缓冲液稀释成不同浓度梯度,各取1 mL不同浓度的大米蛋白水解物,分别加入2.5 mL,pH 6.6磷酸盐缓冲液,2.5 mL 1%铁氰化钾,混合后于50℃恒温20 min,再加入 2.5 mL 10% 三氯乙酸,然后3 000 r/min离心10 min,取上层清液加2.5 mL蒸馏水和0.5 mL的0.1%FeCl3溶液。混匀后于700 nm处测定吸光度值。每一样品进行3次重复。吸光值越高,表明酶解物的还原性越强。
1.3.4 酶解物分子质量测定
采用高效液相色谱法分析。色谱柱TSK gel G2000 SWXL(7.8 ×300 mm);流动相为乙腈∶水∶三氟乙酸(TFA)=45∶55∶0.1,检测波长 220 nm,柱温25℃;流速1.0 mL/min,上样量10μL。以标准品细胞色素C(M r 12 500),抑肽酶(M r 6 500),杆菌酶(M r 1 450),乙氨酰-乙氨酰-酪氨酰-精氨酸(M r 451)和乙氨酰-乙氨酰-乙氨酸(M r 189)做分子质量校正曲线。
1.3.5 数据统计
应用SPASS软件对数据进行处理。
2 结果和讨论
2.1 酶解条件的优化
对3种不同高压处理的大米蛋白分别进行不同底物浓度(A)、反应温度(B)、加酶量(C)和反应时间(D)的单因素酶解试验。在此基础上,采用L9(34)正交试验及相应的因素和水平(表1)进行试验,测定了不同压力处理和酶解条件下酶解物的抗氧化活性(此处以还原力表示)。试验结果如表2所示。
通过分析可知,经过不同压力处理的大米蛋白在相同酶解条件下制备的酶解物不仅还原力大小不同,而且随着酶解条件的变化,还原力变化趋势也有差异。极差分析表明,未经高压处理的大米蛋白酶解时,影响酶解物还原力大小的主次因素依次为CABD(即加酶量、反应温度、反应时间和底物浓度),经300、500 MPa高压处理者的主次因素分别依次为CDAB、CABD。上述结果表明,高压处理影响了大米蛋白的结构,进而影响了它的酶解特性,因而相同条件下产生不同的多肽分子。这与文献中其他蛋白高压处理后的酶解特点有相似性[8,10]。

表1 因素和水平表
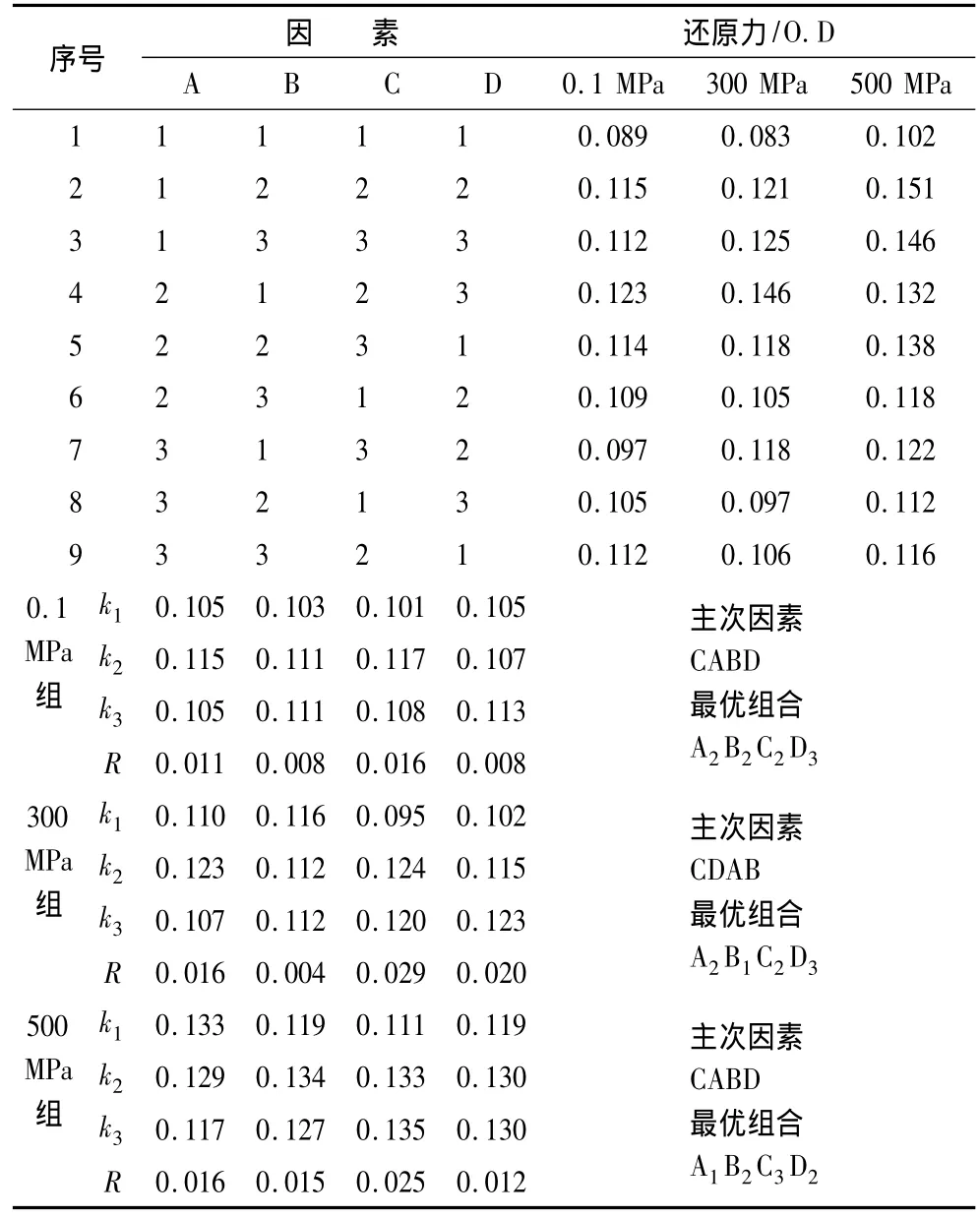
表2 正交试验L9(34)及结果
统计结果显示,未高压处理大米蛋白的最佳酶解条件组合A2B2C2D3,即料液底物质量分数5%,反应温度55℃、加酶量1%、反应时间120 min,在此条件下制备的大豆蛋白酶解物的还原力达到0.125。同理,经过300、500 MPa高压预处理大米蛋白的酶解最佳条件组合分别为A2B1C2D3和A1B2C3D2,在该条件下的放大试验的酶解物还原力结果分别为0.149和0.158,均高于正交试验表中的相应处理的最大值,表明优化条件可靠。
2.2 分子质量分布
为了探讨大米蛋白肽抗氧化活性的分子基础,将前述优化条件下的酶解物用高效液相色谱进行分离(图1)。可知,不同酶解物的分子质量范围差别不大,如最大分子质量均为14.3 ku,最小分子质量为300 u。不同分子质量组分的相对含量却明显不同(表3)。未高压处理的对照组中,10~15 ku、1~10 ku和1 ku以下等3段分子质量组分所占比例分别为26.6%、46.9%、26.5%;300 MPa 预处理组中3 段分子质量组分的质量分数分别为16.5%、39.3%和44.2%;500 MPa组中的质量分数分别为11.8%、33.1%和55.1%;其分子质量大小与作者前期研究高压处理更利于大米蛋白酶解的结论相吻合[12]。结合其还原力结果的分析表明,不同处理条件下大米蛋白酶解物的还原力大小与其分子质量的分布之间有明显的关联性,即3种酶解条件下随着小分子肽含量的比例增加,抗氧化活性也增大。这与文献中其他蛋白的酶解现象有相似之处[15-16]。据报道,多种蛋白的酶解物中小分子质量肽的抗氧化活性均比大分子组分的活性高,如小麦面筋蛋白中性蛋白酶物3 ku以下小麦肽[15]、大豆蛋白酶解物中5 ku以下的大豆肽[16]等组分具有较高的抗氧化活性。

图1 不同压力条件预处理大米蛋白酶解物的HPLC分析图谱

表3 不同压力预处理酶解物的分子质量分布及其相对含量
3 结论
研究表明,高压预处理大米蛋白有利于酶解产生更高抗氧化活性的大米肽,300 MPa和500 MPa处理者活性分别比未处理者提高19.2%和26.4%。当酶解条件变化时,不同压力预处理者酶解物活性的变化趋势也不一致,反映了其活性肽组分之间的差异。HPLC分析显示,经300 MPa和500 MPa高压处理后的酶解物中分子质量1 ku以下小肽的相对含量分别为44.2%和55.1%,而未高压处理者该组分只有26.5%,可见,高压处理有利于大米蛋白酶解产生小分子的活性肽。
[1]张美莉,侯文娟,杨立风.植物蛋白源生物活性肽的研究进展[J].中国食物与营养,2010(11):33-36
[2]曹辉,马海乐,曲文娟,等.大米蛋白的木瓜酶酶解及其水解物的抗氧化活性[J].中国粮油学报,2009,24(7):10-13
[3]Morita T,Akira OH,Kaori T,et al,Cholesterol- lowering effects of soybean,potato and rice proteins depend on their low methionine contents in rats fed a cholesterol-free purified diet[J].The Journal of Nutrition,1997,127(3):470 -477
[4]张君慧,张晖,姚惠源.大米蛋白酶解产物抗氧化活性及功能性质研究[J].食品工业科技,2008,29(5):73 -76
[5]王章存,申瑞玲,姚惠源.大米蛋白研究进展[J].中国粮油学报,2004,19(2):11 -15
[6]Delgado A,Rauh C,Kowalczyk B,et al.Review of modelling and simulation of high pressure treatment of materials of biological origin[J].Trends in Food Science & Technology,2008,19:329 -336
[7]Marchal S,Torrent J,Masson P,et al.The powerful high pressure tool for protein conformational studies[J].Brazilian Journal of Medical and Biological Research,2005,38:1175 -1183
[8]Quiros A,Chichon R,Recio I,et al.The use of high hydrostatic pressure to promote the proteolysis and release of bioactive peptides from ovalbumin[J].Food Chemistry,2007,104:1734-1739
[9]Izquierdo FJ,Alli I,Gomez R.Effects of high pressure and microwave on pronase andα-chymotrypsin hydrolysis ofβlactoglobulin.Food Chemistry,2005,92:713 -719
[10]Zeece M,Huppertz T,Kelly A.Effect of high - pressure treatment on in-vitro digestibility ofβ -lactoglobulin.Innovative Food Science and Emerging Technologies,2008,9:62-69
[11]Van der Plancken I,Maxime D,Indrawati,et al.Kinetic Study on the Changes in the Susceptibility of Egg White Proteins to Enzymatic Hydrolysis Induced by Heat and High Hydrostatic Pressure Pretreatment.Journal of Agricultural and Food Chemistry,2004,52:5621 -5626
[12]王章存,徐贤.超高压处理对大豆蛋白酶解物的影响.中国酿造,2009,(2):132 -134
[13]王章存,崔胜文,赵学伟,等.高压处理对大米蛋白溶解性及其分子特征的影响.中国粮油学报,2012,27(6):1-4
[14]Oyaizu M.Studies on products of browning reactions:antioxidant activities of products of browning reaction prepared from glucose a mine[J].Japanese Journal of Nutrition,1986,44:307 -315
[15]林琳,崔凤杰,闫桂强.不同分子质量小麦面筋蛋白酶解多肽的分离及其抗氧化活性研究.粮食与饲料工业,2010,(8):34 -36
[16]邓成萍,薛文通,孙晓琳.不同分子质量段大豆多肽功能特性的研究.食品科学,2006,27(5):109-112

