麦苗中阿魏酸、抗坏血酸(VC)、总黄酮协同抗氧化能力分析
张志清 向建军 周利茗 蒲 彪
(四川农业大学食品学院,四川雅安 625014)
麦苗作为一种中国传统的中草药,其功效在《本草纲目》《得配本草》《伤寒类要》等中国传统医学典籍中都有详细记载[1]。现代医学研究表明,麦苗有减肥、降脂、抗氧化、抗炎症、抗溃疡、降低胆固醇、降血糖、抗皮肤过敏等重要功效[2-3]。国外对麦苗的开发与利用从19世纪开始,美国人安·威格摩尔创立了以麦苗为主的“生食疗法”。近年来麦苗作为功能食品的研究在我国逐渐得到关注[4]。研究表明,麦苗中含有多种人体必需的氨基酸,丰富的抗氧化成分,如VC、VE、黄酮化合物、多酚等,表现出较高的抗氧化活性[5]。施瑛等[6]采用亚油酸法测得麦苗抗氧化活性分别是BHT、α-生育酚的4.9倍和7.2倍;黄嘌呤氧化酶法测得其SOD活性是葡萄的7倍,并且有一定的GSH-Px活性和自由基清除活性。
抗氧化协同效应是指通过对不同抗氧化物之间进行优选和配方处理,可以获得比单一抗氧化剂高得多的抗氧化能力,提高生物体的氧化稳定性[7]。Tappel等[8]在1962年对VC和VE协同作用的研究中就提出了VC再生VE的观点。王岳飞等的研究表明不同浓度的茶多酚和西洋参之间存在一定的协同增效作用[9]。刘中立等[10]证实了茶多酚与VE的协同抗氧化。普遍存在于麦苗中的阿魏酸、黄酮物质、抗坏血酸都有较高的抗氧化活性,但是这3种抗氧化活性物质在小麦中的协同抗氧化研究依然鲜见。本研究根据麦苗中3种抗氧化组分含量测定数据为基础,通过标准品配置不同浓度的标准溶液,模拟含量水平相互复配组合,分析抗氧化能力,以期研究麦苗中各组分的协同抗氧化作用,了解麦苗的抗氧化活性特点,为麦苗的开发利用提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
小麦品种川麦107,叶片采样按小麦苗生长期计,每次取样10~15株。
反式阿魏酸(Ferulic Acid,FA,纯度 >99%);抗坏血酸(Ascorbic Acida,AA,纯度 >99.9%:德国SIGMA-ALDRICH公司;芦丁(总黄酮测定对照,纯度 >99.9%);DPPH,ABTS(纯度≥99.0%):成都杰锐生物科技有限公司分装。
LC-10A高效液相色谱仪(配紫外检测器):日本岛津公司Milli-Q型纯水仪:美国密理博公司。
1.2 试验方法
1.2.1 麦苗中3种抗氧化组分的测定方法
分别测定小麦叶片中阿魏酸,抗坏血酸,以及总黄酮在2011年1月~3月中总共10个时期(采样次数)的含量,抽穗后停止采样。
抗坏血酸测定采用GB/T 5009.86—2003中2,4-二硝基苯肼法[11];总黄酮含量采用乙醇超声提取,360 nm处吸光度[12];阿魏酸含量采用高效液相色谱法进行测定[13]。
1.2.2 抗氧化活性测定方法
参考郭文莉等[14]和 Roberta 等[15]的方法,采用DPPH法和ABTS法分别测定单一组分以及组配混合物的抗氧化活性。
麦苗汁总抗氧化活性测定取新鲜麦苗20 mg于离心管中,按上述方法测定DPPH·和ABTS+·清除率,分析麦苗汁总抗氧化活性。同时,将浓度为40、60、80、100、120、160、200 μg/mL 抗坏血酸标准液作为抗氧化活性的阳性对照。
1.2.3 协同抗氧化能力的分析
1.2.3.1 单一组分的抗氧化活性的测定
分别配制浓度为 1、2、4、6、8 μg/mL 的抗坏血酸、芦丁、阿魏酸标准溶液,按1.2.2分别测定抗氧化活性。
1.2.3.2 两组分间的协同抗氧化活性的测定
每种抗氧化物质取3个浓度:1、2、4μg/mL,每两种物质之间3种浓度两两组合,配制复合溶液,按1.2.2测定复合溶液的抗氧化活性。
1.2.3.3 3 组分间的协同抗氧化活性
对抗坏血酸、芦丁、阿魏酸分别取1、2、4μg/mL 3个浓度水平进行三因素三水平的析因设计试验,考察组合溶液对DPPH·的清除率。
上述试验每组平行测定3个样品,通过SPSS 18.0分析软件对试验结果进行直接比较分析、析因分析和回归分析,结合1.2.2对麦苗汁总抗氧化活性测定结果分析3组分间的协同抗氧化活性。
2 结果与分析
2.1 小麦苗中3种抗氧化组分在不同时期含量变化
本研究测定分析了在1月~3月小麦叶片中的阿魏酸,抗坏血酸,以及总黄酮的含量及变化趋势(图1)。结果表明,总黄酮含量明显高于阿魏酸和抗坏血酸含量,平均达到773.78 mg/100 g,其变化范围在676.37 ~855.77 mg/100 g波动,其变化趋势是先增加,在2月中旬有所降低,随后在3月中旬到达最高,其原因可能与各类黄酮类物质间转换有关。在2~3月期间,田间温度迅速回升,有利于麦苗生物产量的增加和功能物质的积累,表明总黄酮可能是小麦苗中主要的抗氧化成分。
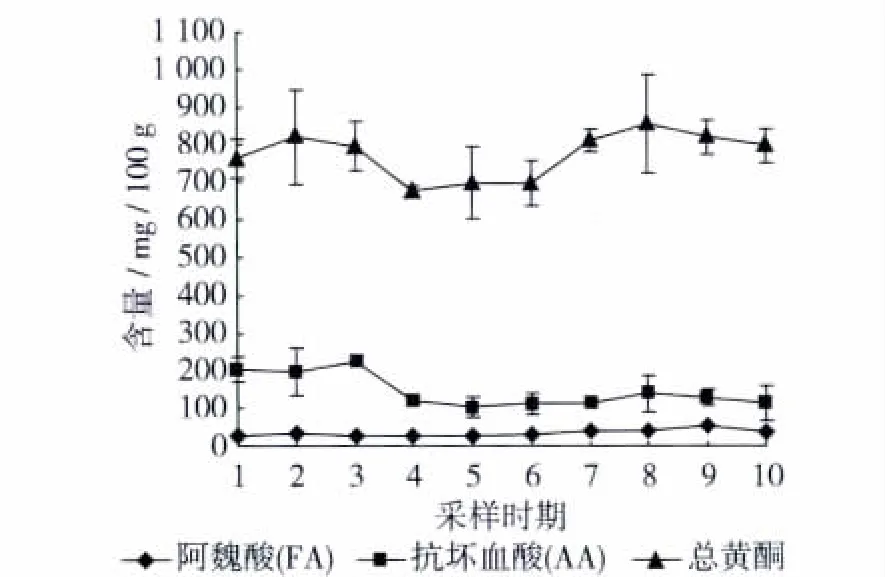
图1 麦苗中阿魏酸(FA),抗坏血酸(AA),总黄酮含量变化
在3种物质中,阿魏酸平均含量最低,仅为34.07 mg/100 g(变幅 25.9 ~52.4 mg/100 g),而且随苗期变化幅度较小,呈缓慢增加。阿魏酸是近年来研究较多的抗氧化物质,在多种植物中均存在,但是本研究中小麦苗阿魏酸含量较低。抗坏血酸平均含量 146.51 mg/100 g,最高为 226.29 mg/100 g,此时期为幼苗期(2月初)田间尚未拔节和分蘖,柔嫩的小麦叶片中抗坏血酸含量较高,随着生育期延长,麦苗中纤维素、木质素增加,其抗坏血酸含量降低,最低仅为 104.02 mg/100 g。
2.2 麦苗汁的抗氧化活性
称取25 mg新鲜麦苗于10 mL离心管中,用玻璃棒捣碎后加入DPPH·或ABTS+·反应体系7或20 mL,然后测定滤液的吸光值。由于吸光度较大清除率DPPH清除率在80% ~90%之间,而ABTS+·清除率接近100%,无法以浓度梯度计算其IC50值。因此试验将麦苗汁用超纯水稀释定容至50 mL,然后测定量效关系,分别取 1、2、4、5、6、8 mL 样品溶液用蒸馏水定容于10 mL容量瓶中,然后分别用DPPH和ABTS测定法其抗氧化活性,结果见图2。同法测定麦苗汁在10个不同时期的抗氧化能力(图3)。
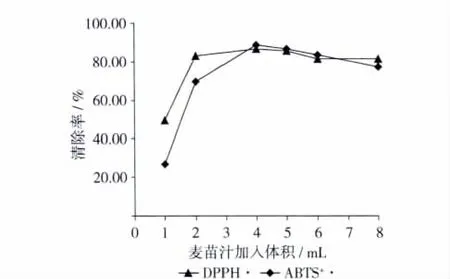
图2 麦苗汁稀释液抗氧化性的量效关系变化

图3 不同采样时期麦苗汁抗氧化活性
从图2可以明显的看出,随着所用麦苗汁稀释液体积的加大,其抗氧化能力明显加强,呈现出一定的量效关系,但线性关系不明显。当反应液中麦苗汁体积为2 mL DPPH·清除率即达到83.23%,此时ABTS+·的清除率也达到了69.49%,表现出较强的抗氧化活性,随着麦苗汁稀释液的体积的增加在4 mL时,抗氧化活性达到最大值,此时清除率分别为86.45%和88.63%。对比抗坏血酸标准液对DPPH·和ABTS+·的清除率(表1)可知,20 mg的麦苗制成的麦苗汁稀释液4 mL对DPPH·和ABTS+·的清除率就可达80%以上,相当于200μg/mL的抗坏血酸2 mL(即0.4 mg)抗坏血酸对DPPH·和ABTS+·的清除率,说明麦苗汁具有较强的抗氧化能力。

表1 抗坏血酸标准液对DPPH·和ABTS+·的清除率
按上述方法将10个采样时期的20 mg新鲜小麦叶片榨汁,稀释并以2 mL加入反应体系中。麦苗汁随生长周期的变化清除DPPH·和ABTS+·的变化趋势表明(图3),麦苗汁清除DPPH·能力随小麦苗生长周期的变化而呈上升趋势,麦苗汁ABTS+·清除率变化趋势较DPPH·清除率上升趋势不明显,仅从1月底的81.20%上升到3月底(第10次采样)94.74%,增加幅度为13.54%。而ABTS+·的清除率则从1月底的43.90%,急剧增加到92.14%,其在小麦苗期,表现出较强的抗氧化活性,其平均ABTS+·和DPPH·清除率分别达到90.76%和74.34%。
2.3 小麦苗中3种抗氧化组分的协同抗氧化作用分析
为了解苗期小麦叶片中3种抗氧化组分对抗氧化活性的协同作用特点,本研究用抗坏血酸、阿魏酸、芦丁3种标准物质对协同抗氧化能力进行分析。并结合上述麦苗汁抗氧化分析结果,采用直观分析、析因分析和回归分析研究组分间的协同作用。
2.3.1 单一组分的抗氧化活性分析
由图4可知,单一组分具有较高的抗氧化能力,且抗氧化能力与浓度呈正相关。在低浓度时,芦丁对DPPH·的清除率比相同浓度的抗坏血酸和阿魏酸要强,对ABTS+·的清除率强于抗坏血酸,但比阿魏酸要弱;随着浓度的增加,抗坏血酸对DPPH·的清除率增大,且要强于芦丁和阿魏酸;随着浓度的变化,阿魏酸对ABTS+·的清除率始终强于抗坏血酸和芦丁,当质量浓度为 8.0 μg·mL-1时,其对ABTS+·的清除率达到86.24%,但其对DPPH·的清除率则较低。抗坏血酸的清除能力在质量浓度大于2.5μg·mL-1时逐渐比芦丁强,这可能与它们的结构以及抗氧化机理有关,不同抗氧化剂提供氢的羟基位置不同,其活泼程度不同,所以抗氧化性能不同。

图4 各组分对DPPH·和ABTS+·的清除率
2.3.2 组分间的协同抗氧化活性分析
分别配制1、2、4 μg·mL-1的 3种不同抗氧化剂,并且两两组合为混合溶液,应用DPPH法和ABTS法测其抗氧化能力,结果如表2所示。由表2可知,抗坏血酸与芦丁的混合溶液对DPPH·和ABTS+·的清除率均比单一组分清除率之代数和低,但大于各单一组分清除率。因此,抗坏血酸与芦丁具有协同抗氧化作用。当抗坏血酸浓度不变时,组合溶液对自由基的清除率与芦丁的浓度呈正相关变化。当芦丁浓度不变时,复配溶液对自由基的清除率与抗坏血酸的浓度未呈现明显相关性。由此可知,芦丁对总抗氧化能力的作用大于抗坏血酸。
抗坏血酸与阿魏酸的混合溶液对DPPH·和ABTS+·的清除率均比单一组分清除率的代数和高,即抗坏血酸与阿魏酸的协同抗氧化活性大于其单一组分之和。但是当抗坏血酸浓度较高时,抗坏血酸与阿魏酸的混合液对DPPH·的清除率略小于单一组分代数和,但均大于各单一组分对DPPH·的清除率。当阿魏酸或抗坏血酸的浓度不变时,混合液对自由基的清除率随抗坏血酸或阿魏酸的浓度升高而升高。可见,抗坏血酸与阿魏酸的组合溶液的协同抗氧化性比抗坏血酸与芦丁溶液组合的协同抗氧化性高。
表2表明,除当阿魏酸质量浓度为1μg·mL-1的复配溶液对ABTS+·清除率大于单一组分清除率的代数和外,阿魏酸与芦丁的复配溶液对DPPH·和ABTS+·的清除率均小于其单一组分清除率之代数和,但均大于各单一组分的清除率。即阿魏酸与芦丁具有协同抗氧化作用。同时,当一种组分浓度不变时,复配溶液对自由基清除率与另一组分浓度的呈正相关变化。阿魏酸浓度变化对抗氧活性的影响大于芦丁的影响,即阿魏酸对抗氧化能力的作用大于芦丁。综上表明,相同浓度下,3种组合中阿魏酸与抗坏血酸的复配溶液对自由基的清除率最大,其次是阿魏酸与芦丁的复配溶液,最后是抗坏血酸与芦丁的复配溶液。

表2 不同抗氧化剂组合溶液对DPPH·和ABTS+·的清除作用
分别配制1、2、4μg/mL的抗坏血酸、芦丁、阿魏酸标准组合溶液,测其抗氧化能力,结果如表3所示。当两种组分浓度不变时,复配组分对自由基的清除率与第3种组分的浓度呈正相关;当芦丁质量浓度为1μg/mL时,复配组分对DPPH·和ABTS+·的清除率小于各单一组分清除率之代数和;当芦丁质量浓度为2和4μg/mL时,复配组分对DPPH·和ABTS+·的清除率均大于各单一组分清除率之代数和,说明芦丁在高浓度时,其协同抗氧化能力更强。复配组分对自由基的清除率均大于单一组分的清除率,说明抗坏血酸、阿魏酸、芦丁之间存在协同抗氧化效应。根据试验结果,当抗坏血酸、阿魏酸、芦丁的质量浓度均为4μg·mL-1时,复配组分对DPPH·和ABTS+·的清除率达到最大,分别为52.86%和76.47%,当抗坏血酸、阿魏酸、芦丁的质量浓度分别为 1、1、4 μg·mL-1时,3 组分对 DPPH·的清除率比单一组分代数和的清除率提高62.9%;当抗坏血酸、阿魏酸、芦丁的质量浓度分别为 2、2、4 μg·mL-1时,3组分对ABTS+·的清除率比单一组分清除率代数和提高8.9%。对比两两组合的复配溶液,相同浓度下,3组分混合液对自由基的清除率有明显提高,即3种物质的协同抗氧化能力大于其中任何两种抗氧化物质的组合。
2.3.3 组分间的协同抗氧化活性的析因分析
本研究对3标准组分的抗氧化能力及协同抗氧化能力采用析因设计,该法可检验每个因素各水平间的差异,以及各因素间的交互作用[16]。每组分取3 个水平:1.0、2.0、4.0 μg·mL-1,每个组合重复 2次,对结果采用SPSS软件进行处理,方差分析结果如表4所示。由表3可知,3组分的 P=0.000<0.05,说明3组分的浓度不同,抗氧化能力的大小也不同;对于一阶交互效应,3者的 P=0.000<0.05,说明3组分间两两之间均存在交互作用,两两之间均对彼此的抗氧化能力存在显著影响;对于二阶交互效应,P=0.000<0.05,说明3组分存在显著的交互作用。
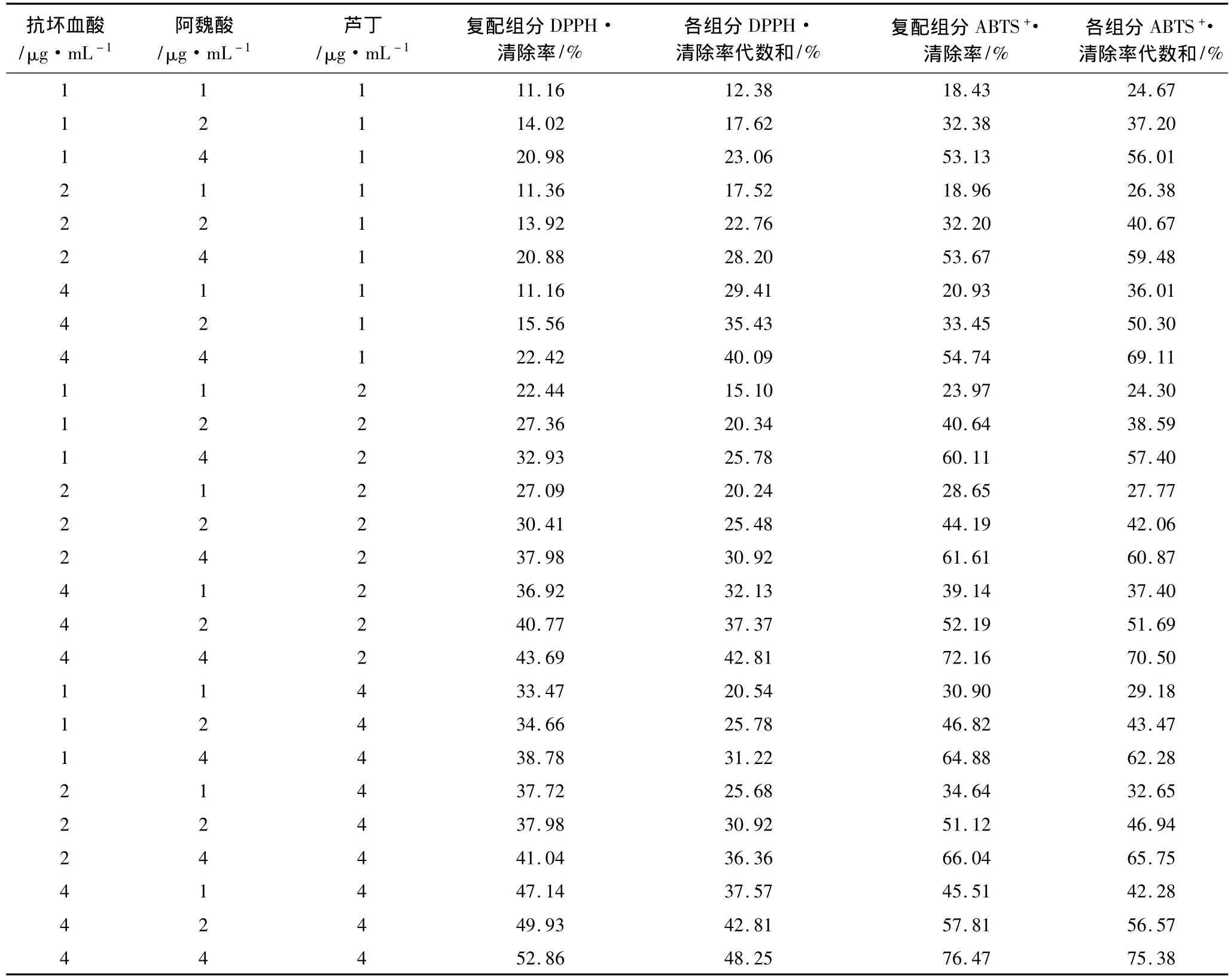
表3 3组分组合对DPPH·和ABTS+·的清除作用

表4 析因试验结果方差分析表
2.3.4 组分间的协同抗氧化活性的回归分析
以混合物对DPPH·的清除率为因变量Y,抗坏血酸、阿魏酸和芦丁的浓度为自变量X1、X2和X3,采用SPSS软件对数据进行逐步回归分析。模型输出结果如表5所示。随着自变量被逐步引入回归方程,回归方程的相关系数R和决定系数R2在逐渐增大,说明引入的自变量对总清除率的作用在增加。其中决定系数R2=0.830,则剩余因子=0.312,该值较大,说明对清除率有影响的自变量不仅有以上3种物质,还有一些影响较大的因素没有考虑到,还有待于进一步研究。
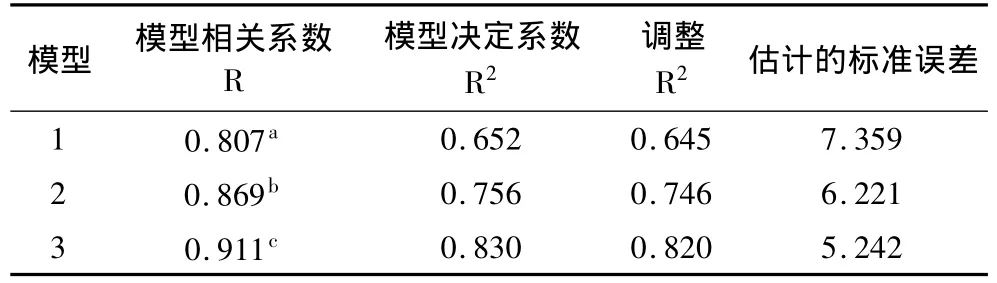
表5 逐步回归模型分析
用spss软件对模型进行回归分析表明,线性回归方程为:y= -1.879+3.167x1+2.673x2+7.920x3。自变量x1、x2、x3对 Y的作用的标准回归系数分别是:P1y=0.323,P2y=0.272,P3y=0.807,即 3 种物质对总清除率的影响大小是:芦丁﹥抗坏血酸﹥阿魏酸。即芦丁对总抗氧化能力的贡献率最大,抗坏血酸次之,阿魏酸最小。显著性检验结果表明,x1、x2、x3的偏回归系数的显著性均小于0.05,说明自变量与因变量之间存在显著性差异。经偏回归系数的显著性检验表明,3者之间存在着极显著地交互作用(P<0.01),即3者有着显著地协同抗氧化作用。
3 讨论
已有研究表明[17-19],麦苗中抗坏血酸、阿魏酸、总黄酮的含量分别为 168.41、37.6、770.0 mg/100 g,三者含量比约为22∶5∶1,综合以上结论分析,麦苗对DPPH·的清除率将在30%左右,而对ABTS+·的清除率将在60%左右。因此,麦苗中的抗氧化组分具有协同抗氧化作用,且抗氧化能力较高。
抗氧化活性大小与抗氧化剂分子中酚羟基数目及新生成自由基的稳定性呈正相关。不同抗氧化剂提供氢的羟基位置不同,其活泼程度不同,所以抗氧化性能不同。不同抗氧化剂复配使用时,其抗氧化效果优于单独一种抗氧化剂的抗氧化效果,这是因为两种或两种以上的抗氧化剂复配使用时,各种抗氧化剂在抗氧化之后,产生的游离基会相互作用生成新的酚类化合物,继续发挥抗氧化作用,使其抗氧化性能得以增强[20]。1962年,Tappel率先开展了VE与VC间协同作用的研究,并提出了VC再生VE的观点。除此之外,其它抗氧化剂间的协同作用也有文献报道如儿茶素与VC、VE共同使用对猪油抗氧化有明显的协同增效作用[21]。
抗氧化的机理研究表明,抗氧化剂作用机理并不完全相同。有的提供质子,捕获自由基,而本身形成稳定的共振结构而阻断氧化(如黄酮类化合物);有的与氧作用而消耗密闭系统中残留的氧(如VC及其盐类);有的可与金属离子形成螯合物,减少金属离子对氧化作用的催化活性(如柠檬酸、植酸等);有的能破坏单旋态氧(1O2)而抑制光氧化的进行(如胡萝卜素)等等。如将这些具有不同抗氧化性能的物质混合在一起,抗氧化的整体效果自然要增强。另外,不同抗氧化剂共同使用时,抗氧化剂自由基之间可能互相还原,使抗氧化剂再生[21]。因此,协同抗氧化作用既不是各种抗氧化剂抗氧化作用的简单加合,也不是它们的相乘关系,而是各种抗氧化剂在抗氧化作用不同方面发挥作用,从而从整体上表现为抗氧化效果大大增强。
4 结论
本研究结果表明,阿魏酸与抗坏血酸的复配溶液对自由基的清除率最大,其次是阿魏酸与芦丁的复配溶液,最后是抗坏血酸与芦丁的复配溶液。对3组分进行协同抗氧化能力分析,发现3者间存在显著的协同抗氧化性,回归分析表明,3组分中芦丁对总抗氧化能力的贡献率最大,抗坏血酸次之,阿魏酸最小。利用3种物质的抗氧化协同作用并不能完全的解释麦苗较强的抗氧化活性,说明麦苗的抗氧化性受多种组分的影响,需要考察更多的组分,以了解其抗氧化特点。
[1]林宣贤,林升清,廖惠珍.麦苗的营养成份及安全性实验[J].中医药信息,1996,(4):47 -48
[2]乔文静.麦苗的营养及制品研究[J].中国食物与营养,2009,7:59 -61
[3]Kulkarni SD,Tilak J C,Acharya R,et al.Evaluation of the antioxidant activity of wheatgrass(Triticum aestivm L)as a function of growth under different conditions[J].Phototherapy Research,2006,20(3):218 -227
[4]黄碧光,刘思衡.麦苗的营养保健价值及其开发利用[J].食品研究与开发,2001,22(5):40-42
[5]王永辉,李培兵,金宏,等.小麦草营养成分分析[J].营养学报,2011,33(3):327 -238
[6]施瑛,汪梅,徐娟,等.麦苗汁的营养成分及其抗氧化活性测定[J].食品科学,2005,26(1):215-218
[7]卢静琼,石文平,靳利娥,等.天然抗氧化物抗氧化协同效应研究进展[J].食品工程,2009,(4):11 -13
[8]郝晓丽.七种抗氧化剂单一抗氧化活性及其协同作用的研究[D].青岛:青岛大学,2002
[9]王岳飞,李磊,谢争珍,等.茶多酚西洋参抗氧化活性比较及协同增效作用研究[J].中外医疗,2008,(29):68
[10]Jia Z S,Zhou B,Yang L,et al.Antioxidant synergism of tea polyphenols andα-tocopherol against free radical induced peroxidation of linoleic acid in solution[J].Journal of the Chemical Society,Perkin Transactions 2,1998,(4):911 -916
[11]中国预防医学科学院营养与食品卫生研究所.GB/T 5009.86—2003蔬菜、水果及其制品中总抗坏血酸的测定(荧光法和2,4-二硝基苯肼法)[S].北京:中国标准出版社,2003
[12]邓斌,蒋刚彪,黄红英,等.分光光度法测定夏枯草中总黄酮的含量[J].时珍国医国药,2008,19(7):1608-1609
[13]张志清,王潇,姚艳艳,等.超声波辅助碱醇提取HPLC法测定麦麸中阿魏酸含量[J].中国粮油学报,2010(4):96-99
[14]郭文莉,李敏,谢琼,等.葡萄皮色素抗氧化活性的初步研究[J].中国食品添加剂,2007,(2):116 -119.
[15]Roberta R,Nicoletta P,Anna P,et al.Antioxidant activity applying an improved ABTSradical cation decolorization assay[J].Free Radical Biology & Medicine,1999,26(9):1231-1237
[16]Douglas C Montgomery.实验设计与分析(第 6版)[M].北京:人民邮电出版社,2009:134-156
[17]刘仁杰,卢丞文,郭志军,等.不同生长期荞麦苗中总黄酮含量的变化研究[J].吉林农业科学,2007,32(6):58-60
[18]张志清,蒙昭,姚艳艳,等.小麦苗中阿魏酸含量变化分析[J].食品科学,2010,31(18):271-274
[19]向建军,姚艳艳,蒲至恩,等.小麦叶片中几种抗氧化组分的含量变化研究[J].中国粮油学报,2011,26(11):18-22
[20]陆云梅,黄华仁,夏仁学.红肉脐橙果实中抗氧化物质含量及其抗氧化活性变化[J].果树学报,2011,28(1):134-137
[21]李书国,李雪梅,陈辉,等.油脂复合抗氧化剂抗氧化协同增效作用的研究[J].粮油加工与食品机械,2004(4):42-44.

