洗心汤对散发性老年性痴呆大鼠脑内tau蛋白O-GlcNAc糖基化修饰的影响
第五永长, 田金洲, 时 晶
(1.陕西中医学院第一临床医学院,陕西咸阳712046;2.北京中医药大学第一临床医学院,北京100029)
蛋白质磷酸化和O位N-乙酰葡萄糖胺 (O-linked N-acetylglucosamine,O-Glc N Ac)糖基化修饰是蛋白质翻译后修饰的两种重要方式。近年研究表明,蛋白质的磷酸化和O-Glc N Ac糖基化之间负相关,两种修饰之间存在一种平衡机制[1],类似于中医的“阴”与“阳”,即存在着“阴阳调治”的关联[2]。神经微管蛋白tau出现异常过度磷酸化以至形成阿尔茨海默病 (Alzheimer's Disease)组织病理改变之一的细胞内神经原纤维缠结,与脑内tau蛋白磷酸化和O-Glc N Ac糖基化修饰之间的平衡被打破有密切关系[3]。
本实验研究了清代治疗痴呆名方洗心汤对散发性老年性痴呆大鼠脑内tau蛋白O-Glc N Ac糖基化修饰水平的影响[4],从而探讨其通过调节 OGlc N Ac糖基化修饰途径而抑制散发性老年性痴呆脑内tau异常磷酸化的可能机制,现报道如下。
1 材料与方法
1.1 动物及分组 SPF级健康雄性SD大鼠84只,体质量 (270±20)g,由第四军医大学实验动物中心提供 (实验动物合格证号:0034642)。所有大鼠随机分为假手术组、模型组、多奈哌齐组、洗心汤小剂量组、洗心汤中剂量组、洗心汤大剂量组,均饲养于屏障环境动物室 (使用许可证:SYXK【陕】2007-2010)。实验过程中自由摄食饮水,室温22℃ ~26℃,相对湿度40%左右。
1.2 主要药品与试剂 洗心汤:人参、半夏、茯神、附子、石菖蒲等中药组成,由999企业集团医药股份有限公司提供中药配方颗粒 (产品批号:0908032);链脲佐菌素 (Streptozotocin,STZ):Merck公司产品 (批号:K0050);多奈哌齐:由中美合资西安海欣制药有限公司生产 (产品批号:091201)。
琥珀酸化凝集素 (sWGA):EY Labs,San Mateo,CA产品。用于富集海马组织内O-Glc N Ac糖基化修饰的蛋白质。用western blot法富集时稀释倍数1∶400。
CTD110.6一抗:SantaCruz产品。用于检测海马组织内O-Glc N Ac糖基化修饰的tau蛋白。western blot稀释倍数1∶1 000。
RL2一抗:Pierce-ABR产品。用于检测海马组织内O-Glc N Ac糖基化修饰的tau蛋白。免疫组化染色时稀释倍数为1∶200,western blot稀释倍数1∶1 000。
1.3 侧脑室注射链脲佐菌素拟阿尔茨海默病模型制备 参考Sharma的方法[5],大鼠经10%水合氯醛麻醉后,固定于脑立体定位仪,常规消毒皮肤,颅骨正中矢状切口,分离骨膜,暴露硬脑膜。除假手术组外,均以微量注射器双侧侧脑室各注射STZ约18μL(注射前将STZ溶于人工脑脊液,质量浓度为25 mg/mL)。坐标参考《大鼠脑立体定向图谱》[6]。第3天重复注射,剂量同前。假手术组以等量人工脑脊液代替STZ。
1.4 给药方法 第二次造模21 d后给药治疗。在实验过程中以60℃双蒸水溶解稀释洗心汤颗粒,配成大、中、小不同剂量 [每29 g提取物相当于原方生药169 g,依据人与大鼠体表面积折算等效剂量,按生药计算的大鼠给药剂量,大剂量为30.42 g/(kg·d),中剂量为15.21 g/(kg·d),小剂量为7.61 g/(kg·d)],多奈哌齐给药量0.92 mg/kg,均按7.5 mL/(kg·d)灌胃。模型组及假手术组以等体积的双蒸水灌胃。各组均每日1次,共灌胃2个月。
1.5 脑组织样品处理 先采用Morris水迷宫试验法进行大鼠行为学测试[7]。内容包括:(1)定位航行实验:即从平台所在象限的相邻象限中选择一个入水点,将动物面向池壁放入水中,记录动物寻找并爬上平台所需时间即逃避潜伏期 (escape latency)及游泳距离。用于测量动物在水迷宫中的学习和记忆能力。(2)空间搜索实验:撤除平台,任选一个入水点将动物放人水中,测量120 s内动物在目标象限 (原平台所在象限)(targetquadrant)和其他各象限的游泳时间。用于测量动物对平台空间位置准确记忆,即记忆保持能力。行为学测试结束后,每组随机选取6只大鼠行灌注固定,然后断头并完整取出鼠脑,置于固定液中,24 h后行石蜡包埋切片。每只大鼠海马CA1区出现后连续冠状切片,放入0.01 mol/L PBST的溶液中进行免疫组化染色。Western-blot蛋白印迹检测取新鲜海马组织置液氮中速冻后保存于-70℃冰箱。
1.6 免疫组化染色 ①石蜡切片常规二甲苯脱蜡;②新鲜3%H2O2灭活内源性酶,蒸馏水冲洗;③将切片置于枸橼酸盐缓冲液 (pH6.0)中热修复抗原,PBS(pH7.4)冲洗;④滴加5%BSA封闭,37℃20 min,吸去多余液体;⑤滴加稀释的一抗,4℃过夜,PBS冲洗;⑥滴加相应的二抗,37℃孵育1 h,PBS冲洗;⑦滴加辣根过氧化物酶标记的链霉素卵白素工作液,37℃孵育1 h,PBS冲洗;⑧滴加DBA,室温下作用5~30 min;⑨苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片。
免疫组化染色结果分析:每只大鼠取相同位置脑片,以Motic Med 6.0数码医学图像分析系统采集图象和分析,记录每组图象中阳性细胞数、阳性细胞总面积和积分光密度值。
1.7 Western-blot蛋白印迹检测 ①提取大鼠海马蛋白质;②Folin酚法测定海马组织蛋白水平;③SDS—PAGE电泳;④转膜;⑤免疫反应 (分别加入按1∶1 000稀释后的相应二抗);⑥化学发光(吸干膜上的PBST,铺于干净的平皿中膜蛋白朝上,放入Syngene GBOX iChemi化学发光凝胶成像多功能系统的智能暗箱中,调好焦距,将发光液A和B两种试剂等体积混匀后,用移液器均匀加于膜上,充分接触后进行曝光)。利用多功能系统的图像采集和分析软件分析图像各条带的光密度值。
2 结果
2.1 行为学测试结果 在5 d的定位航行试验中,从第3天开始,多奈哌齐组,洗心汤小、中、大剂量组与模型组相比,平均逃避潜伏期及总游泳距离表现出显著性差异 (P<0.05,P<0.01)。第5天各治疗组与模型组相比,平均逃避潜伏期及总游泳距离均有显著性差异 (P<0.01)。在第6天撤除平台后的空间搜索试验中,与模型组相比,各治疗组在第一象限的活动时间明显延长 (P<0.05,P<0.01)。见表1、表2、表3。
表1 大鼠在定位航行试验中的平均逃避潜伏期比较 (±s)Tab.1 Comparison of average escape latency in place navigation experm iment of rats in each group(±s)

表1 大鼠在定位航行试验中的平均逃避潜伏期比较 (±s)Tab.1 Comparison of average escape latency in place navigation experm iment of rats in each group(±s)
与假手术组相比,**P <0.01;与模型组相比,△P<0.05,△△P <0.01;与多奈哌齐组相比,▲P <0.05
组 别 动物数/只 第1天/s 第2天/s 第3天/s 第4天/s 第5天/s假手术组 11 76.74±25.03 31.37 ±10.76 20.46±10.14 12.91 ±3.10 10.67 ±6.59模型组 12 94.69 ±7.01 88.98 ±26.02** 50.96 ±31.85** 47.43 ±30.50** 40.23 ±34.12**多奈哌齐对照组 12 78.92±24.19 66.95±26.47 27.99±17.48△ 28.26±25.97△ 15.62±13.58△△洗心汤小剂量组 11 69.09±41.59 60.99±28.91△ 25.89±20.46△ 23.62±11.16△ 16.75±13.30△△洗心汤中剂量组 11 56.54±19.81△ 40.69±19.14△△ 26.62±21.43△ 30.68±27.75△ 19.95±23.07△△洗心汤大剂量组 11 66.29±20.85△ 27.07±10.17△△▲ 19.84±11.89△△ 16.84±12.38△△ 11.19±7.98△△
表2 大鼠在定位航行试验中的游泳距离比较 (±s)Tab.2 Comparison of sw imm ing distance in the place navigation test of rats in each group(±s)

表2 大鼠在定位航行试验中的游泳距离比较 (±s)Tab.2 Comparison of sw imm ing distance in the place navigation test of rats in each group(±s)
注:与假手术组相比,*P<0.05,**P<0.01;与模型组相比,△P<0.05,△△P<0.01;与多奈哌齐组相比,▲P<0.05
组 别 动物数/只 第1天/cm 第2天/cm 第3天/cm 第4天/cm 第5天/cm假手术组 11 968.74±368.03 676.65±408.62 334.22±175.44 231.23± 22.87 179.15±105.79模型组 12 1 210.51±303.78 1093.50±498.43* 764.34±375.98** 748.82±376.27** 601.59±409.03**多奈哌齐对照组 12 1 063.38±407.53 755.59±348.04△ 451.88±272.12△ 408.39±244.89△ 247.31±224.99△△洗心汤小剂量组 11 822.28±544.56△ 665.53±493.53△ 328.29±173.62△△ 316.62±146.44△△ 260.75±215.79△△洗心汤中剂量组 11 742.90±313.50△ 529.96±329.79△△ 361.29±206.50△△ 461.85±387.99△ 307.56±310.55△△洗心汤大剂量组 11 968.91±400.43 422.41±204.95△△▲ 341.91±171.92△△ 252.18±123.28△△ 157.18±105.47△△
表3 各组大鼠空间探索试验第一象限活动时间比较 (±s)Tab.3 Comparison of sw imm ing time around the target quadrant of rats in each group(±s)

表3 各组大鼠空间探索试验第一象限活动时间比较 (±s)Tab.3 Comparison of sw imm ing time around the target quadrant of rats in each group(±s)
注:与假手术组相比,**P<0.01;与模型组相比,△P<0.05,△△P <0.01
组 别 动物数/只 第一象限活动时间/s假手术组11 59.49±8.57模型组 12 15.92 ± 6.16**多奈哌齐对照组 12 41.02±10.76△洗心汤小剂量组 11 39.91±13.97△洗心汤中剂量组 11 52.81± 4.30△△洗心汤大剂量组 11 56.45±5.32△△
2.2 western blot检测结果 western blot检测发现:模型组sWGA富集的O-Glc N Ac糖基化蛋白质明显低于假手术组 (P<0.01),同样,模型组以RL2、CTD 110.6检测的O-Glc N Ac糖基化tau蛋白表达明显低于假手术组 (P<0.01);与模型组相比,洗心汤不同剂量组中,sWGA富集的O-Glc N Ac糖基化蛋白质以及 RL2、CTD 110.6检测的 OGlc N Ac糖基化tau蛋白表达均明显提高,组间差异有统计学意义 (P<0.05,P<0.01),洗心汤各剂量组之间无显著性差异,多奈哌齐对照组与模型组比较无统计学意义。见表4~6,图1~3。

图1 sWGA富集的糖基化蛋白质表达Fig.1 sWGA enrichment protein glycosylation expression by western blot
表4 sWGA富集的糖基化蛋白质表达情况 (±s)Tab.4 sWGA enrichment protein glycosylation expression by western blot(±s)

表4 sWGA富集的糖基化蛋白质表达情况 (±s)Tab.4 sWGA enrichment protein glycosylation expression by western blot(±s)
注:与假手术组相比,**P<0.01;与模型组相比,△P<0.05,△△P<0.01;与多奈哌齐组相比,▲P<0.05,▲▲P<0.01
组 别 动物数/只 (sWGA/β-actin)假手术组50.540 2±0.007 6模型组 5 0.257 9 ±0.003 6**多奈哌齐对照组 5 0.270 1±0.002 3洗心汤小剂量组 5 0.405 3±0.003 6△▲洗心汤中剂量组 5 0.485 2±0.027 3△△▲▲洗心汤大剂量组 5 0.459 8±0.006 4△△▲▲

图2 以RL2检测的O-G lc N Ac糖基化tau蛋白表达Fig.2 Tau RL2 expression of hippocam pus of rat measured by western blot
表5 以RL2检测的O-G lc N Ac糖基化tau蛋白表达情况(±s)Tab.5 Tau RL2 expression of hippocampus of rat measured by western blot(±s)
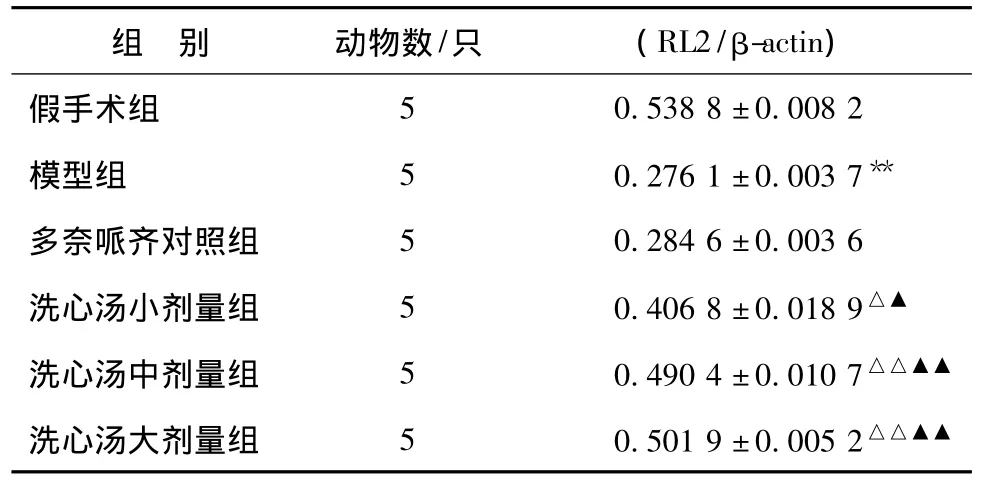
表5 以RL2检测的O-G lc N Ac糖基化tau蛋白表达情况(±s)Tab.5 Tau RL2 expression of hippocampus of rat measured by western blot(±s)
注:与假手术组相比,**P<0.01;与模型组相比,△P<0.05,△△P<0.01;与多奈哌齐组相比,▲P<0.05,▲▲P<0.01
组 别 动物数/只 (RL2/β-actin)假手术组50.538 8±0.008 2模型组 5 0.276 1 ±0.003 7**多奈哌齐对照组 5 0.284 6±0.003 6洗心汤小剂量组 5 0.406 8±0.018 9△▲洗心汤中剂量组 5 0.490 4±0.010 7△△▲▲洗心汤大剂量组 5 0.501 9±0.005 2△△▲▲
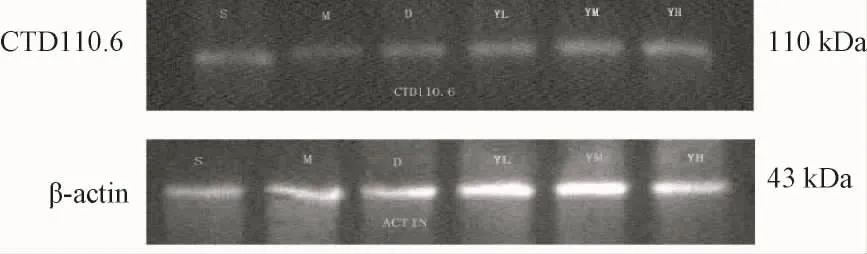
图3 以CTD 110.6检测的O-Glc N Ac糖基化tau蛋白表达Fig.3 Tau CTD 110.6 expression of hippocampus of rat measured by western blot
表6 以CTD 110.6检测的O-Glc N Ac糖基化tau蛋白表达情况(±s)Tab.6 Tau CTD 110.6 expression of hippocam pus of ratmeasured by western blot(±s)
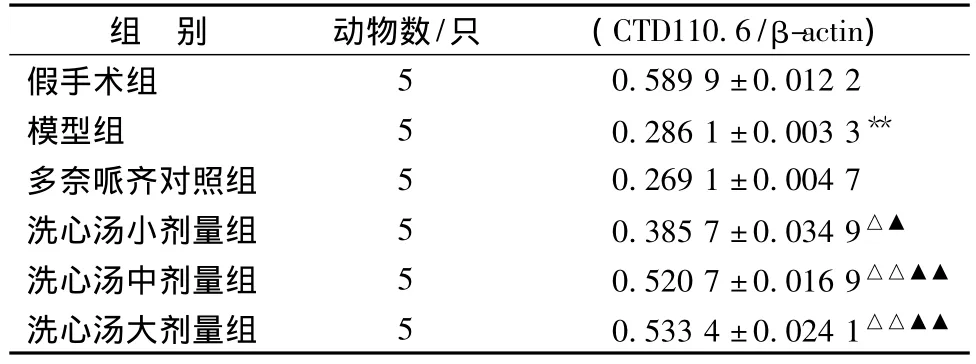
表6 以CTD 110.6检测的O-Glc N Ac糖基化tau蛋白表达情况(±s)Tab.6 Tau CTD 110.6 expression of hippocam pus of ratmeasured by western blot(±s)
注:与假手术组相比,**P<0.01;与模型组相比,△P<0.05,△△P<0.01;与多奈哌齐组相比,▲P<0.05,▲▲P<0.01
组 别 动物数/只 (CTD110.6/β-actin)假手术组50.589 9±0.012 2模型组 5 0.286 1 ±0.003 3**多奈哌齐对照组 5 0.269 1±0.004 7洗心汤小剂量组 5 0.385 7±0.034 9△▲洗心汤中剂量组 5 0.520 7±0.016 9△△▲▲洗心汤大剂量组 5 0.533 4±0.024 1△△▲▲
2.3 免疫组化检测结果 用免疫组化方法,以RL2检测大鼠海马CA1区O-Glc N Ac糖基化tau蛋白表达,所得结果与western blot法一致。与假手术组相比,模型组O-Glc N Ac糖基化tau阳性蛋白表达的细胞数减少、阳性细胞总面积减小、积分光密度值均下降 (P<0.05,P<0.01);与模型组相比,洗心汤小、中、大剂量组O-Glc N Ac糖基化tau蛋白表达的阳性细胞数、阳性细胞总面积、积分光密度值均有明显提高 (P<0.05,P<0.01),洗心汤各剂量组之间比较仍未表现出显著性差异,多奈哌齐对照组与模型组比较无统计学意义。见表7、图4。
图4显示,假手术组阳性细胞表达多,胞浆深染;模型组阳性细胞表达极少;多奈哌齐组阳性细胞表达极少;洗心汤小剂量组阳性细胞表达明显增多;洗心汤中剂量组阳性细胞表达明显增多;洗心汤大剂量组阳性细胞表达明显增多。
3 讨论
近年来大量研究显示:O-Glc N Ac糖基化在老年性痴呆发病中起着重要的作用[8]。多项证据支持O-Glc N Ac糖基化通过己糖胺生物合成途径(Hexosamine biosynthetic pathway,HBP)直接调节tau蛋白的磷酸化而参与了散发性老年性痴呆的发病过程[9]。老年性痴呆发病的能量代谢障碍学说认为,脑内葡萄糖摄取及代谢障碍引起神经原纤维变性可能是散发性老年性痴呆发病的重要原因[10]。老年性痴呆患者脑内葡萄糖代谢障碍,影响了尿苷二磷酸N-乙酰氨基葡萄糖 (UDP-GlcNAc)的合成,导致tau蛋白O-Glc N Ac糖基化水平降低,从而促进了tau蛋白的过度磷酸化[8]。而tau的异常过度磷酸化除了使其丧失正常生物学活性外,还使其变成细胞毒性分子,并促使其自身沉积为神经原纤维缠结[11]。
表7 大鼠海马CA1区以RL2检测的O-G lc N Ac糖基化tau蛋白表达情况 (±s)Tab.7 Tau RL2 expression in CA1 region of hippocampus of rat by immunohistochem istry(±s)

表7 大鼠海马CA1区以RL2检测的O-G lc N Ac糖基化tau蛋白表达情况 (±s)Tab.7 Tau RL2 expression in CA1 region of hippocampus of rat by immunohistochem istry(±s)
注:与假手术组相比,**P<0.01;与模型组相比,△P<0.05,△△P<0.01;与多奈哌齐组相比,▲P<0.05,▲▲P<0.01
组 别 动物数/只 阳性细胞数 阳性细胞总面积/μm2积分光密度值假手术组 5 84.791 7±0.342 5 32 066.290 1±502.131 7 171.961 7 ±0.628 1模型组 5 18.421 7 ±0.942 4** 6 797.310 1 ±117.613 1** 56.201 7 ±1.218 5**多奈哌齐对照组 5 21.491 7±0.535 6 6 906.146 7±61.845 7 57.743 3±0.643 3洗心汤小剂量组 5 38.583 3±1.325 8△▲ 11 970.921 7±190.516 8△△▲ 110.006 7±1.134 7△△▲洗心汤中剂量组 5 71.745 1±0.448 9△△▲▲ 26 514.466 7±450.454 0△△▲▲ 137.941 7±1.150 0△△▲▲洗心汤大剂量组 5 74.403 3±1.761 1△△▲▲ 27 445.185 1±315.989 6△△▲▲ 140.854 7±2.920 6△△▲▲
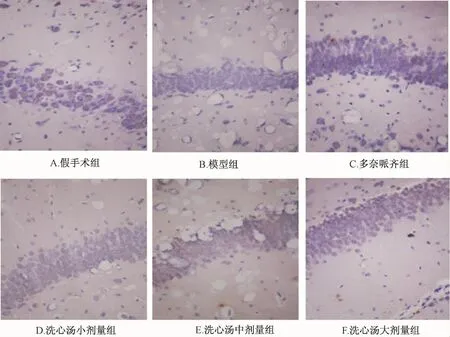
图4 大鼠海马CA1区以RL2检测的O-Glc N Ac糖基化tau蛋白表达情况Fig.4 Tau RL2 expression in CA1 region of hippocampus of rat by immunohistochem istry)(×200)
本实验中洗心汤是在清代名医陈士铎治疗呆病经验方的基础上经组方及剂量优化形成的有效成分提取物。该方依据中医益气通阳、开郁化痰治则拟定,全方寓消于补,标本兼治,具有升发阳气,祛逐阴邪,开郁化痰、平衡阴阳之功效。前期研究表明,洗心汤能明显改善侧脑室注射STZ拟散发性老年性痴呆大鼠空间学习记忆能力,其作用的形态学基础可能与保护海马神经元线粒体及轴突内微管结构有关[7]。
本实验研究表明,侧脑室注射STZ拟散发性老年性痴呆模型大鼠海马组织O-Glc N Ac糖基化蛋白质明显低于假手术组,同样,以 RL2、CTD 110.6检测的O-Glc N Ac糖基化tau蛋白表达也明显低于假手术组,上述结果说明大鼠侧脑室注射STZ之后,可能影响了脑组织神经元能量代谢及糖代谢,使得O-Glc N Ac糖基化的供体UDP-乙酰氨基己糖合成减少,导致大鼠脑内tau蛋白OGlc N Ac糖基化水平下降,这与散发性老年性痴呆患者体内的变化一致[12];研究显示:与模型组相比,洗心汤不同剂量组中,sWGA富集的 OGlc N Ac糖基化蛋白质以及RL2、CTD 110.6检测的O-Glc N Ac糖基化tau蛋白表达均明显提高,表明洗心汤能够通过改善侧脑室注射STZ拟散发性老年性痴呆模型大鼠脑组织能量及糖代谢,增加tau蛋白的O-Glc N Ac糖基化水平,从而起到抑制tau蛋白过度磷酸化及其毒性的作用。当然,该方对于蛋白质O-Glc N Ac糖基化修饰水平的研究属于首次探索,对其深层次的作用机制有必要进一步深入研究。
[1]Lefebvre T,Ferreira S,Dupont-Wallois L,et al.Evidence of a balance between phosphorylation and O-Glc N Ac glycosylation of Tau proteins-a role in nuclear localization[J].Biochim Biophys Acta,2003,1619(2):167-176.
[2]Hart GW,Greis K D,Dong L Y,et al.O-linked N-acetylglucosamine:the“yin-yang”of Ser/Thr phosphorylation Nuclear and cytoplasmic glycosylation[J].Adv Exp Med Biol,1995,376:115-123.
[3]Liu F,Iqbal K,Grundke-Iqbal I,et al.O-Glc N Acylation regulates phosphorylation of tau:a mechanism involved in alzheimer's disease[J].Proc Natl Acad Sci USA,2004,101(29):10804-10809.
[4]第五永长.银思维对拟SAD大鼠脑内tau磷酸化及其OGlc N Ac修饰的调节作用及相关研究[D].北京:北京中医药大学,2011.
[5]Sharma M,Gupta Y K.Intracerebroventricular injection of streptozotocin in rats produces both oxidative stress in the brain and cognitive impairment[J]. Life Sci,2001,68(9):1021-1029.
[6]George Paxinos,Charles Waston.大鼠脑立体定向图谱[M].诸葛启钏译.3版.北京:人民卫生出版社,2005.
[7]Diwu Yong chang,Tian Jin zhou,Shi Jing.The effect of Chinese herbal medicine Yinsiwei compound on spatial learning and memory ability and the ultrastructure of hippocampal neurons in a rat model of sporadic Alzheimer disease[J].J Chin Integr Med,2011,9(2):209-215.
[8]Gong C X,Liu F,Grundke-Iqbal I,et al.Impaired brain glucose metabolism leads to alzheimer neurofibrillary degeneration through a decrease in tau O-GlcNAcylation[J].J Azheimer's Dis,2006,9(1):1-12.
[9]Dias W B,Hart G W.O-Glc N Ac modification in diabetes and Alzheimer's disease[J].Mol Biosyst,2007,3(11):766-72.
[10]Hoyer S.Causes and consequences of disturbances of cerebral glucose metabolism in sporadic Alzheimer disease:therapeutic implications[J].Adv Exp Med Biol,2004,541:135-152.
[11]Gong C X,Liu F,Grundke-Iqbal I,et al.Post-translational modifications of tau protein in Alzheimer's disease[J].J Neural Transm,2005,112(6):813-838.
[12]Liu Fei,Shi Jianhua,Tanimukai Hitoshi,et al.Reduced OGlc N Acylation links lower brainglucose metabolism and tau pathology in Alzheimer's disease[J].Brain,2009,132(7):1820-1832.

