由Langmuir方程计算标准吸附平衡常数*
周学永 周鑫
(1天津农学院食品科学系 天津300384;2华中师范大学化学学院 湖北武汉430079)
Langmuir方程是由美国物理化学家Langmuir根据分子运动理论和单分子层吸附的假定推导得出的[1],其表达式为:θ=bp/(1+bp)。Langmuir方程是描述吸附平衡行为的一种应用最广泛的模型[2],其使用范围已由当初的气-固吸附逐渐推广至液-固吸附过程,涉及环境、材料、催化等众多研究领域。在Langmuir方程中,参数b被定义为吸附速率常数ka与解吸速率常数kd的比值,即吸附平衡常数。长期以来,人们习惯用吸附平衡常数b进行吸附热力学参数计算,常用公式为:
本文作者认为,这种计算方法是不正确的,理由有如下两点。第一,Langmuir方程中的b虽然是吸附平衡常数,但b不是无量纲量(量纲一的量)[6]。因此它不是标准吸附平衡常数,当然也就不能用于热力学参数的计算。根据国际纯粹与应用化学联合会(IUPAC)的规定,标准平衡常数的定义为:KƟ=exp(-ΔGƟ/RT)[7],式中 ΔGƟ、R 和 T 的单位依次为 J·mol-1、J·mol-1·K-1和 K,显然,KƟ应是无量纲量(量纲一的量)。第二,从数学的角度而言,在超越函数(如对数、指数、三角函数等)运算中,只有在参数为无量纲量(量纲一的量)时才有意义[8]。由于Langmuir方程中的b不是无量纲量,因此,ln b这种表示方法在数学上没有意义。
由于b是否为无量纲量的问题长期被忽略,导致b的单位在文献中有多种表述,而在进行热力学参数计算时却忽略了这些单位的差别。例如,有文献将 b(有时也写作 Kb)的单位表示为 L·mol-1[9-10]、L·mmol-1[11-12]、L·g-1[13-14]或 L·mg-1[15-16]。而用这些不同单位的 b 计算得出的标准自由能,其单位却都用kJ·mol-1表示,这显然是不应该的。如Bulut等[9]研究了榛子壳和杏仁壳对重金属离子的吸附,利用Langmuir方程对吸附数据进行拟合,获取不同温度下的参数b,采用ΔGƟ=-RT ln b计算吸附热力学常数,结果列于表1。

表1 榛子壳和杏仁壳吸附Ni(Ⅱ)的热力学参数(引自文献[9])
在298K条件下,榛子壳吸附Ni(Ⅱ)的ΔGƟ计算过程列举如下:
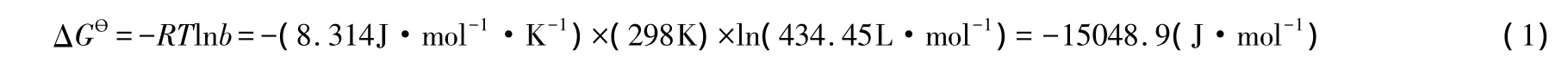
由于b不是无量纲量,故式(1)不符合IUPAC的规定,也不符合数学原理,因此,这种运算方式是错误的。
又如于丽娜等[11]研究了球状壳聚糖树脂对重金属离子的吸附热力学,用Kb代替b进行热力学计算,结果列于表2。在303K条件下,吸附自由能的计算过程如下:
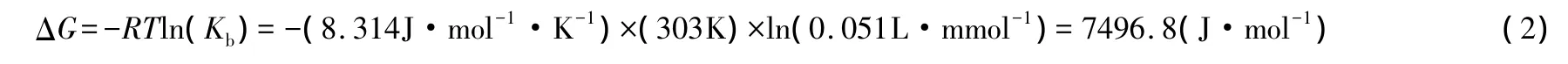
在式(2)中,平衡常数的单位为L·mmol-1,因此,表2中ΔG的计算结果是错误的。

表2 球状壳聚糖树脂对重金属离子的吸附热力学(引自文献[11])
再如Unuabonah等[13]研究了改性高岭土对Pb(Ⅱ)和Cd(Ⅱ)的吸附特性,吸附平衡常数b和吸附自由能ΔG的计算结果汇于表3。
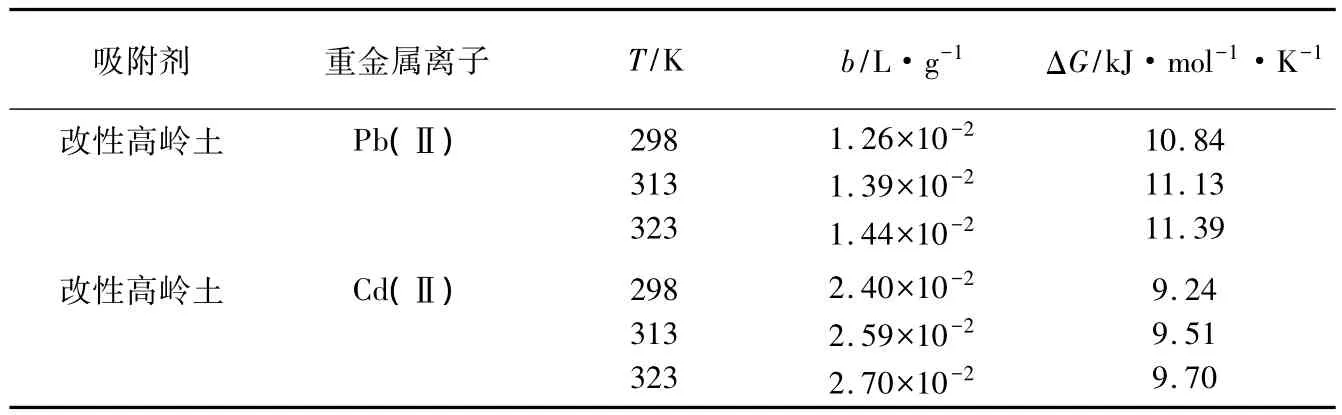
表3 改性高岭土吸附Pb(Ⅱ)和Cd(Ⅱ)的热力学参数(引自文献[13])
由表3可知,原文作者将ΔG的单位误写成kJ·mol-1·K-1。接下来我们再核查他们的计算过程。在298K条件下,改性高岭土吸附Pb(Ⅱ)的自由能按下式计算:
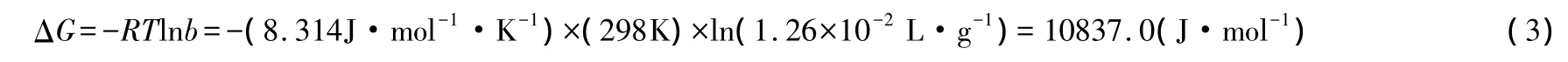
由于b的单位是L·g-1,故表3给出的计算结果是错误的。
除上述所列举实例外,在文献中还发现了其他两种表示平衡常数K的方式。文献[17]用Kb表示Langmuir方程中的经验常数,而计算自由能时却用Kb的倒数表示平衡常数K,即:ΔG=-RT ln K,K=1/Kb,K的单位是 mg·mL-1。文献[18]则用 Langmuir方程中的平衡吸附量 qe(mg·g-1)与b(L·mg-1)的乘积表示平衡常数Ka,并利用下式计算自由能:的单位是L·g-1。
在文献中,类似的错误还有很多。通过上述例证分析可知,b的单位在文献中使用得非常混乱。对于一个特定的吸附过程而言,b用L·mol-1、L·mmol-1、L·g-1或L·mg-1表示,在数值上会有很大差别,计算得出的自由能也会有很大不同,因此,不加限定地使用b进行热力学参数计算,是不妥的。本文从Langmuir方程的推导入手,通过量纲分析阐述参数b是经验吸附平衡常数而不是标准吸附平衡常数的根据。在此基础上,提出利用Langmuir方程计算标准吸附平衡常数的方法,可解决吸附热力学参数计算过程中存在的量纲问题。
1 Langmuir方程的推导及量纲分析
经典Langmuir方程是由气体在纯净固体表面发生吸附这一假定条件下推导得出的,在吸附达到平衡之前,固体吸附剂表面存在空白位点,气体分子可以直接与空白位点结合而发生吸附:

式中A代表气体,S代表固体表面;ka和kd分别为吸附和解吸速率常数。
若以θ表示任一瞬间固体表面被气体分子覆盖的分数,以N代表固体表面具有吸附能力的总的吸附位点数,则吸附速率与气体压力p及固体上的空位数(1-θ)N成正比,吸附速率ra的表达式为[19]:
为了比较转移支付在中国教育水平趋同中的作用,下文将采用β绝对收敛、β条件收敛对中国以及东、中、西部地区间的教育水平进行研究,以揭示西部地区受教育水平差异及缩小的内在原因。中国各省的教育水平和转移支付都存在显著的空间效应,因此本文借助空间经济收敛模型,构建教育水平的空间β绝对收敛(式2~式3)和条件收敛的空间面板自相关模型和空间面板滞后模型(式4~式5),以考察转移支付条件下教育水平增长与初期发展水平的关系。鉴于教育发展程度除了受国家财政支持力度的影响外,还取决于当地的经济发展水平,因此将经济发展水平也作为必要条件纳入β条件收敛模型。

气体的解吸速率与被吸附的气体分子数目Nθ成正比,即:

当吸附达到平衡时,吸附速率与解吸速率相等,解得:

式(7)即为Langmuir方程,其中p为气体压力,单位为Pa;b=ka/kd,为吸附平衡常数,单位为Pa-1。
同理,将单分子层吸附这一假定应用于液-固吸附过程,便可推导出描述该过程的Langmuir吸附等温式:

式中c为溶质浓度,在不考虑溶液标准态的情况下,c可以用ρ(质量浓度)代替;b为吸附平衡常数,其单位为L·mol-1(使用浓度时)或L·g-1(使用质量浓度时)。
2 由Langmuir方程计算标准吸附平衡常数的方法
标准吸附平衡常数与经验吸附平衡常数之间存在着密切联系,如果将式(7)变形,即可求得气-固吸附过程中经验吸附平衡常数b的表达式:

对一个特定的气相反应来说,标准平衡常数KƟp可以用下列通式表示:

式中B代表反应过程中的任一组分,νB为化学计量系数,pƟ是气体的标准状态压力(101.3kPa)。
依据上述原理,将气体的标准状态压力引入式(9),即可求得气-固吸附过程中标准吸附平衡常数bƟ的表达式:

对式(11)进行整理,得:

式(12)为考虑气体标准状态时的Langmuir方程,bƟ为标准吸附平衡常数,为无量纲量。
同理,将溶液标准态引入液-固吸附过程,可以得到修正的Langmuir方程:

式中c为溶质浓度,单位为mol·dm-3;cƟ为溶液的标准态浓度(1mol·dm-3);bƟ为标准吸附平衡常数,单位为1。值得指出的是,当考虑溶液的标准态时,须使用浓度(单位为mol·dm-3),这就相当于对溶质浓度的单位进行了规范和限定。
3 讨论
如何利用Langmuir方程中的参数进行正确的热力学计算,是化学工作者应当认真考虑的问题。这个问题本来并不困难,可能是由于受思维定式的束缚以及习惯引用他人文献的做法,不少人忽视了Langmuir方程中原有的某些假定条件,致使出现了将经验平衡常数误用为标准吸附平衡常数的现象。在经历了较长时间的探索后,我们认识到,忽略平衡常数的量纲是导致自由能误算的根本原因,这促使我们写出本文,推导用Langmuir方程计算标准吸附平衡常数的公式。
[1]Langmuir I.J Am Chem Soc,1918,40:1361
[2]Rossi C G,Heil D M,BonumàN B,et al.Environ Model Software,2012,38:40
[3]Donnaperna L,Duclaux L,Gadiou R,et al.J Colloid Interface Sci,2009,339:275
[4]Vinod K G,Imran A,Vipin K.J Colloid Interface Sci,2007,315:87
[5]张再利,况群,贾晓珊.生态环境学报,2010,19(12):2973
[6]Zhou X,Liu N,Gao J,et al.Int J Chem Reactor Eng,2011,9:A5
[7]International Union of Pure and Applied Chemistry Physical Chemistry Division.Quantities,Units and Symbols in Physical Chemistry.2nd ed.London:Blackwell Science Ltd,1993
[8]陈长植.工程流体力学.武汉:华中科技大学出版社,2008
[9]Bulut Y,Tez Z.J Hazard Materials,2007,149:35
[10]Das D P,Das J,Parida K.J Colloid Interface Sci,2003,261:213
[11]于丽娜,汪东风,胡维胜,等.中国海洋大学学报,2008,38(1):27
[12]Huang Y H,Hsueh C L,Huang C P,et al.Sep Purif Technol,2007,55:23
[13]Unuabonah E I,Adebowale K O,Olu-Owolabi B I,et al.Hydrometallurgy,2008,93:1
[14]Adebowale K O,Unuabonah E I,Olu-Owolabi B I.Chem Eng J,2008,136:99
[15]Sakkayawong N,Thiravetyan P,Nakbanpote W.J Colloid Interface Sci,2005,286:36
[16]lmeida C A P A,Debacher N A,Downsc A J,et al.J Colloid Interface Sci,2009,332:46
[17]孙培宾,陈江,尹进华,等.化学与生物工程,2011,28(4):62
[18]雒和明,曹国璞,张建强,等.应用化学,2010,27(2):211
[19]Atkins P W.Physical Chemistry.Oxford:Oxford University Press,1978

