蝇蛆粉替代鱼粉对黄颡鱼幼鱼生长性能、体组成和血浆生化指标的影响
文远红 曹俊明 黄燕华 王国霞 莫文艳孙智武 周婷婷 刘小玲
(1.广东省农业科学院畜牧研究所,广州 510640;2.华南农业大学动物科学学院,广州 510642;3.广东省动物育种与营养公共实验室,广州 510640;4.广东省畜禽育种与营养研究重点实验室,广州 510640)
鱼粉是传统的优质蛋白质源,因其蛋白质含量高,氨基酸、脂肪酸、维生素和矿物质含量丰富,适口性好,易被水产动物消化吸收等优点而广泛应用于水产饲料中。但是,随着水产养殖业的不断发展以及海水鱼捕获量的锐减,鱼粉价格不断攀升,限制了其在水产饲料中的使用量[1]。因此,寻找价格低廉、供应充足的动植物蛋白质源部分或全部替代饲料中的鱼粉,以降低饲料成本,提高经济效益成为了水产营养饲料学研究的重要方向。昆虫蛋白是一种新型蛋白质源,具有蛋白质含量高、氨基酸含量相对平衡、富含维生素和矿物质、适口性较好等优点,近年来受到了不少研究者的关注[2-4]。其中,蝇蛆繁殖速度快、养殖周期短、易饲养、易获取,是一种易被开发利用的昆虫蛋白[5]。蝇蛆粉(maggot meal)蛋白质含量高,富含氨基酸、维生素和矿物质,并含有抗菌肽、凝聚素等活性物质,营养全面,具有替代鱼粉的巨大潜力[6]。研究发现,直接投喂蝇蛆可提高尼罗罗非鱼(Oreochromis niloticus)[7]、中 国 对 虾 (Fenneropenaeus chinensis)[8]、三疣梭子蟹(Portunus trituber culatus)[8]的生长性能,可提高中国对虾[9]、凡纳滨对虾(Litopenaeus vannamei)[10]的免疫力。陈乃松等[11]报道,蝇蛆粉可提高凡纳滨对虾抗弧菌感染能力。研究表明,蝇蛆粉可部分或全部替代凡纳滨对虾[12]、非洲鲶鱼(Clarias gariepinus)[13]、尼罗罗非鱼[14]、鲤鱼(Cyprinus carpio)[15]饲料中的鱼粉。
黄颡鱼(Pelteobagrus fulvidraco)隶属于鲇形目鲿科黄颡鱼属,俗称黄骨鱼、黄腊丁、嘎鱼等,是我国常见淡水经济鱼类。其具有含肉率高、肉质细嫩、味道鲜美、营养价值高等优点,深受中国、韩国、日本等东亚国家消费者青睐,养殖规模在我国不断扩大。近年来,部分学者研究了黄颡鱼对营养素的需求量[16],但有关黄颡鱼饲料中鱼粉替代源研究的报道不多,并且有关蝇蛆粉在黄颡鱼饲料中的应用尚未见报道。因此,本试验拟研究蝇蛆粉等蛋白质替代不同比例的鱼粉对黄颡鱼幼鱼生长性能、体组成和血浆生化指标的影响,以便为蝇蛆粉在黄颡鱼饲料中的应用提供理论依据。
1 材料与方法
1.1 蝇蛆粉
试验用家蝇(Musca domestica)蝇蛆购于河北省玉田县某蝇蛆养殖场,养殖原料以麸皮为主,直接收集并在自然条件下阴干。在实验室用万能粉碎机将其粉碎,过80目筛,-20℃冰箱中保存备用。蝇蛆粉呈淡黄色,无臭味异味,无结块霉变。经分析测定,蝇蛆粉的水分、粗蛋白质、粗脂肪、灰分、钙、总磷含量分别为8.2%、53.0%、13.5%、10.8%、1.0%、1.1%,能量为 20.9 MJ/kg,蛋氨酸、赖氨酸、总必需氨基酸和总氨基酸含量分别为1.4%、3.1%、22.1%、48.4%,以上测定结果均为风干基础。
1.2 试验饲料
以秘鲁红鱼粉和豆粕为主要蛋白质源,鱼油和豆油为脂肪源,高筋面粉为糖源配制基础饲料,用蝇蛆粉等蛋白质替代基础饲料中0、20%、40%、60%、80%和100%的鱼粉,配制6种试验饲料(G0~G100)。6种试验饲料等氮(39.5%)等能(16.8 MJ/kg),其组成及营养水平见表1,氨基酸组成见表2。所有饲料原料均粉碎并过80目筛,采用逐级扩大法将维生素和矿物质等微量成分混匀,然后加入鱼油、豆油和水混匀,用SLX-80型双螺旋杆挤压机将其制成直径为2.00 mm的颗粒饲料,50℃烘干,自然冷却后装入密封袋,-20℃冰箱中保存备用。
1.3 试验鱼与饲养管理
试验用黄颡鱼幼鱼购于广东省清远市黄沙渔业基地,购回后暂养于广东省农业科学院畜牧研究所水产研究室的室内循环水养殖系统中,每天用天邦黄颡鱼0号饲料饱食投喂2次(08:00、17:00),驯养2周。养殖系统由24个容量为350 L(直径80 cm,高70 cm)的圆柱形玻璃纤维缸组成,养殖实际水容量为300~320 L。试验开始时,挑选出体格健壮、大小均匀、平均体重为2.02 g的黄颡鱼幼鱼960尾,分配于24个养殖缸中,每缸放养40尾。将24个养殖缸随机分为6个组(每组4 个重复),记为 G0、G20、G40、G60、G80和G100组,分别投喂对应的试验饲料。每天饱食投喂3次(08:00、14:00和18:00),投饲量为体重的4%~6%,并根据摄食和生长情况调节。每天记录投饲量、死亡情况以及水温。全天24 h不间断曝气,光照为自然光源,水温27.0~30.0℃,pH 7.3 ~8.0,氨 氮 <0.02 mg/L,亚 硝 酸 <0.05 mg/L。试验期为60 d。
1.4 样品采集与分析
试验开始时,挑选体重与试验用幼鱼的初始体重相近的鱼40尾,-20℃冰箱中保存备用。养殖试验结束时,禁食24 h,每缸试验鱼分别称重并统计数目。每缸随机取10尾鱼,-20℃冰箱中保存,用于全鱼体组成分析。每缸随机取12尾鱼,尾静脉取血混合后4℃下4 000 r/min离心10 min制备血浆样品,-80℃冰箱中保存,用于血浆生化指标分析。每缸随机取6尾鱼,用于形体指标测定。
饲料和全鱼体组成样品中水分含量采用105℃常压干燥法(GB/T 6435—1986)、粗蛋白质含量采用凯氏定氮法(GB/T 6432—1994)、粗脂肪含量采用乙醚抽提法(GB/T 6432—1994)、灰分含量采用550℃灼烧法(GB/T 6438—1992)、钙含量采用乙二胺四乙酸(EDTA)滴定法(GB/T 6436—2002)、总磷含量采用钼黄比色法(GB/T 6437—2002)进行测定。饲料中总能采用氧弹量热仪(IKA-C2000)进行测定。
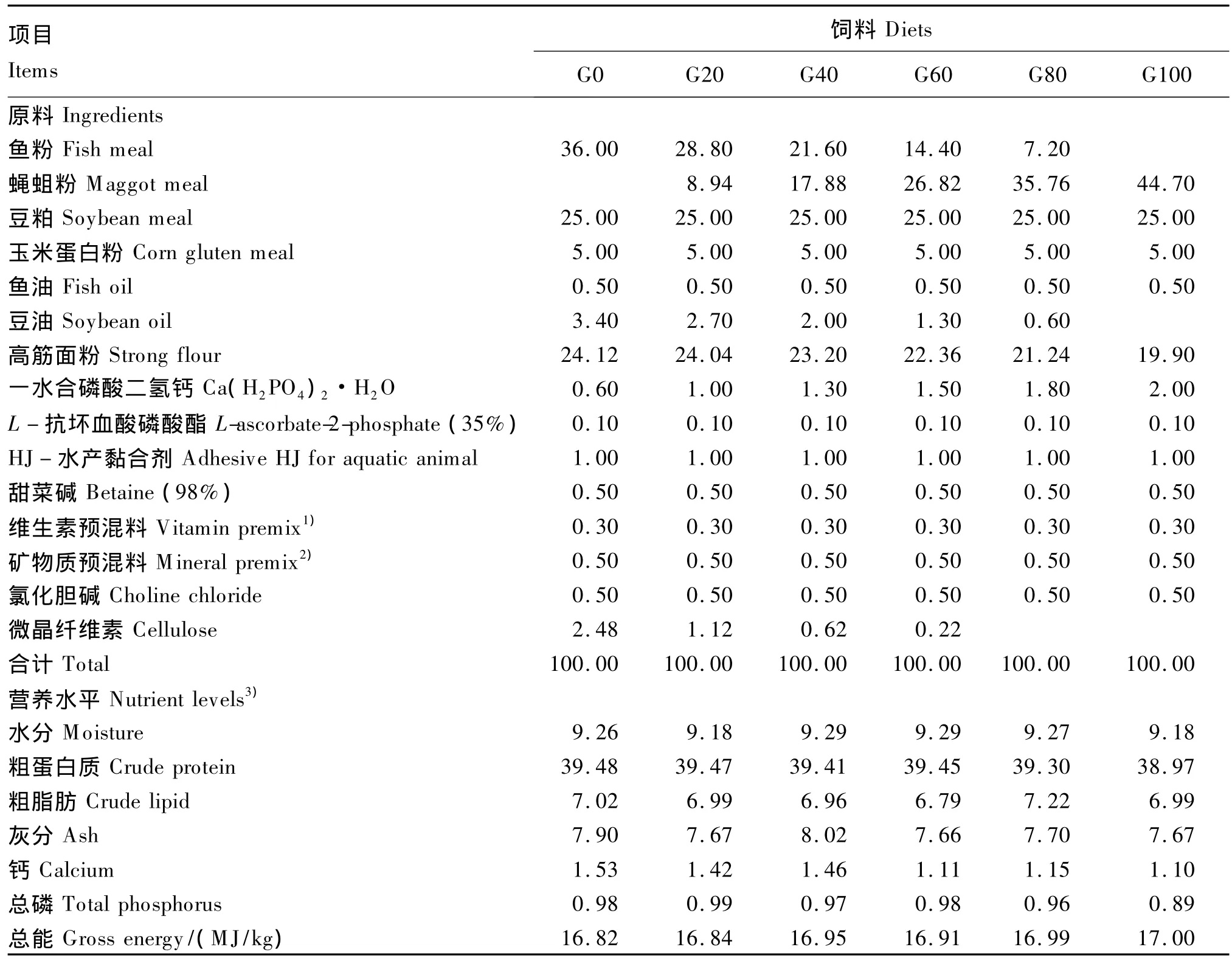
表1 试验饲料组成及营养水平(干物质基础)Table1 Composition and nutrient levels of experimental diets(DM basis) %
血浆葡萄糖(glucose,GLU)、总蛋白(total protein,TP)、尿素氮(urea nitrogen,UN)、胆固醇(cholesterol,CHOL)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)和甘油三酯(triglyceride,TG)含量及谷丙转氨酶(glutamic-pyruvic transaminase,ALT)和谷草转氨酶(glutamic-oxalacetic transaminase,AST)活性采用日立全自动生化分析仪进行测定。
1.5 指标计算
增重率(weight gain rate,WGR,%)=100 ×(终末体重+死亡体重-初始体重)/初始体重;特定生长率(specific growth rate,SGR,%/d)=100×(ln终末体重-ln初始体重)/饲养天数;
摄食量(feed intake,FI,g/尾)= 投饲总量/[(初始尾数+终末尾数)/2];
(1)从系统综合能效比来看,相比于加装中间换热器的地下水源热泵系统,地埋管地源热泵系统具有较大的优势,空气源热泵系统次之,由此可知,加装中间换热器的地下水源热泵系统作为该项目的冷热源方案是最不节能的。
饲料系数(feed coefficient,FC)=投饲总量/(终末体重+死亡体重-初始体重);
蛋白质效率(protein efficiency ratio,PER,%)=100×(终末体重+死亡体重-初始体重)/摄入蛋白质量;
蛋白质沉积率(protein deposition rate,PDR,%)=100×[(终末体重+死亡体重)×终末鱼体蛋白质含量-初始体重×初始鱼体蛋白质含量]/摄入蛋白质量;
存活率(survival rate,SR,%)=100×终末尾数/初始尾数;
肥满度(condition factor,CF,g/cm3)=100×体重/体长3;
脏体比(viscerosomtic index,VSI,%)=100×内脏重/体重;
肝体比(hepatosomatic index,HSI,%)=100×肝脏重/体重。

表2 试验饲料氨基酸组成(干物质基础)Table2 Amino acid composition of experimental diets(DM basis)%
1.6 数据统计与分析
试验数据用平均值±标准差(n=4)表示。采用SPSS 16.0软件进行统计分析。首先对数据进行方差齐性检验,若满足方差齐性则用单因素方差分析(one-way ANOVA)分析数据,差异显著者再用Tukey检验方法进行多重比较;若不满足方差齐性则采用Dunnett’s T3检验法进行多重比较。P<0.05表示差异显著。
2 结果与分析
2.1 蝇蛆粉替代鱼粉对黄颡鱼幼鱼生长性能的影响
从表3可以看出,蝇蛆粉替代鱼粉比例对黄颡鱼幼鱼SR无显著影响(P>0.05),各组试验鱼的SR均在98%以上。除G20组外的其他替代组试验鱼的终末体重、WGR和SGR较对照组(G0组)显著降低(P<0.05)。G80组试验鱼的FI最高,显著高于 G0、G20和 G100组(P<0.05),其他替代组与对照组相比差异不显著(P>0.05)。试验鱼的FC随蝇蛆粉替代鱼粉比例的增加而逐渐增加,除G20组外的其他替代组均显著高于对照组(P<0.05)。PER和PDR随蝇蛆粉替代鱼粉比例的增加而逐渐降低,与对照组相比,G20组差异不显著(P>0.05),其他替代组差异均达到显著水平(P<0.05)。

表3 蝇蛆粉替代鱼粉对黄颡鱼幼鱼生长性能的影响Table3 Effects of fish meal replacement by maggot meal on growth performance of juvenile yellow catfish(Pelteobagrus fulvidraco)
2.2 蝇蛆粉替代鱼粉对黄颡鱼幼鱼形体指标的影响

表4 蝇蛆粉替代鱼粉对黄颡鱼幼鱼形体指标的影响Table4 Effects of fish meal replacement by maggot meal on physique indexes of juvenile yellow catfish(Pelteobagrus fulvidraco)
2.3 蝇蛆粉替代鱼粉对黄颡鱼幼鱼体组成的影响
从表5可以看出,蝇蛆粉替代鱼粉比例对全鱼水分、粗蛋白质、粗脂肪、灰分、钙和总磷含量的影响不显著(P>0.05)。其中,全鱼水分含量随蝇蛆粉替代鱼粉比例的升高而逐渐增加,粗脂肪含量随蝇蛆粉替代鱼粉比例的升高而逐渐降低。
2.4 蝇蛆粉替代鱼粉对黄颡鱼幼鱼血浆生化指标的影响
从表6可以看出,血浆GLU含量随蝇蛆粉替代鱼粉比例的升高先升高后降低,其中G60和G80组显著高于对照组(P<0.05),其他替代组与对照组相比差异不显著(P>0.05)。蝇蛆粉替代鱼粉比例对血浆UN含量以及ALT和AST活性未产生显著影响(P>0.05)。血浆TP含量随蝇蛆粉替代鱼粉比例的升高而降低,其中G80和G100组显著低于对照组(P<0.05)。血浆CHOL、TG和LDL-C含量随蝇蛆粉替代鱼粉比例的升高而降低,其中G20~G100组CHOL、G20~G80组TG、G60组LDL-C含量较对照组显著降低(P<0.05)。与对照组相比,G40~G100组血浆HDL-C含量显著升高(P<0.05)。

表5 蝇蛆粉替代鱼粉对黄颡鱼幼鱼体组成的影响(干物质基础)Table5 Effects of fish meal replacement by maggot meal on body composition of juvenile yellow catfish(Pelteobagrus fulvidraco)(DM basis) %

表6 蝇蛆粉替代鱼粉对黄颡鱼幼鱼血浆生化指标的影响Table6 Effects of fish meal replacement by maggot meal on plasma biochemical indexes of juvenile yellow catfish(Pelteobagrus fulvidraco)
3 讨论
3.1 蝇蛆粉替代鱼粉对黄颡鱼幼鱼生长性能的影响
本试验结果表明,当蝇蛆粉替代鱼粉比例不超过20%时,黄颡鱼幼鱼的WGR、PER和PDR等指标与对照组相比无显著差异,但随蝇蛆粉替代比例的继续升高,上述各项指标均显著降低。这与蝇蛆粉替代鱼粉在凡纳滨对虾[12]、非洲鲶鱼[17]和鲤鱼[15]上的研究结果相似,但上述研究所得替代比例均高于本试验。此外,有学者研究表明,蝇蛆粉可完全替代尼罗罗非鱼饲料中的鱼粉[18-19]。出现差异的原因可能与饲料加工条件、试验条件、养殖品种和饲料原料的来源不同有关。赵振山等[20]、程媛媛等[21]指出,饲料蛋白质质量越好,氨基酸的沉积率越高,PDR就越高,并且PDR与养殖动物的种类也有关。据报道,豆粕[22]、烁生肽[23]、黄粉虫[24]仅能替代黄颡鱼饲料中 30% ~50%的鱼粉。这可能是因为黄颡鱼为偏肉食性鱼类,其对替代蛋白质源的质量和营养素要求较高。本试验中,各组黄颡鱼幼鱼的生长性能随蝇蛆粉替代鱼粉比例的升高而下降,这可能与饲料中赖氨酸等必需氨基酸以及多不饱和脂肪酸等营养素含量不足有关。试验饲料中赖氨酸、含硫氨酸(蛋氨酸+半胱氨酸)含量随蝇蛆粉替代鱼粉比例的升高而逐渐降低(表2),其含量不足可能导致黄颡鱼生长速率、饲料利用率和PER的下降。Cao等[25]报道,黄颡鱼的生长性能和饲料利用率随饲料中赖氨酸添加量的升高而增加,黄颡鱼对赖氨酸的需求量为3.13%。本试验用蝇蛆粉赖氨酸含量(3.07%)低于鱼粉(4.62%),赖氨酸为蝇蛆粉的限制性氨基酸,其含量不足可能影响了黄颡鱼幼鱼的生长和摄食。蝇蛆粉脂肪的饱和度较高,多不饱和脂肪酸仅含亚油酸,随替代比例的升高,饲料中二十碳五烯酸(EPA)仅在G0和G20组中检测出,含量分别为6.49%和5.75%;二十二碳六烯酸(DHA)在G0~G60组中的含量逐渐降低,由6.99%降至2.66%,G80和G100组不含DHA;亚麻酸和多不饱和脂肪酸含量在G0~G100组中逐渐降低,分别由3.31%降至1.79%和由45.99%降至24.87%。多不饱和脂肪酸含量不足可能导致了黄颡鱼幼鱼生长缓慢、饲料利用率和PER低下。李敬伟[26]指出,黄颡鱼的生长性能在一定范围内随饲料中EPA+DHA含量的增加而增加。Tan等[27]报道,当饲料中亚油酸与亚麻酸比值为1.17~2.12时,黄颡鱼的生长性能最佳。因此,当蝇蛆粉高比例替代鱼粉时,可导致饲料中赖氨酸、EPA、DHA和亚麻酸含量不足,引起黄颡鱼的生长速率下降、饲料系数升高、PER和PDR降低。曹俊明等[12]也指出,蝇蛆粉中赖氨酸和多不饱和脂肪酸含量不足会降低凡纳滨对虾的生长性能、饲料利用率、PER和PDR。另外,本实验室研究结果显示,黄颡鱼对蝇蛆粉干物质、粗蛋白质、粗脂肪、能量和总氨基酸的表观消化率分别为80.35%、91.08%、71.59%、78.19% 和95.53%[28]。黄颡鱼对蝇蛆粉干物质、粗脂肪和能量的消化利用率较低可能影响了黄颡鱼的生长。已有研究指出,鱼类对替代原料干物质、粗蛋白质等营养素的表观消化率显著影响鱼的生长性能和饲料利用率[29-30]。蝇蛆粉含有的几丁质很难被鱼类所消化,幼鱼生长和饲料利用率会受其影响[31]。本试验在用蝇蛆粉高比例替代鱼粉时,黄颡鱼幼鱼的生长性能和饲料利用率也可能会受到蝇蛆粉中几丁质的影响。替代原料的适口性也是影响鱼虾生长的重要因素,Bake等[32]研究指出,食物副产物的适口性较差,替代鱼粉后显著影响尼罗罗非鱼的摄食和生长。本试验中,除80%替代组外,其他替代组黄颡鱼幼鱼的摄食量与对照组相比差异不显著,这说明蝇蛆粉适口性不是影响黄颡鱼幼鱼生长性能的主要因素。关于蝇蛆粉影响黄颡鱼幼鱼生长性能的作用机理有待深入研究。
3.2 蝇蛆粉替代鱼粉对黄颡鱼幼鱼形体指标和体组成的影响
本试验中,各替代组黄颡鱼CF、HSI、VSI与对照组相比差异不显著,这说明蝇蛆粉替代鱼粉在形态学上不会对黄颡鱼幼鱼产生显著影响。其中,黄颡鱼HSI和VSI随蝇蛆粉替代鱼粉比例的升高而逐渐升高,这可能与试验饲料中脂肪、碳水化合物含量和蝇蛆粉脂质被氧化有关。Lee等[33]、Rueda-Jasso 等[34]均指出,饲料中脂肪含量的高低显著影响鱼类的肝体比。据报道,水产动物肝体比受饲料中碳水化合物含量的影响[35-37]。曹俊明等[12]报道,蝇蛆粉高比例替代鱼粉时,显著增加凡纳滨对虾的肝胰指数,其认为这与饲料脂肪含量较高和蝇蛆粉脂质被氧化有关。彭士明等[38]指出,氧化鱼油会导致黑鲷(Acanthopagrus schlegeli)肝脂含量和肝体比显著增加。
本试验中,鱼体粗脂肪含量随蝇蛆粉替代鱼粉比例的升高而逐渐降低,但各组间无显著性差异,这与曹俊明等[12]报道的一致,可能是蝇蛆粉中多不饱和脂肪酸含量的缺乏导致了鱼体粗脂肪含量的下降,也可能与蝇蛆粉中蛋白质、游离氨基酸和多不饱和脂肪酸等营养素含量较低有关。饲料蛋白质来源和含量、脂肪含量及氨基酸组成等都会影响脂肪及脂肪酸在鱼体内的代谢和沉积[39-40]。
3.3 蝇蛆粉替代鱼粉对黄颡鱼幼鱼血浆生化指标的影响
GLU是衡量机体营养状况的重要指标,在一定阈值内,血浆GLU含量越高,表明鱼摄食越积极、健康状态越好;血浆GLU含量超过一定阈值时,会造成机体的营养生理胁迫,损害鱼体健康[41]。本试验结果表明,与对照组相比,G60和G80组黄颡鱼血浆GLU含量显著升高,这与Ogunji等[14]报道的蝇蛆粉替代鱼粉对尼罗罗非鱼的研究结果不同。Ogunji等[14]研究表明,蝇蛆粉不会影响尼罗罗非鱼血浆GLU含量,亦不会对罗非鱼产生胁迫作用。出现这种差异可能与养殖动物机体糖代谢能力不同有关。据报道,水产动物对糖的利用能力因种类而异,一般认为杂食性鱼类比肉食性鱼类对糖的利用能力和耐受能力更强[42]。本试验中,血浆GLU含量显著增加可能与黄颡鱼幼鱼FI显著增加、对糖的耐受力和碳水化合物的利用能力较强有关。王赛等[29]报道,褐点石斑鱼(Epinephelus fuscoguttatus)幼鱼对豆粕中的碳水化合物的消化吸收能力较低,致使血浆GLU含量显著降低。本试验中,蝇蛆粉是否引起黄颡鱼幼鱼血浆GLU含量过高,而造成机体营养生理胁迫,影响黄颡鱼幼鱼生长性能尚需进一步研究。
TP是反映机体蛋白质代谢和机体健康与营养是否正常的重要指标。本试验中,G80和G100组黄颡鱼血浆TP含量显著低于对照组。这可能与蝇蛆粉的蛋白质质量较差、饲料中赖氨酸等必需氨基酸含量随替代比例的升高而降低有关。有研究表明,饲料蛋白质源的质量显著影响血浆TP含量,亦显著影响机体蛋白质代谢[35,43]。王赛等[29]指出,豆粕饲料中蛋氨酸、赖氨酸含量不足会导致褐点石斑鱼对饲料蛋白质的吸收能力下降,影响血清TP含量。ALT和AST是蛋白质代谢过程中的2种关键酶,主要存在于肝细胞中,正常情况下血液中这2种酶的活性较低且相对稳定,当肝脏受损时,会使血液中这2种酶的活性显著升高。本试验结果显示,蝇蛆粉替代鱼粉比例对黄颡鱼血浆ALT和AST活性的影响不显著,替代比例不超过40%时,血浆ALT和AST活性随替代比例升高而逐渐降低,这表明在此替代比例下蝇蛆粉能起到保护肝脏的作用。霍桂桃等[44]指出,蝇蛆粉可降低蛋鸡血浆中ALT和AST活性,保护肝脏不受热应激的影响。
TG是反映机体脂肪代谢的重要生理指标,其含量升高表明肝脏中脂肪堆积较多,容易引起脂肪肝、肝肥大等病理症状。CHOL代谢是脂质代谢的重要部分,血液中CHOL主要来自肝脏,其含量升高表明肝脏细胞功能发生障碍,机体脂质代谢出现紊乱。本试验结果显示,G20~G100组CHOL和G20~G80组TG含量显著低于对照组,这与陈乃松等[11]报道的凡纳滨对虾血清TG含量随饲料中蝇蛆粉含量的增加而增加不同。这可能与养殖动物机体脂质代谢能力有关。研究发现,不同养殖动物对同种蛋白质源脂质的代谢能力存在差异[45-46]。本试验中,与对照组相比,各替代组血浆CHOL含量均显著降低,可能与试验饲料脂肪(7.0%)、CHOL含量较低和黄颡鱼机体CHOL代谢能力较强有关。据报道,饲料中CHOL含量直接影响养殖动物血液 CHOL含量[46-47]。邓君明[48]指出,大豆蛋白降低牙鲆血浆CHOL含量与大豆中蛋白质含量和氨基酸组成无关,与大豆中的非淀粉多糖含量有关。本试验中,各替代组血浆CHOL含量显著降低是否与蝇蛆粉含有的非淀粉多糖有关,尚需进一步研究。同时,本试验还表明,随蝇蛆粉替代比例的升高,G20~G60组血浆LDL-C含量逐渐降低,G20~G100组血浆HDL-C含量逐渐升高,这可能与蝇蛆粉具有降血脂功能有关。LDL-C和HDL-C是一种血脂蛋白,LDL-C易引起胆固醇在血管沉积,并与其他物质一起堵塞血管;HDL-C能将肝脏外的胆固醇运输到肝脏分解排出体外。Ye等[37]报道,随豆粕替代鱼粉比例的升高,牙鲆血浆TG、CHOL、LDL-C含量显著增加,而血浆HDL-C含量则显著降低,表明豆粕导致了牙鲆机体脂质代谢紊乱和高血脂。本试验结果表明,当替代比例不超过60%时,蝇蛆粉可提高黄颡鱼幼鱼机体脂质代谢能力,降低血脂含量。
4 结论
①用蝇蛆粉等蛋白质替代20%~100%鱼粉对黄颡鱼幼鱼存活率、形体指标和体组成没有显著影响。
②当蝇蛆粉替代鱼粉比例超过20%时,黄颡鱼幼鱼的增重率和饲料利用率显著降低,部分血浆生化指标受到显著影响。
③以黄颡鱼幼鱼生长性能为评价指标,在粗蛋白质为39.8%的饲料中,当鱼粉含量为36%时,蝇蛆粉替代鱼粉的比例不宜超过20%。
[1]周歧存,麦康森,刘永坚,等.动植物蛋白源替代鱼粉研究进展[J].水产学报,2005,29(3):404-410.
[2]张伯文,孙龙生,姜亮,等.蚯蚓粉替代鱼粉对罗氏沼虾生长性能的影响[J].中国饲料,2011(15):38-40.
[3]ANH N T N,HIEN T T T,MATHIEU W,et al.Effect of fishmeal replacement with artemia biomass as aprotein source in practical diets for the giant freshwater prawn Macrobrachium rosenbergii[J].Aquaculture Research,2009,40(6):669-680.
[4]郭林英,王宇锋.柞蚕蛹替代鱼粉对鲤鱼生产性能影响研究[J].河南水产,2009(2):31-32.
[5]李颖,王红育.家蝇及其幼虫的营养价值与开发利用[J].中国食物与营养,2009(11):24-26.
[6]魏震,周定刚,任永林,等.蝇蛆粉作为鱼粉替代物在水产养殖中的应用[J].粮食与饲料工业,2008(9):34-35.
[7]黄国庆,王小兵.蝇蛆代替鱼用饲料喂养罗非鱼效果试验[J].中国水产,2008(10):70-71.
[8]郑伟,董志国,李晓英,等.投喂蝇蛆混养中国明对虾和三疣梭子蟹试验[J].水产科学,2010,29(6):344-347.
[9]王娓,周晓梅,于宁.蝇蛆提高对虾抗杆状病毒感染能力的初步研究[J].东北师大学报:自然科学版,2002,34(1):54-57.
[10]刘丽波,李色东,陈镜华,等.鲜活蝇蛆对凡纳滨对虾生长和免疫的影响[J].水产科学,2010,29(12):741-724.
[11]陈乃松,魏涛涛,廖奕招.蝇蛆粉和β-葡聚糖对凡纳滨对虾生长和免疫的影响[J].水产学报,2007,31(6):771-777.
[12]曹俊明,严晶,黄燕华,等.家蝇蛆粉替代鱼粉对凡纳滨对虾生长、抗氧化和免疫指标的影响[J].水产学报,2012,36(4):529-537.
[13]ANIEBO A O,ERONDU E S,OWEN O J.Replacement of fish meal with maggot meal in African catfish(Clarias gariepinus)diets[J].Revista Científica UDO Agrícola,2009,9(3):666-671.
[14]OGUNJI J O,KLOAS W,WIRTH M,et al.Effect of housefly maggot meal(magmeal)diets on the performance,concentration of plasma glucose,cortisol and blood characteristics of Oreochromis niloticus fingerlings[J].Journal of Animal Physiology and Animal Nutrition,2008,92:511-518.
[15]OGUNJI J,SUTTER D,RENNERT B,et al.Growth performance and body composition of carp(Cyprinus carpio)fed diets containing housefly maggot meal(magmeal)[C].Leibniz:Berichte des IGB,2007:140-148.
[16]文远红,曹俊明,黄燕华,等.黄颡鱼营养需求研究进展[J].广东农业科学,2011,38(18):108-111.
[17]FASAKIN E A,BALOGUN A M,AJAYI O O.Evaluation of full-fat and defatted maggot meals in the feeding of clariid catfish Clarias gariepinus fingerlings[J].Aquaculture Research,2003,34:733-738.
[18]OGUNJI J O,KLOAS W,WIRTH M,et al.Housefly maggot meal(magmeal)as a protein source for Oreochromis niloticus(Linn.)[J].Asian Fisheries Science,2008,21:319-331.
[19]OGUNJI O,NIMPTSCH J,WIEGAND C,et al.Evaluation of the influence of houseflymaggot meal(magmeal)diets on catalase,glutathione S-transferase and glycogen concentration in the liver of Oreochromis niloticus fingerling[J].Comparative Biochemistry and Physiology-Part A,2007,147:942-947.
[20]赵振山,林可椒.配合饲料品质对鲤鱼体内必需氨基酸沉积率的影响[J].水产科技情报,1995,22(1):10-13.
[21]程媛媛,周洪琪,华雪铭,等.玉米蛋白粉部分替代鱼粉对罗氏沼虾生长、氨基酸沉积率和肌肉营养成分的影响[J].中国水产科学,2009,16(4):572-579.
[22]杨严鸥,张艳,潘宙,等.豆粕替代不同水平的鱼粉对黄颡鱼饲料利用、ATP酶活性和免疫功能的影响[J].饲料广角,2006(15):39-41.
[23]唐武斌,朱邦科.烁生肽替代鱼粉对黄颡鱼幼鱼生长及饲料利用的影响[J].动物营养学报,2008,20(2):133-139.
[24]苏时萍,杨启超,苏雷,等.2种虫源性蛋白替代鱼粉对黄颡鱼幼鱼生长、体成分和蛋白酶活性的影响[J].福建农林大学学报:自然科学版,2010,36(6):608-613.
[25]CAO J M,CHEN Y,ZHU X,et al.A study on dietary L-lysine requirement of juvenile yellow catfish Pelteobagrusfulvidraco [J].Aquaculture Nutrition,2012,18(1):35-45.
[26]李敬伟.黄颡鱼幼鱼对饲料中蛋白、能量、钙、磷和脂肪酸需要量[D].硕士学位论文.武汉:华中农业大学,2008:23-37.
[27]TAN X Y,LUO Z,XIE P,et al.Effect of dietary linolenic acid/linoleic acid ratio on growth performance,hepatic fatty acid profiles and intermediary metabolism of juvenile yellow catfish Pelteobagrus fulvidraco[J].Aquaculture,2009,296:96-101.
[28]文远红,曹俊明,黄燕华,等.黄颡鱼对蝇蛆粉的表观消化率的研究[J].饲料工业,2012,33(14):23-26.
[29]王赛,陈刚,张健东,等.不同蛋白质源部分替代鱼粉对褐点石斑鱼幼鱼生长性能、体组成以及血清生化指标的影响[J].动物营养学报,2012,24(1):160-167.
[30]ABDELGUANY A E.Partial and complete replacement of fish meal with gambusia meal in diets for red tilapia(Orechromis niloticus× O.mossambicus)[J].Aquaculture Nutrition,2003,9(3):145-154.
[31]ADEWOLU M A,IKENWEIWE N B,MULERO S M.Evaluation of an animal protein mixture as a replacement for fishmeal in practical diets for fingerlings of Clarias gariepinus(Burchell,1822)[J].Israeli Journal of Aquaculture Bamidgeh,2010,62(4):237-244.
[32]BAKE G G,ENDO M,AKIMOTO A,et al.Evaluation of recycled food waste as a partial replacement of fishmeal in diets for the initial feeding of Nile tilapia(Oreochromisniloticus)[J].Fisheries Science,2009,75:1275-1283.
[33]LEE S M,JEON I G,LEE J Y.Effects of digestible protein and lipid levels in practical diets on growth,protein utilization and body composition of juvenile rockfish(Sebates schlegeli)[J].Aquaculture,2002,211:227-239.
[34]RUEDA-JASSO R,CONECEICAO L E C,DIAS J,et al.Effect of dietary non-protein energy levels on condition and oxidative status of Senegalese sole(Solea senegalensis)juveniles[J].Aquaculture,2004,231:417-433.
[35]KAUSHIK S J,COVES D,DUTTO G,et al.Almost total replacement of fishmeal by plant protein sources in the diet of a marine teleost,the European seabass,Dicentrarchus labrax[J].Aquaculture,2004,230:391-404.
[36]DIAS J,ALVAREZ M J,DIEZ A,et al.Regulation of hepatic lipogenesis by dietary protein/energy in juvenile European seabass(Dicentrarchus labrax)[J].Aquaculture,1998,161:169-186.
[37]YE J D,LIU X H,WANG Z J,et al.Effect of partial fish meal replacement by soybean meal on the growth performance and biochemical indices of juvenile Japanese flounder Paralichthys olivaceus[J].Aquaculture International,2011,19:143-153.
[38]彭士明,陈立桥,叶金云,等.饲料中添加氧化鱼油对黑鲷幼鱼生长的影响[J].水产学报,2007,31(9):109-115.
[39]ESPE M,LEMME A,PETRI A,et al.Can Atlantic salmon(Salmo salar)grow on diets devoid of fishmeal?[J].Aquaculture,2006,255:255-262.
[40]DIAS J,ALVAREZ M J,ARZEL J,et al.Dietary protein source affects lipid metabolism in the European seabass(Dicentrarchus labrax)[J].Comparative Biochemistry and Physiology-Part A,2005,142:19-31.
[41]林小植,罗毅平,谢小军.饲料碳水化合物水平对南方鲇幼鱼餐后糖酵解酶活性及血糖浓度的影响[J].水生生物学报,2006,30(3):304-310.
[42]张世亮.饲料中糖结构、糖水平及糖脂比对瓦氏黄颡鱼幼鱼生长及糖代谢的影响[D].硕士学位论文.青岛:中国海洋大学,2011:24-39.
[43]DAY O J,GONZALEZ H G.Soybean protein concentrate as a protein source for turbot Scophthalmus maximus L.[J].Aquaculture Nutrition,2000,6(4):221-228.
[44]霍桂桃,任文社,谷子林,等.蝇蛆粉及蝇蛆培养残料对夏季产蛋鸡血液生化指标的影[J].黑龙江畜牧兽医,2006(11):53-55.
[45]ZHOU Q C,MAI K S,TAN B P,et al.Partial replacement of fishmeal by soybean meal in diets for juvenile cobia(Rachycentron canadum)[J].Aquaculture Nutrition,2005,11(3):175-182.
[46]KAUSHIK S J,CRAVEDE J P,LALLES J P,et al.Partial or total replacement of fish meal by soybean protein on growth,protein utilization,potential estrogenic or antigenic effects,cholesterolemia and flesh quality in rainbow trout,Oncorhynchus mykiss[J].Aquaculture,1995,133:257-274.
[47]GOULDING N J,GIBNEY M J,TAYLOR T G,et al.Reversible hypercholesterolaemia produced by cholesterol-free fish meal protein diets[J].Atherosclerosis,1983,49(2):127-137.
[48]邓君明.动植物蛋白源对牙鲆摄食、生长和蛋白质及脂质代谢的影响[D].博士学位论文.青岛:中国海洋大学,2006:63-82.

