饲粮添加短乳杆菌对生长猪生长性能和血清生化指标的影响
刘 辉 季海峰 张董燕 王四新 王 晶 单达聪 王雅民
(北京市农林科学院畜牧兽医研究所,北京 100097)
乳酸菌制剂作为一种安全、优质、高效的新型饲料添加剂,在断奶仔猪生产中得到了广泛的应用。乳酸菌可在仔猪体内发挥良好的生物活性,抑制有害菌繁殖,改善肠道环境和菌群结构,提高机体免疫功能,促进生长[1-4]。短乳杆菌(Lactobacillus brevis)是乳酸菌属中重要的种群之一,具有高产酸、解毒、抑菌和提高机体免疫能力等多种特性[5-7]。有研究发现,给哺乳或新生仔猪饲喂短乳杆菌制剂,能够提高仔猪断奶后生长性能,改善肠道菌群,提高机体免疫功能[8-9]。目前未见短乳杆菌在生长猪中的应用报道。本试验旨在通过在生长猪饲粮中添加短乳杆菌制剂,研究其对生长猪生长性能、粪便中菌群以及血清生化指标的影响,为短乳杆菌在生长猪生产中的应用提供科学依据。
1 材料与方法
1.1 试验材料
试验所选菌种为本研究室筛选保藏并经中国工业微生物菌种保藏管理中心鉴定的短乳杆菌,具有较强的耐酸、耐胆盐和抗菌活性,其冻干菌粉制剂中有效活菌总数为2.40×109CFU/g。
1.2 基础饲粮
基础饲粮是参照美国NRC(1998)20~50 kg生长猪营养需要配制的粉状饲料,其组成及营养水平见表1。
1.3 试验动物及分组
选用108头(70±2)日龄的平均体重为(24.49±1.61)kg的“杜×长×大”三元杂交猪,按性别、体重和窝源基本一致的原则随机分为3组,每组3个重复,每个重复12头猪。具体分组及各组饲粮为:对照组饲喂基础饲粮;试验Ⅰ组饲喂基础饲粮+0.05%短乳杆菌(配合饲料中短乳杆菌浓度为1.20×106CFU/g);试验Ⅱ组饲喂基础饲粮+0.10%短乳杆菌(配合饲料中短乳杆菌浓度为2.40×106CFU/g)。

表1 基础饲粮组成及营养水平(风干基础)Table1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.4 试验管理
试验在京郊某猪场进行,时间为2011年11月至2011年12月,预试期为5 d,正试期为30 d。试验猪舍属半敞开式建筑模式,水泥地面圈养。试验期间每日上午和下午定时喂料2次,自由采食和饮水。按猪场常规程序进行免疫、驱虫、消毒和管理等。
1.5 测定指标与方法
1.5.1 生长性能
试验开始和试验结束时分别对试验猪进行空腹称重,每天观察猪群生长情况,记录饲料消耗情况,由此计算生长猪平均日增重、平均日采食量、料重比。
1.5.2 粪便微生物含量的测定
试验结束当天,每个重复随机选择6头生长猪逐头采集新鲜粪样,用于测定猪粪中的乳酸菌和大肠杆菌的数量,菌群数量以每克粪便中所含细菌群落总数的对数[lg(CFU/g)]表示。乳酸菌和大肠杆菌分别采用改良MRS培养基和伊红美蓝培养基进行培养,测定方法参照Torrallardona等[10]的方法进行。
1.5.3 血清生化指标
仔猪粪便取样同时进行前腔静脉采血约5 mL,3 000 r/min离心10 min,分离血清,-20℃保存备用。采用HITACHI-7020自动生化分析仪分析测定血清中总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、葡萄糖(GLU)、尿素氮(UN)、总胆固醇(TCHO)、甘油三酯(TG)含量及谷丙转氨酶(ALT)和谷草转氨酶(AST)活性,试剂盒购自中生北控生物科技股份有限公司;采用免疫比浊法测定血清中结合珠蛋白(Hp)含量,采用Elisa法测定血清中干扰素γ(IFN-γ)含量,试剂盒购自美国Bethyl公司。
1.6 数据处理
结果以平均值±标准差表示,数据处理与分析采用SPSS 19.0软件的one-way ANOVA程序进行单因素方差分析,以P<0.05为差异显著,P<0.01为差异极显著,差异显著或极显著时,以Duncan氏法进行多重比较。
2 结果与分析
2.1 短乳杆菌对生长猪生长性能的影响
由表2可知,各组的初重、末重和平均日增重之间差异均不显著(P>0.05)。与对照组相比,试验Ⅰ组的平均日采食量、料重比和试验Ⅱ组的平均日采食量均显著降低(P<0.05),试验Ⅱ组的料重比极显著降低(P<0.01)。
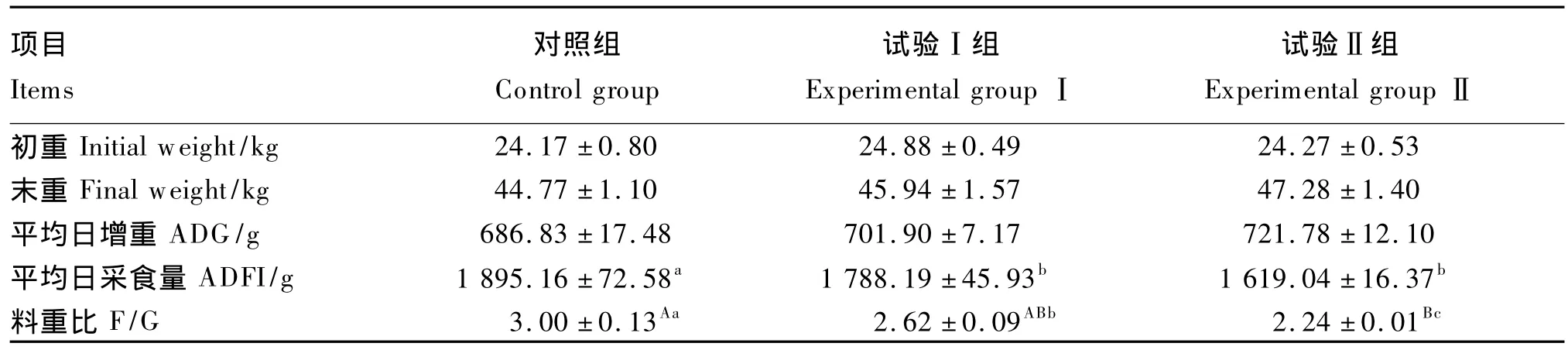
表2 短乳杆菌对生长猪生长性能的影响Table2 Effects of Lactobacillus brevis on growth performance of growing pigs
2.2 短乳杆菌对生长猪粪便中菌群的影响
由表3可知,与对照组相比,试验Ⅱ组粪便中的乳酸菌数量显著提高(P<0.05),大肠杆菌数量显著降低(P<0.05)。

表3 短乳杆菌对生长猪粪便中菌群的影响Table3 Effects of Lactobacillus brevis on faecal microflora of growing pigs lg(CFU/g)
2.3 短乳杆菌对生长猪血清生化指标的影响
由表4可知,与对照组相比,试验组的血清白蛋白含量显著降低(P<0.05),其中试验Ⅱ组达到极显著水平(P<0.01);球蛋白含量极显著升高(P<0.01);白球比极显著降低(P<0.01);结合珠蛋白含量极显著降低(P<0.01);IFN-γ含量显著升高(P<0.05)。各组间血清总蛋白、葡萄糖、尿素氮、总胆固醇和甘油三酯含量及谷丙转氨酶、谷草转氨酶活性均无显著性差异(P>0.05)。
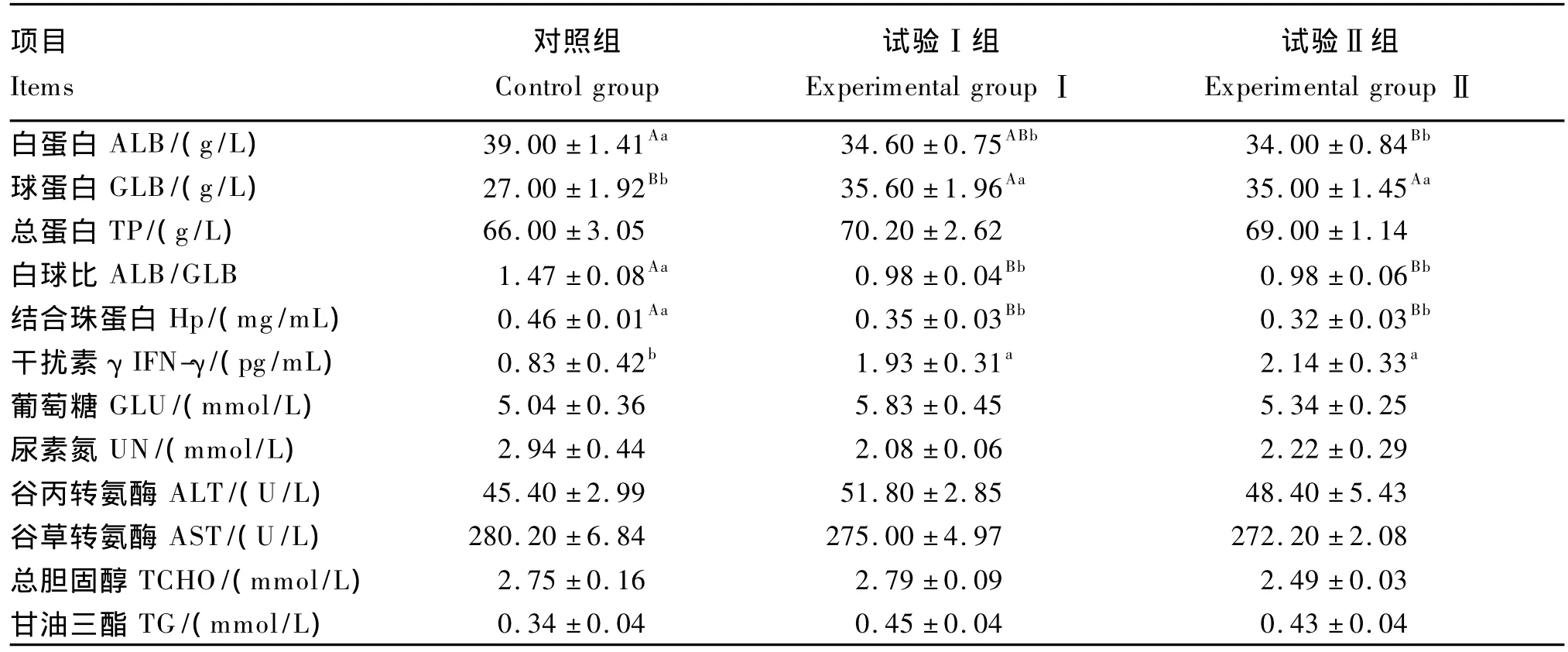
表4 短乳杆菌对生长猪血清生化指标的影响Table4 Effects of Lactobacillus brevis on serum biochemical indices of growing pigs
3 讨论
3.1 短乳杆菌对生长猪生长性能的影响
近年来,乳酸菌在断奶仔猪生产中得到了广泛的研究报道,而在生长猪中的应用研究报道却较少。与幼龄猪群生理特点相比,生长猪群的消化系统、肠道菌群相对稳定,消化吸收功能及饲料转化率均有了进一步改善[11-13]。目前,益生菌在生长或育肥猪生产中的说法不一。Apgar等[14]研究了乳酸菌对生长育肥猪生长性能的影响,结果显示,饲粮添加乳酸菌对猪群生长性能的效果并不显著,Hong 等[15]和 Chen 等[16]的研究则证实了乳酸菌能提高生长猪的生长性能。结果的差异可能与所用菌种、添加剂量、饲粮组成、饲喂方式、饲喂时间、动物的生理状态和饲养条件等不同有关[17]。由本试验结果可以发现,饲粮中添加短乳杆菌对生长猪的平均日增重没有显著影响,但能够显著或极显著降低生长猪的平均日采食量和料重比。分析其原因,可能与短乳杆菌的代谢产物有关,短乳杆菌通过代谢可以产生多种有机酸和一些酶类[5-6],能够降低肠道 pH并参与机体代谢,肠道的消化吸收能力改善,从而提高了饲粮中营养物质的消化率,在满足了猪日常的营养需要,特别是能量需要的情况下[18-20],表现出采食量明显减少。张振斌等[21]也曾得出过这样的结论。另外,从添加剂量来说,0.10%添加组的平均日增重和料重比要好于0.05%添加组,说明在本试验条件下,短乳杆菌以0.10%的剂量添加(配合饲料中短乳杆菌浓度为2.40×106CFU/g)更能有效促进生长猪的生长性能。
3.2 短乳杆菌对生长猪粪便中菌群的影响
乳酸菌和大肠杆菌常被作为仔猪肠道菌群研究的主要代表菌,其活菌含量与猪的健康密切相关,仔猪腹泻时肠道菌群发生很大变化,主要表现为大肠杆菌数量上升,而乳酸菌数量下降[22-24]。研究认为,饲粮中添加乳酸菌能够使断奶仔猪肠道乳酸菌数量显著增加[25],产生有机酸,显著降低肠道pH,且显著降低小肠后部、盲肠和结肠中大肠杆菌的数量,从而改善肠道微生物环境[26-27]。Gebert等[9]、黄兴国等[28]、侯成立等[29]均经试验证明了断奶仔猪饲粮中添加乳酸菌能够显著增加肠道或粪便中的乳酸菌数量、显著降低大肠杆菌数量。本试验通过检测粪便菌群发现,添加0.10%短乳杆菌后粪便中乳酸菌数量显著提高、大肠杆菌数量显著降低,表明适量短乳杆菌能够抑制肠道内大肠杆菌的繁殖,改善肠道菌群环境,促进肠道健康。0.10%添加组较0.05%添加组效果显著的原因可能是,生长猪经历了断奶应激后,其消化道内微生物菌群相对稳定,只有当外源乳酸菌在肠道内达到一定活菌浓度时,才能有效抑制肠道有害菌的含量,明显改善肠道微生物区系,这与Yan等[30]、Nousiainen 等[13]的研究结果相似。
3.3 短乳杆菌对生长猪血清生化指标的影响
血清生化指标可以反映机体各组织器官的功能和营养代谢情况,从而间接反映动物的生长性能。血清中总蛋白由白蛋白和球蛋白组成,其高低可反映机体蛋白质合成代谢的强弱,白蛋白由肝脏合成,是机体蛋白质来源之一,球蛋白是B细胞转化为浆细胞后分泌而成的,能反映机体的抵抗力,而白蛋白与球蛋白的比值(白球比)可反映机体免疫系统状态,白球比降低,说明有更多的球蛋白合成用于提高机体免疫机能[31-33]。张董燕等[34]的研究证明,饲粮中添加猪源罗伊氏乳酸杆菌能够显著提高断奶仔猪血清球蛋白的含量,显著降低白球比,提高其免疫力,从而促进猪的生长。张永勇[35]也研究指出,复合益生菌能够降低断奶仔猪血清白球比,从而提高断奶仔猪机体免疫力。本试验结果显示,试验组的球蛋白含量极显著升高、白球比极显著下降,说明短乳杆菌能够改善肝脏的蛋白质代谢,促进蛋白质吸收,从而提高机体免疫功能。本试验还发现,虽然试验组和对照组的白蛋白含量均在张军等[36]测定的健康猪血清白蛋白范围内,但添加短乳杆菌后白蛋白含量却显著或极显著降低,说明短乳杆菌会引起白蛋白的合成减少或消耗增加,这可能与菌株的生理特性、机体的营养状态、样品采集和检测等因素有关[37],其确切原因还有待进一步研究。
结合珠蛋白是一种存在于血清中的急性期蛋白,被认为是检测猪群健康、亚健康及疾病等机体状况的主要评定指标,其含量会随着机体感染、炎症和损伤的出现而增加,其值越高,说明机体健康状态越坏[38-39]。Piñeiro 等[40]研究指出,4 周龄猪群血清中结合珠蛋白含量为0.6 mg/mL,而到12周龄时,该值升高到 1.4 mg/mL。Petersen 等[41]、Le Floch等[42]认为,猪群血清中结合珠蛋白含量不仅受到日龄的影响,同时猪的品种及饲养环境也对其产生一定影响,如恶劣环境下饲养的猪群血清中结合珠蛋白的含量要高于好的环境中的测定值。本试验中3个组中猪群血清结合珠蛋白含量在0.32 ~0.46 mg/mL,均在 Witten[43]报道的健康猪血液中结合珠蛋白范围内(0.079~2.000 mg/mL),而试验组结合珠蛋白含量极显著低于对照组,说明短乳杆菌能够降低生长猪体内急性期蛋白含量,在促进动物健康方面具有积极作用。
IFN-γ作为一种重要的免疫相关细胞因子,对宿主具有抗病毒、免疫调节等重要的生物学活性作用[44],是判断机体免疫功能的重要指标。乳酸菌可以传达病毒等异物入侵的信息给特定的细胞,提升其制造 IFN-γ的能力以抑制病毒繁殖[45-46]。本试验结果表明,饲粮中添加短乳杆菌能够显著增加猪群血清中IFN-γ含量,这与Mohamadzadeh等[47]报道的短乳杆菌能够诱导IFN-γ等Th1细胞因子的产生是一致的,表明短乳杆菌对机体的免疫功能具有促进作用。
其余血清生化指标,如血清葡萄糖、尿素氮含量可反映糖和氨基酸代谢情况,血清谷丙转氨酶、谷草转氨酶活性是反映肝功能的重要指标,而血清总胆固醇和甘油三酯含量是衡量体内脂肪代谢的重要指标[31-33]。从试验结果来看,各指标值虽有一定的变化,但均在正常范围内,且各组之间无显著性差异,说明短乳杆菌对生长猪的肝脏功能没有负面影响,对机体的糖、脂肪代谢没有明显影响。
4 结论
①本试验条件下,在生长猪饲粮中添加0.10%的短乳杆菌(配合饲料中短乳杆菌浓度为2.40×106CFU/g)可显著提高粪便中乳酸菌数量,显著降低大肠杆菌数量;极显著降低料重比,从而改善生长猪的生长性能。
②本试验条件下,饲粮中添加短乳杆菌能极显著提高血清球蛋白含量,显著提高IFN-γ含量,极显著降低白球比及结合珠蛋白含量,从而提高了生长猪的免疫功能。
[1]BOSI P,TREVISI P.New topics and limits related to the use of beneficial microbes in pig feeding[J].Beneficial Microbes,2010,1(4):447-454.
[2]MIZUMACHI K,AOKI R,OHMORI H,et al.Effect of fermented liquid diet prepared with Lactobacillus plantarum LQ80 on the immune response in weaning pigs[J].Animal,2009,3(5):670-676.
[3]GIANG H H,VIET T Q,OGLE B,et al.Growth performance,digestibility,gut environment and health status in weaned piglets fed a diet supplemented with potentially probiotic complexes of lactic acid bacteria[J].Livestock Science,2010,129(1/2/3):95-103.
[4]TARAS D,VAHJEN W,MACHA M,et al.Performance,diarrhea incidence,and occurrence of Escherichia coli virulence genes during long-term administration of a probiotic Enterococcus faecium strain to sows and piglets[J].Journal of Animal Science,2006,84(3):608-617.
[5]RÖNKÄ E,MALINEN E,SAARELA M,et al.Probiotic and milk technological properties of Lactobacillus brevis[J].International Journal of Food Microbiology,2003,83(1):63-74.
[6]NOBUTA Y,INOUE T,SUZUKI S,et al.The efficacy and the safety of Lactobacillus brevis KB290 as a human probiotics[J].International Journal of Probiotics and Prebiotics,2009,4(4):263-270.
[7]SEGAWA S,NAKAKITA Y,TAKATA Y,et al.Effect of oral administration of heat-killed Lactobacillus brevis SBC8803 on total and ovalbumin-specific immunoglobulin E production through the improvement of Th1/Th2 balance[J].International Journal of Food Microbiology,2008,121(1):1-10.
[8]DAVIS M E,BROWN D C,BAKER A,et al.Effect of direct-fed microbial and antibiotic supplementation on gastrointestinal microflora,mucin histochemical characterization,and immune populationns of weanling pigs[J].Livestock Science,2007,108(1/2/3):249-253.
[9]GEBERT S,DAVIS E,REHBERGER T,et al.Lactobacillus brevisstrain 1E1 administered to piglets through milk supplementation prior to weaning maintains intestinal integrity after the weaning event[J].Beneficial Microbes,2011,2(1):35-45.
[10]TORRALLARDONA D,CONDE M R,BADIOLA T,et al.Effect of fishmeal replacement with spraydried animal plasma and colistin on intestinal structure,intestinalmicrobiology,and performance ofweanling pigs challenged with Escherichia coli K99[J].Journal of Animal Science,2003,81(5):1220-1226.
[11]HUANG C H,QIAO S Y,LI D F,et al.Effects of Lactobacilluson the performance,diarrhoea incidence,VFA concentration and gastrointestinal microbial flora of weaning pigs[J].Asian-Australia Journal of Animal Science,2004,17(3):401-409.
[12]LINDEMAN M D,KORNEGAY E T,STAHLY T S,et al.The efficacy of salinomycin as a growth promotant for swine from 9 to 97 kg[J].Journal of Animal Science,1985,61(4):782-788.
[13]NOUSIAINEN J,SETALA J.Lactic acid bacteria as animalprobiotics[M]//SALMINEN S,VON WRIGHT A.Lactic acid bacteria.New York:Marcel Dekker,Inc.,1993:315-356.
[14]APGAR G A,KORNEGAY E T,LINDEMANN M D,et al.The effect of feeding various levels of Bifidobacterium globosum A on the performance,gastrointestinal measurements and immunity of weanling pigs and on the performance and carcass measurements of growing-finishing pigs[J].Journal of Animal Science,1993,71(8):2173-2179.
[15]HONG J W,KI I H,KWON O S,et al.Effects of dietary probiotics supplementation on growth performance and fecal gas emission in nursing and finishing pigs[J].Journal of Animal Science and Technology(Korea),2002,44:305-314.
[16]CHEN Y J,SON K S,MIN B J,et al.Effects of dietary complex probiotic on growth performance,nutrients digestibility,blood characteristics and fecal noxious gas content in growing pigs[J].Asian-Australia Journal of Animal Science,2005,18(10):1464-1468.
[17]CHESSON A.Probiotics and other intestinal mediators[M]//COLE D J A,WISEMAN J,VARLEY M A.Principles of pig science.Loughborough:Nottingham University Press,1994:197-214.
[18]BROOM L J,MILLER H M,KERR K G,et al.Effects of zinc oxide and Enterococcus faecium SF68 dietary supplementation on the performance,intestinal microbiota and immune status of weaned piglets[J].Research in Veterinary Science,2006,80(1):45-54.
[19]LLOYD L E,CRAMPTON E W,MACKAY V G.The digestibility of ration nutrients by three-vs.seven-week old pigs[J].Journal of Animal Science,1957,6(2):83-88.
[20]徐凤华.L-乳酸作为酸化剂在饲料中的作用机制[J].饲料研究,2008(9):33.
[21]张振斌,林映才,蒋宗勇,等.益生菌对断奶仔猪生长表现、微生物区系和小肠黏膜结构的影响[J].养猪,2004(1):1-3.
[22]MATHEW A G,ROBBINS C M.Influence of galactosyl lactose on energy and protein digestibility,enteric microflora,and performance of weanling pigs[J].Journal of Animal Science,1997,75:1009-1016.
[23]CANH T T,STUTTONA L.Dietary carbohydrates alter the fecal composition and pH and the ammonia emission from slurry of growing pigs[J].Journal of Animal Science,1998,76(7):1887-1895.
[24]张振斌,蒋宗勇,林映才,等.超早期断奶应激对仔猪胃肠内容物pH值和微生物区系的影响[J].养猪,1998(3):14-15.
[25]TAKAHASHI S,EGAWA Y,SIMOJO N,et al.Oral administration of Lactobacillus plantarum strain Lq80 to weaning piglets stimulates the growth of indigenous Lactobacilli to modify the Lactobacillal population[J].Journal of General and Applied Microbiology,2007,53(6):325-332.
[26]CANIBE N,JENSEN B B.Fermented and nonfermented liquid feed to growing pigs:effect on aspects of gastrointestinal ecology and growth performance[J].Journal of Animal Science,2003,81(8):2019-2031.
[27]MODESTO M,D’AIMMO M R,STEFANINI I,et al.A novel strategy to select Bifidobacterium strains and prebiotics as natural growth promoters in newly weaned pigs[J].Livestock Science,2009,122(2/3):248-258.
[28]黄兴国,杨承剑,王超,等.微生态制剂对猪生产性能及粪中微生物的影响[J].家畜生态学报,2009,30(2):67-71.
[29]侯成立,季海峰,周雨霞,等.植物乳杆菌对断奶仔猪生产性能和生化指标的影响[J].饲料研究,2011(12):14-16.
[30]YAN L,WANG J P,KIM H J,et al.Influence of essential oil supplementation and diets with different nutrient densities on growth performance,nutrient digestibility,blood characteristics,meat quality and fecal noxious gas content in grower-finisher pigs[J].Livestock Science,2010,128(1/2/3):115-122.
[31]MORRILL J L,MORRILL J M,FEYERHERM A M,et al.Plasma proteins and a probiotic as ingredients in milk replace[J].Journal of Dairy Science,1995,78(4):902-907.
[32]王镜岩,朱圣庚,徐长法.生物化学[M].3版.北京:高等教育出版社,2002.
[33]SWENSON M J.家畜生理学[M].华北农业大学,译.北京:科学出版社,1978.
[34]张董燕,季海峰,王晶,等.猪源罗伊氏乳杆菌对断奶仔猪生长性能和血清指标的影响[J].动物营养学报,2011,23(9):1553-1559.
[35]张永勇.复合益生素对断奶仔猪生长性能和血液生化相关指标的影响[D].硕士学位论文.长沙:湖南农业大学,2007:26-27.
[36]张军,郭亮,梁如意,等.仔猪血清总蛋白、白蛋白和球蛋白含量测定[J].畜牧与饲料科学,2009(9):10-11.
[37]PATTERSON J A,BURKHOLDER K M.Prebiotic feed additives:rational and use in pigs[M]//Proceedings of the 9th international symposium on digestive physiology in pigs.Banff,Canada:University of Alberta,2003(1):319-331.
[38]PETERSEN H H,NIELSEN J P,HEEGAARD P M.Application of acute phase protein measurements in veterinary clinical chemistry[J].Veterinarian Research,2004,35(2):163-187.
[39]FRANCISCO C J,BANE D P,WEIGEL R M,et al.The influence of pen density,weaning age,and feeder space on serum haptoglobin concentration in young growing swine[J].Journal of Swine Health and Production,1996,4(2):67-71.
[40]PIÑEIRO M,GYMNICH S,KNURA S,et al.Meat juice:an alternative matrix for assessing animal health by measuring acute phase proteins.Correlations of pig-MAP and haptoglobin concentrations in pig meat juice and plasma[J].Research in Veterinary Science,2009,87(2):273-276.
[41]PETERSEN H H,ERSBOLL A K,JENSEN C S,et al.Serum haptoglobin concentration in Danish slaughter pigs of different health status[J].Preventive Veterinary Medicine,2002,54(4):325-335.
[42]LE FLOCH N,JONDREVILLE C,MATTE J J,et al.Importance of sanitary environment for growth performance and plasma nutrient homeostasis during the post-weaning period in piglets[J].Archives of Animal Nutrition,2006,60(1):23-34.
[43]WITTENⅠ.Ways of evaluating the health status of slaughter pigs and its effect on the storage life of pork by using haptoglobin analysis[D].Ph.D.thesis.Hannover:University of Veterinary Medicine,2005:63-65.
[44]RAMSAY A J,HUSBAND A J,RAMSBAW I A,et al.The role of interleukine-6 in mucosal IgA antibody responses in vivo[J].Science,1994,264:561-563.
[45]FUJIWARA D,INOUE S,WAKABAYASHI H,et al.The anti-allergic effects of lactic acid bacteria are strain dependent and mediated by effects on both Th1/Th2 cytokine expression and balance[J].International Archives of Allergy and Immunology,2004,135(3):205-215.
[46]SEGAWA S,NAKAKIA Y,TAKATA Y,et al.Effect of oral administration of heat-killed Lactobacillus brevis SBC8803 on total and ovalbumin-specific immunoglobulin E production through the improvement of Th1/Th2 balance[J].International Journal of Food Microbiology,2008,121(1):1-10.
[47]MOHAMADZADEH M,OLSON S,KALINA W V,et al.Lactobacilli activate human dendritic cells that skew T cells toward T helper 1 polarization[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(8):1-5.

