制备色谱技术对人参皂苷Rg2(组)的分离效果
刘 飞, 王 东 明, 刘 春 莹, 左 佳 敏, 张 玉 苍, 金 凤 燮
(1.大连工业大学 生物工程学院, 辽宁 大连 116034; 2.百威英博(四川)啤酒有限公司, 四川 资阳 641300; 3.海南大学 材化学院, 海南 海口 570228)
0 引 言
人参皂苷大多为三萜类皂苷,广泛存在于人参属植物的根、茎、叶中,是药材中主要的药物活性成分之一,在疾病预防及治疗方面,具有抗衰老[1]、增强机体对病毒的抵抗力[2-3]、保护神经[4]、抗肿瘤[5]等疗效。迄今为止,为人们所熟知的人参皂苷就多达60多种,且各种人参皂苷所发挥的药理作用与其化学结构有着密不可分的关系。为了对皂苷有着更加深入地了解,制备纯净的单体人参皂苷显得尤为重要。人参皂苷Rg2(组)包含4种异构体,分别是20(S)-Rg2、20(R)-Rg2、Rg6及Rg4(如图1所示)。由于化学结构相似,性质相近,给分离纯化带来了一定的难度。YANG[6]通过AB-8大孔吸附树脂纯化人参皂苷Rg2,得到了纯度为70%左右的混合物。杨博[7]应用重结晶法拆分了20(S)-Rg2及20(R)-Rg2,结果仅得到95.3%的20(S)-Rg2。郭伟芳等[8]采用高效液相色谱法对20(S)-Rg2 及20(R)-Rg2两种人参皂苷进行了分离研究,虽取得显著效果,但是不够全面。目前,系统地对人参皂苷Rg2(组)所包含的4种皂苷进行分离纯化方面研究的文章,未见发表。
本论文尝试采用制备色谱技术对人参皂苷Rg2(组)的4种单体进行了分离研究,为少量制备单体人参皂苷20(S)-Rg2、20(R)-Rg2、Rg6及Rg4提供了依据。
注:Glc,β-D-吡喃葡萄糖基;Rha,α-L-吡喃鼠李糖基
1 实 验
1.1 仪器与材料
薄层层析板Silica Gel 60-F254,德国Merck公司产品;高效液相色谱仪;日本Jasco高效液相色谱仪;Jasco-UV1575紫外检测器,LC-NetⅡ色谱工作站,SinoChrom ODS-BP高纯硅胶色谱柱(5 μm,φ10 mm×250 mm);Waters 2695高效液相色谱仪,Waters 2996二极管阵列检测器,美国Waters公司;Kromasil C18色谱柱(5 μm,φ4.6 mm×250 mm)。甲醇、乙腈为色谱纯试剂,美国TEDIA公司;人参皂苷Rg2(组),本实验室提供。
1.2 方 法
1.2.1 薄层层析法(TLC)
采用薄层层析法检测人参皂苷Rg2(组)。微量点样器吸取人参皂苷标准品及样品,等间距、均匀地点样于薄层层析板上。根据样品浓度适量增减点样量,每次点样前,均需风干上一次所点样品。展开剂选用体积比为7∶2.5∶0.5的氯仿-甲醇-水溶液的澄清下层溶液。显色剂为10%硫酸溶液,加热显色。
1.2.2 色谱条件
制备色谱:色谱柱为SinoChrom ODS-BP(5 μm,φ10 mm×250 mm),流动相为乙腈(A)-水(B)。0~180 min,31%A等度,180~300 min, 43%A等度,体积流量为0.8 mL/min,样品质量浓度为100 mg/mL,进样量为500 μL,柱温为室温,检测波长为203 nm。
分析色谱:色谱柱为Kromasil C18(5 μm,φ4.6 mm×250 mm),体积流量为1 mL/min,样品质量浓度为1 mg/mL,进样量为10 μL,柱温为35 ℃,检测波长为203 nm,对标准品检测所用流动相为乙腈(A)-水(B)(0~20 min,20%A等度;20~31 min,20%~32%的A线性梯度;31~40 min,32%~43%的A线性梯度;40~70 min,43%~100%的A线性梯度),对分离产品检测所用流动相为乙腈(A)-水(B)(20(S)-Rg2、20(R)-Rg2,31%A等度;Rg6、Rg4,43%A等度)。
2 结果与讨论
2.1 样品检测
首先对待分离样品采用TLC法检测。由图2可知,本次实验所用人参皂苷Rg2(组)样品纯度极高,几乎仅含有20(S)-Rg2、20(R)-Rg2、Rg6及Rg4等4种人参皂苷,因此,可作为制备4种皂苷的原料。

1,人参皂苷Rg6、Rg4标准品;2,人参皂苷20(S)-Rg2、20(R)-Rg2标准品;3,人参皂苷Rg2(组)样品
图2 人参皂苷Rg2(组)TLC图谱
Fig.2 TLC results of ginsenoside Rg2 (group)
2.2 Rg2(组)标准品HPLC图谱
按照“1.2.2”中所述色谱条件,对样品进行检测,结果如图3所示。由图3可知,人参皂苷20(S)-Rg2 吸收峰先于20(R)-Rg2出现,且由出峰时间推测可知,此时的洗脱剂体积分数约为31%的乙腈溶液;人参皂苷Rg6吸收峰先于Rg4出现,且此时洗脱剂体积分数约为43%的乙腈溶液。由于4种组分在HPLC图上呈现出4个峰,因此可以采用此方法对4种组分进行分离。

图3 人参皂苷Rg2(组)标准品HPLC图谱
2.3 制备型HPLC分离Rg2(组)皂苷
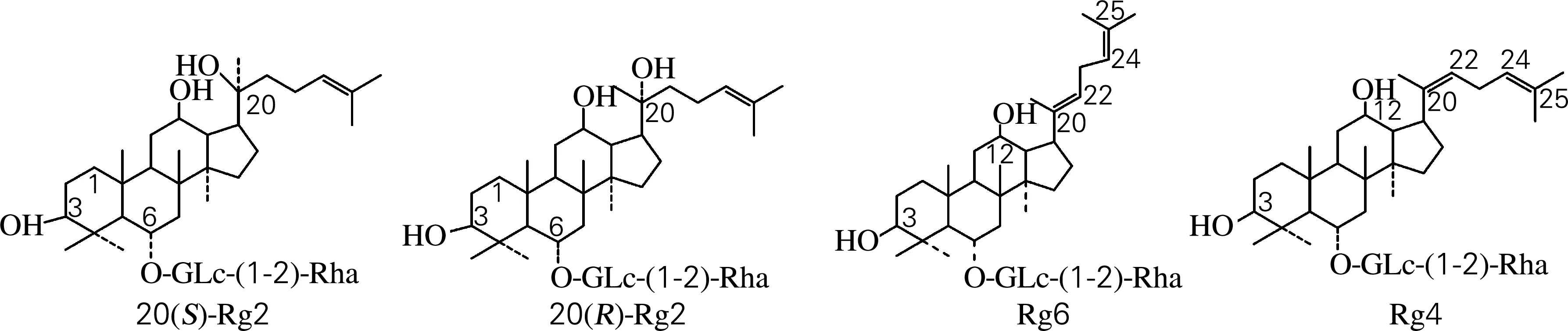
根据“2.2”的结论,人参皂苷Rg2(组)样品采用制备型HPLC进行少量制备。50 mg样品先后经31%及43%乙腈溶液等度洗脱分离,收集不同峰对应的洗脱液,混合、干燥,分别获得20(S)-Rg2、20(R)-Rg2、Rg6及Rg4等4种皂苷2.6、2.8、1.5及3.9 mg。然后采用HPLC对各个组分进行纯度检测,结果如图4所示,各分离产物在HPLC图谱中几乎都为单峰,经峰面积换算后得到各种皂苷纯度分别为:20(S)-Rg2皂苷的纯度为95.3%,20(R)-Rg2皂苷的纯度为96.4%,Rg6皂苷的纯度为96.3%,Rg4皂苷的纯度为98.3%,达到了分离纯化的效果。

(a) 20(S)-Rg2
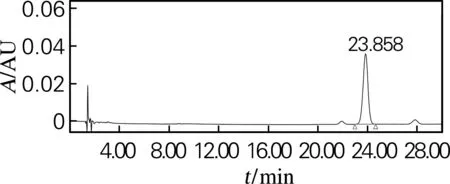
(b) 20(R)-Rg2
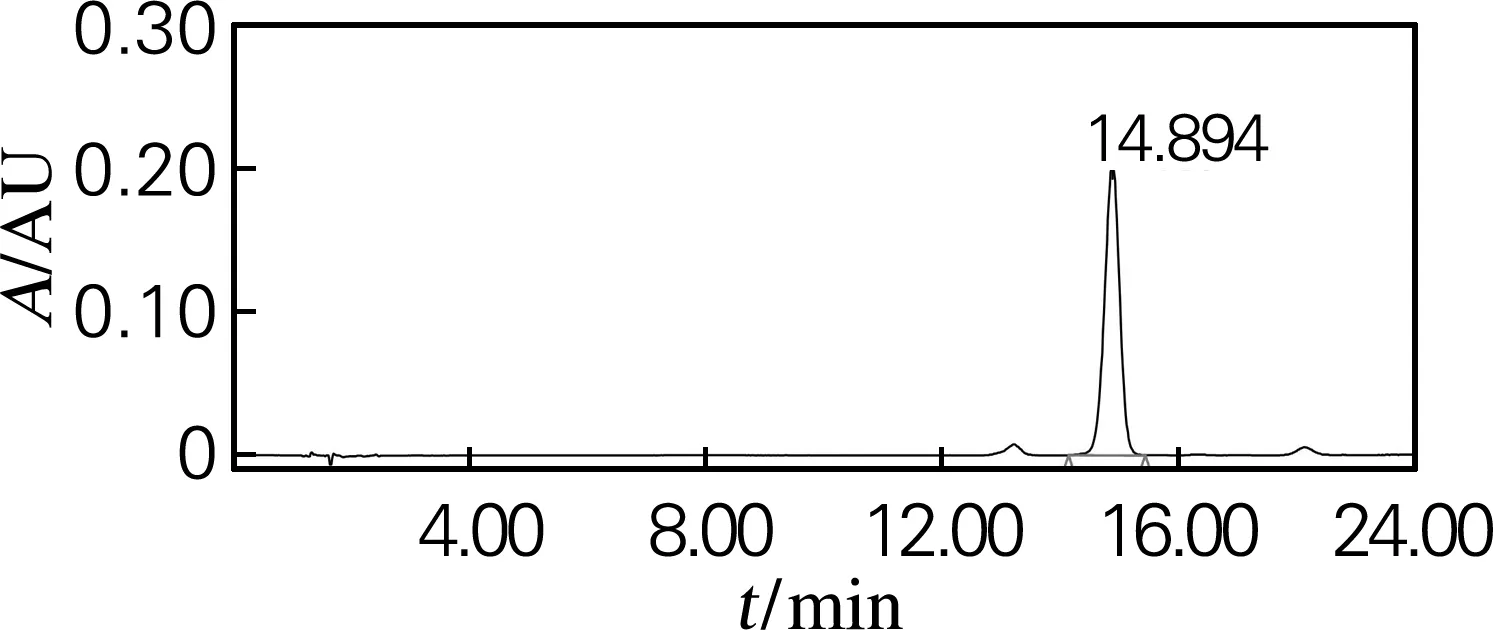
(c) Rg6
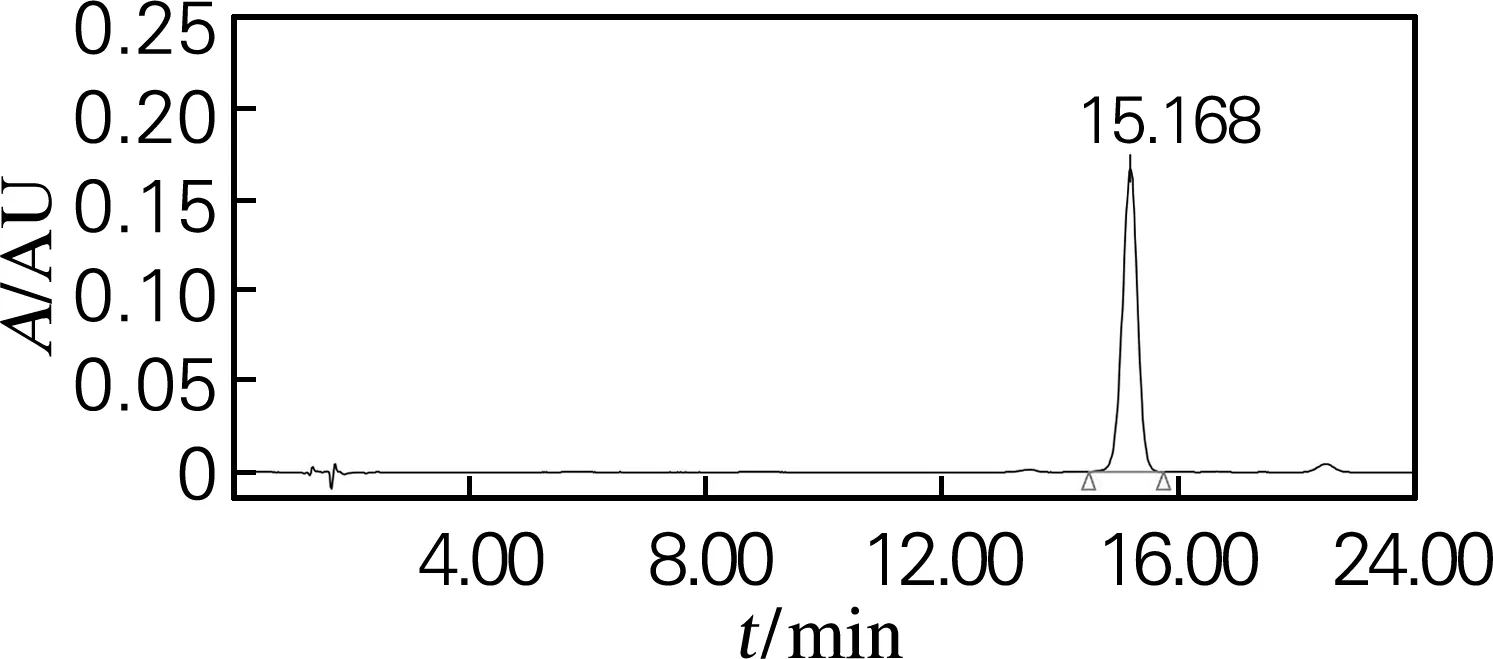
(d) Rg4
图4 分离皂苷HPLC图谱
Fig.4 The ginsenosides separated on HPLC
3 结 论
综上所述,通过制备色谱技术可以对人参皂苷Rg2(组)4种组分进行有效地分离,且纯度较高。因此,制备色谱技术可应用于20(S)-Rg2、20(R)-Rg2、Rg6及Rg4 4种皂苷的制备,但是,Rg6及Rg4不稳定,互相转化,有待于研究其保存方法。
[1] 杨文志,杨凤媚,亓淑芳,等. 人参皂甙抗衰老作用的研究进展[J]. 人参研究, 1993(3):2-5.
[2] 褚秀玲,苏建青,韦旭斌. 人参皂苷免疫调节和抗病毒作用研究进展[J]. 中兽医医药杂志, 2008(5):20-23.
[3] 李俊霞,苏建青,褚秀玲. 人参皂苷抗鸡新城疫病毒的试验研究[J]. 湖北农业科学, 2012, 52(2):351-353.
[4] 沈思钰,干振华,傅晓东,等. 人参皂苷对神经系统作用的研究现状及分析[J]. 安徽中医学院学报, 2004, 23(1):62-64.
[5] 窦德强,靳玲,陈英杰. 人参的化学成分及药理活性的研究进展与展望[J]. 沈阳药科大学学报, 1999, 16(2):151-156.
[6] YANG Zhenhua. Purification of high-voltage electric field transformed ginsenoside Rg2[J]. Medicinal Plant, 2010, 1(11):83-84.
[7] 杨博. 人参三醇类皂苷生物转化的研究[D]. 大连:大连工业大学, 2009:29-31.
[8] 郭伟芳,潘书洋,李超生,等. 高效液相色谱法分离20(S) 和20(R)-人参皂苷Rg2构型异构体[J]. 中国卫生工程学, 2005, 4(6):361-363.

