胸腺法新微乳的制备及质量评定
李元元,徐风华(解放军总医院药品保障中心制剂室,北京 100853)
近年来,随着生物技术的发展,蛋白多肽类药物在临床上的应用越来越广泛,其共同的特点是分子结构复杂,且分子量大,脂溶性差,很难通过生物膜屏障,通常为静脉或肌内注射给药,基本剂型是冻干粉注射剂[1],给临床用药带来不便,尤其是需要长期用药的患者。因此,该类药物的非注射途径给药新剂型的研究成为热点,通常采用的制剂技术包括化学结构修饰、微乳技术、微球技术、脂质体技术等[2]。其中,微乳是研究应用较多的新型药物载体,它是由油相、表面活性剂、助表面活性剂和水相按一定比例自发形成的透明或半透明的液体制剂,是黏度低、各向同性、且粒径在10 ~ 100 nm的热力学稳定的溶液体系[3],可以分为三种类型:油包水型微乳(W/O)、水包油型微乳(O/W)、双连续型微乳。
胸腺法新(thymalfasin)是由28个氨基酸组成的酸性多肽,是一种生物反应调节剂,生物学活性较为广泛,临床用于治疗乙肝、丙肝、肿瘤和艾滋病,也可作为疫苗辅助药物,治疗效果显著[4]。但由于胸腺法新分子量较大,不易通过生物屏障,生物半衰期短(< 2 h),且口服易被胃肠道中的蛋白质水解酶降解,生物利用度不高[5]。本实验应用微乳技术制备胸腺法新W/O型微乳,主要对其处方筛选、制备工艺及其理化性质和稳定性进行考察,为研发胸腺法新的新剂型提供参考。
1 材料与方法
1.1 仪器与试药
Adveturer AR2140电子分析天平(奥豪斯国际贸易(上海)有限公司);S-7四联磁力搅拌器(北京北德科技有限公司);NDJ-5S旋转粘度计(上海越平科学仪器有限公司);WZS-1阿贝折光仪(上海光学仪器六厂);H-7650电子透视电镜(日本日立公司);Nano-ZS90激光粒度仪(英国马尔文仪器有限公司)。
胸腺法新(含量100.8%,成都圣诺生物制药有限公司,批号:THSA100201);无水乙醇(分析纯,北京化工厂,批号:20100408);异丙醇(分析纯,北京化工厂,批号:20100506);Span80(湖南尔康制药有限公司,批号:20091202);Tween80(Fisher scientific worldwide company,批号:G3665F7015682F);辛癸酸三甘油酯(GTCC,上海千为油脂科技有限公司);十四酸异丙酯(IPM,力德士(北京)化学技术有限公司);氢氧化钠(分析纯,北京化学试剂中心);磷酸二氢钾(分析纯,北京化学试剂中心);苏丹红Ⅲ(美国Sigma公司);亚甲基蓝(北京中生瑞泰科技有限公司);重蒸水(自制)。
1.2 空白微乳处方的筛选
本实验采用单因素筛选获得最佳微乳处方。考察内容包括表面活性剂(Span80、Span80和Tween80复配)、助表面活性剂(乙醇、异丙醇、无助表面活性剂)、Span80/Tween80比例(1∶2,1∶1和2∶1)、油相(GTCC、IPM)及水相(蒸馏水、PBS缓冲液)。
水相和混合表面活性剂以不同比例制备微乳,采用滴定法绘制伪三元相图。具体方法为:将一定比例的表面活性剂与助表面活性剂混合均匀后,再将该混合液与油相分别按一定的质量比(1∶9,2∶8,3∶7,4∶6,5∶5,6∶4,7∶3,8∶2,9∶1)混合均匀;然后向混合液滴加水相并不停的搅拌使体系充分混匀,当体系由澄清变混浊时为临界点,记录临界点时加入水相的质量。按油相、混合表面活性剂、水相在所得体系的各自质量百分比绘制伪三元相图,确定其微乳区域。
1.3 胸腺法新微乳的制备
按照最佳处方将油相、混合表面活性剂搅拌均匀得混合液约2.89 g,备用。精密称定胸腺法新5 mg溶于定量的水相中,然后将胸腺法新水溶液加入到上述混合液中,搅拌至澄清透明,即得。
1.4 胸腺法新微乳的鉴别
1.4.1 电导法 采用电导率仪分别测定水、IPM、微乳的电导率值。
1.4.2 染色法 取两份等体积的胸腺法新微乳,分别将苏丹红Ⅲ和亚甲基蓝粉末加入到微乳中,静置一段时间观察两种染色的扩散速度。
1.4.3 稀释法 将微乳分别滴于油相和水相中,观察其在油相和水相中是否散开。
1.4.4 折光率 利用阿贝折光率仪,测定微乳的折光
1.4.5 黏度 利用旋转式黏度计测定微乳的黏度。
1.4.6 粒径的测定 采用马尔文激光粒度仪测定微乳的粒径。
1.4.7 形态学考察 滴1滴乳液于覆有Formvar膜的铜网上,自然晾干后用透射电镜观察乳液的形态。
1.5 胸腺法新微乳的含量测定
采用HPLC法测定胸腺法新微乳中的胸腺法新含量,色谱条件为:色谱柱:Venusil XBP C18柱(4.6 mm×250 mm, 5 μm);流动相:磷酸盐缓冲液(pH =5.7)-乙腈(92∶8)为流动相A,乙腈为流动相B,采用梯度洗脱:在0 ~ 30 min内流动相B的比例从0升至16%,31 min时降为0;流速:1.0 mL·min-1;检测波长:210 nm;进样量:20 μL。标准曲线方程Y=15 837X+ 2.763 6(r= 1.000 0,n= 6);线性范围为0.01 ~0.1 mg·mL-1,精密度RSD为0.10%,回收率98.99%,RSD为0.12%。按处方分别制备3批样品,测定其含量标示量,含量标示量=测得量/加入量×100%。
1.6 胸腺法新微乳的稳定性考察
制备三批胸腺法新微乳置于西林瓶中密封,在常温下放置3个月,分别于0、1、2、3月取样,考察其外观、离心后是否分层(5000 r·min-1,离心10 min)、pH值等理化指标,并测定微乳中药物含量。
2 结果
2.1 微乳处方的筛选及优化
2.1.1 表面活性剂的选择 分别对Span80和Span80/Tween80按比例(1∶2,1∶1和2∶1)复配两种试剂进行筛选。结果表明,单独应用Span80制备的微乳面积极小,黏度大;而Span80/Tween80复配体系制备的微乳流动性好,且稳定。因此,选择Span80/Tween80复配的表面活性剂。
2.1.2 助表面活性剂对微乳形成的影响 以GTCC为油相,Span80/Tween80为表面活性剂,助表面活性剂分别采用乙醇、异丙醇和无助表面活性剂三种,结果显示,三个三元相图有明显区别,无助表面活性剂的微乳区域面积最大,如图1所示,因此,选择处方中不加入助表面活性剂。


图1 GTCC/Span80-Tween80/助表面活性剂/蒸馏水,不同助表面活性剂的伪三元相图Fig 1 Pseudo-ternary phase diagrams of GTCC/Span80-Tween80/different cosurfacant/water
2.1.3 Span80/Tween80不同比例对微乳形成的影响 以GTCC为油相,Span80/Tween80比例分别为1∶2、1∶1和2∶1时制备胸腺法新微乳,绘制三元相图,所得结果如图2所示。微乳区域面积随Span80/Tween80比例值增大而逐渐减小,因此,选用Span80/Tween80 = 1∶2的体系。

图2 GTCC/Span80-Tween80/蒸馏水,不同Span80/Tween80比例的三元相图Fig 2 Ternary phase diagrams of GTCC/Span80-Tween80 with different ratio/water
2.1.4 油相对微乳形成的影响 分别选用GTCC、IPM作为油相考察其对微乳形成的影响。如图3所示,可以看出2种油相均能形成微乳,但以IPM为油相形成的微乳区域面积较大(表面活性剂为Span80/Tween80按1∶2混合),故选择IPM为油相。

图3 油相/Span80-Tween80/蒸馏水,不同的油相的三元相图Fig 3 Ternary phase diagrams of different Oil/Span80-Tween80/water
以IPM为油相,对上述表面活性剂、助表面活性剂及按Span80/Tween80比例再进行筛选验证,所得结果相同,即以Span80/Tween80按比例为1∶2混合作为表面活性剂,不加助表面活性剂为优化条件制备微乳。
2.1.5 水相的选择 水相分别选用PBS缓冲液和蒸馏水,绘制三元相图,由图4可知,微乳载水量相差不大。基于胸腺法新略溶于PBS缓冲液而微溶于水的考虑,水相选用PBS缓冲液(pH = 6.8)。
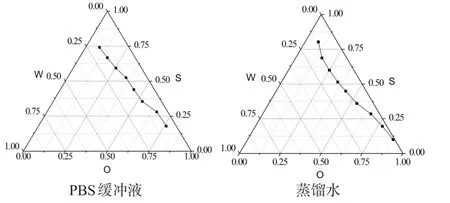
图4 IPM/Span80-Tween80/水相,不同水相的三元相图Fig 4 Ternary phase diagrams of IPM /Span80-Tween80/different water phase
结合胸腺法新的性质和微乳的载水量,最终确定最佳的处方配比为IPM∶Span80∶Tween80∶PBS =38.2∶17.4∶34.8∶9.6。
2.2 胸腺法新微乳的鉴定及质量评价
胸腺法新微乳为透明的淡黄色溶液,流动性好;电导法测得电导率值为0.58 μs·cm-1,接近于油相电导率值;分别加入苏丹红Ⅲ和亚甲基蓝粉末(苏丹红Ⅲ为油性染料,亚甲基蓝为水性染料),红色的扩散速度大于蓝色的扩散速度;乳液能够被其外相所稀释,微乳滴入油相时立即散开,而滴入水相时则不能。以上实验均证明该微乳体系外相为油相,为W/O型微乳。
胸腺法新微乳的折光率为1.448 2,黏度为32 mpa·s;通过透射电镜观察,胸腺法新微乳为粒径大小不均的球形,如图5所示;利用英国马尔文激光粒度仪测得粒径分布为10 ~ 30 nm,平均粒径26.68 nm,见图6。
按处方量制备的三批胸腺法新微乳样品,HPLC法测定含量标示量为97.59%、96.67%、95.74%。

图5 胸腺法新微乳的透射电镜观察Fig 5 The observation of thymalfasin microemulsion under TEM

图6 胸腺法新微乳的粒径分布Fig 6 The size distribution of thymalfasin microemulsion
2.3 胸腺法新微乳的稳定性
胸腺法新微乳在室温条件下分别放置1、2、3个月,其外观均为透明的淡黄色溶液,pH值没有明显变化,未见油水相分离,离心后亦未见分层。微乳中胸腺法新含量无明显变化。
3 讨论
3.1 表面活性剂和助表面活性剂的筛选
由于制备微乳时需加入表面活性剂的量比较大,为减少微乳的体内毒性,本实验选用低毒的非离子表面活性剂Span80和Tween80,结果表明复配的表面活性剂(Span80/Tween80)比单独应用Span80的效果好,与文献[6]报道的表面活性剂复配,既可以增加协同性,又可以使体系稳定是一致的。另外,虽然助表面活性剂可能使微乳的流动性增强,但载水量并没有增大,因此,我们采用了不加入助表面活性剂的处方,这同时也可减少微乳在体内的刺激性。
3.2 胸腺法新新剂型研究
近年来,有将胸腺法新制成结肠片[7]、缓释微球[8]的报道,但国内外文献未见将其制成微乳。本实验利用微乳能够促进药物吸收,避免其不被蛋白酶水解的优势将胸腺法新制备成微乳制剂。通过理化性质及稳定性考察,证明胸腺法新微乳体系为稳定的W/O型微乳,且制备工艺简单,质量可控。该微乳体系在体内非注射途径给药是否能提高胸腺法新的生物利用度我们将进一步进行研究证实。
[1] 刘绛光,王俊敏,何应. 微乳在口服多肽类药物中的应用[J].中国生化药物杂志,2006,27(1):56-58.
[2] 贾雷,房泽海. 制剂新技术在蛋白多肽类药物中的应用[J]. 中国药业,2009,18(18):80-82.
[3] 吴顺芹,李三鸣,赵国斌. 微乳及其在药剂学中的应用[J]. 沈阳药科大学学报,2003,20(5):381-385.
[4] Ancell CD, Phipps J, Young L. Thymosin alpha-1[J]. Am J Health Syst Pharm, 2001, 58(10): 879-885.
[5] 刘昂,吴梧桐. 制剂新技术在多肽、蛋白质类药物给药系统研究中的应用[J]. 中国现代应用药学,2003,20(2):110-114.
[6] Li P, Ghosh A, Wagner RF. Effect of combined use of nonionic surfactant on formation of oil-in-water microemulsions[J]. Int J Pharm, 2005, 288(1): 27-34.
[7] 张洁,谭兴起,张纯,等. 胸腺肽α1结肠释放片的制备及其体外释药研究[J]. 中国新药与临床杂志,2007,26(7):504-508.
[8] 朱艳,鲁莹,钟延强. 胸腺肽α1缓释注射微球的研究[J]. 药学学报,2007,42(2):211-215.

