八角茴香挥发性成分的油相组分和水溶性组分的比较
李萍,申晓霞,舒婷,石春韬
(天津农学院 基础科学学院,天津 300384)
八角茴香挥发性成分的油相组分和水溶性组分的比较
李萍,申晓霞,舒婷,石春韬
(天津农学院 基础科学学院,天津 300384)
目的:比较八角茴香挥发性成分的油相组分和水溶性组分的化学组成和抗菌活性。方法:采用水蒸气蒸馏法提取八角茴香挥发性成分的油相组分,用石油醚作溶剂从蒸馏残液中萃取挥发性成分的水溶性组分。利用气-质联用技术分析化学组成,采用琼脂-孔洞扩散法测定抗菌活性。结果:油相组分和水溶性组分的提取率分别为8.50%和4.19%,挥发性成分的总提取率为12.69%。油相组分和水溶性组分各鉴定出12种和45种化合物,分别占各自总量的100.000%和98.076%,两者最主要成分都是反式茴香脑,含量分别为94.897%(油相组分)和70.520%(水溶性组分)。虽然油相组分对7种供试菌种的抑制效果都比水溶性组分强,但高浓度的水溶性组分对供试菌种也表现出一定的抑制效果。油相组分对枯草芽孢杆菌的抑制效果最好,水溶性组分对啤酒酵母展现出很强的抗菌活性。在实验浓度范围内,油相组分和水溶性组分对供试青霉和黑曲霉抑制效果较弱。结论:在提取八角茴香挥发性成分的油相组分同时,还应该收集并利用水溶性组分,达到八角茴香挥发性成分的综合利用。
八角茴香;挥发性成分;油相组分;水溶性组分;化学组成;抗菌活性
随着人们食品安全意识的提高,化学防腐剂的残留问题引起关注,安全有效的天然植物源抗菌剂的市场需求不断增加。大量文献报道了天然香料和草药提取物,尤其是植物精油的抗菌活性及应用[1-3]。其中,八角茴香精油是通过水蒸气蒸馏法从八角茴香果实、枝、叶等部位提取得到的芳香油状液体,是八角茴香挥发性成分的油相组分,是水不溶性组分。关于八角茴香精油的组成、抗菌、抗氧化、杀蚊虫等活性已有文献报道[4-7],然而,水蒸气蒸馏提取八角茴香精油后的残液通常被弃掉,这部分是八角茴香挥发性成分的水溶性组分,有文献报道八角茴香果实的水煮液对食源性致病菌具有一定的抗菌效果[8]。关于水蒸气蒸馏提取八角茴香精油后,蒸馏残液的组成和抗菌活性的报道很少,因此,研究蒸馏残液即水溶性组分的组成及抗菌活性对全面了解八角茴香挥发性成分具有重要意义。
本文采用水蒸气蒸馏法提取八角茴香挥发性成分的油相组分(即八角茴香精油),收集油相组分后,剩余残液继续蒸馏,收集八角茴香挥发性成分的水溶性组分,利用气-质联用技术分析两者的组成,采用琼脂-孔洞扩散法测定两者的抗菌活性,为八角茴香挥发性成分的综合利用提供参考。
1 材料与方法
1.1 材料与菌种
1.1.1 大红八角整果
产地广西,购于超市,50 ℃干燥24 h,粉碎,过40目筛,取筛下粉末备用。
1.1.2 供试菌种
大肠杆菌、产气肠杆菌、枯草芽孢杆菌、啤酒酵母、酿酒酵母、青霉、黑曲霉,均由天津农学院农学与资源环境学院微生物实验室提供,4 ℃斜面保存,用前活化。
1.2 药品与仪器
氯化钠、无水硫酸钠、石油醚(30~60 ℃)、N,N-二甲基甲酰胺(DMF):均为国产分析纯。正己烷:色谱纯,天津市光复精细化工研究所。细菌用牛肉膏蛋白胨琼脂培养基、酵母用酵母膏胨葡萄糖琼脂培养基、霉菌用马铃薯葡萄糖琼脂培养基。
7890A/5975C型气相色谱-质谱联用仪(GC-MS) 美国安捷伦公司;DX-35BI型立式压力蒸汽灭菌锅 上海博迅实业有限公司;Thermo Scientific MSC-Advantage Ⅱ级生物安全柜 德国Thermo Fisher Scientific公司;LRH-250-S型恒温恒湿培养箱 广东省医疗器械厂。
1.3 实验方法
1.3.1 八角茴香挥发性成分的油相组分提取
按照文献中水蒸气蒸馏法提取八角茴香精油的最佳工艺条件[9],称取10 g(精确至0.0001 g)八角茴香粉末置于500 mL圆底烧瓶中,加入200 mL蒸馏水,水蒸气蒸馏,收集溜出液(油水混合物),至馏出液恰好澄清。油水混合物盐析,石油醚萃取,干燥,过滤,水浴回收石油醚,得八角茴香挥发性成分的油相组分,即八角茴香精油,称重,按照公式(1)计算提取率。
公式(1)
1.3.2 八角茴香挥发性成分的水溶性组分提取
从水蒸气蒸馏提取油相组分的馏出液恰好变澄清开始,继续收集馏出液,至圆底烧瓶内液体几乎蒸干。澄清的馏出液用石油醚萃取,干燥,过滤,水浴回收石油醚,得八角茴香挥发性成分的水溶性组分,称重,按照公式(1)计算提取率[10]。
1.3.3 GC-MS分
1.3.3.1 色谱条件
色谱柱:HP-5MS 石英毛细管柱(30 m×0.25 mm,0.25 μm),根据文献[7]的GC-MS测试条件并做适当修改,柱箱程序:初始60 ℃,保持1 min,以5 ℃/min升至160 ℃,保持4 min,再以5 ℃/min升至210 ℃,保持5 min,运行时间40 min;进样口温度:220 ℃,进样量:0.5 μL,分流比:50∶1,载气:高纯He,流速:1.0 mL/min。
1.3.3.2 质谱条件
电子轰击(EI)离子源;电子能量70 eV;传输线温度280 ℃;离子源温度230 ℃,四极杆温度150 ℃;质量扫描范围:30.0~550.0 amu。组分的鉴定根据美国NIST 2008标准谱库检索并参考相关文献,用峰面积归一化法计算各组分的相对百分含量。
1.3.4 抗菌活性测定
1.3.4.1 供试样品溶液的配制
油相组分和水溶性组分用DMF溶解,初始浓度为1000.0 mg/mL。用DMF作溶剂,采用3倍连续稀释法制备一系列不同浓度的供试样品溶液。
1.3.4.2 菌悬液的制备
细菌用平板稀释法测定菌落数[11],酵母菌用血球计数法计算菌落数。将活化后的细菌和酵母菌用无菌生理盐水稀释,分别制成含菌数为107cfu/mL的菌悬液。霉菌活化后用适量无菌生理盐水冲洗并收集孢子,充分振荡,制成孢子数为107个/mL的菌液。
1.3.4.3 琼脂-孔洞扩散法测定抗菌活性操作步骤
灭菌培养基冷却至50 ℃,加入5 mL菌悬液,混匀,倒入培养皿中(直径9 cm),每皿20 mL,放置,使培养基固化。用无菌打孔器在固化后的培养基上均匀打孔(直径7 mm),记号,每孔加入40 μL不同浓度的供试样品溶液,DMF作空白对照。细菌37 ℃培养24 h,酵母菌28 ℃培养48 h,霉菌25 ℃培养72 h。测量抑菌圈直径(mm),每个浓度重复3次,按公式(2)计算对供试菌种的抑制率[12,13]。

公式(2)
2 结果与分析
2.1 油相组分和水溶性组分的提取率和外观比较
油相组分和水溶性组分的提取率和外观比较结果见表1。

表1 油相组分和水溶性组分提取率及外观比较结果
由表1可知,油相组分的产率比水溶性组分高,是水溶性组分的2.03倍,这一结果与王同禹等报道的结果一致。但油相组分和水溶性组分都属于八角茴香的挥发性成分,因此,如果收集水溶性组分可使挥发性成分的提取率达到12.69%。此外,油相组分和水溶性组分的外观没有区别,但油相组分的八角茴香风味比水溶性组分更加浓烈。
2.2 油相组分和水溶性组分的化学组成比较
油相组分和水溶性组分的化学组成分析结果见表2。
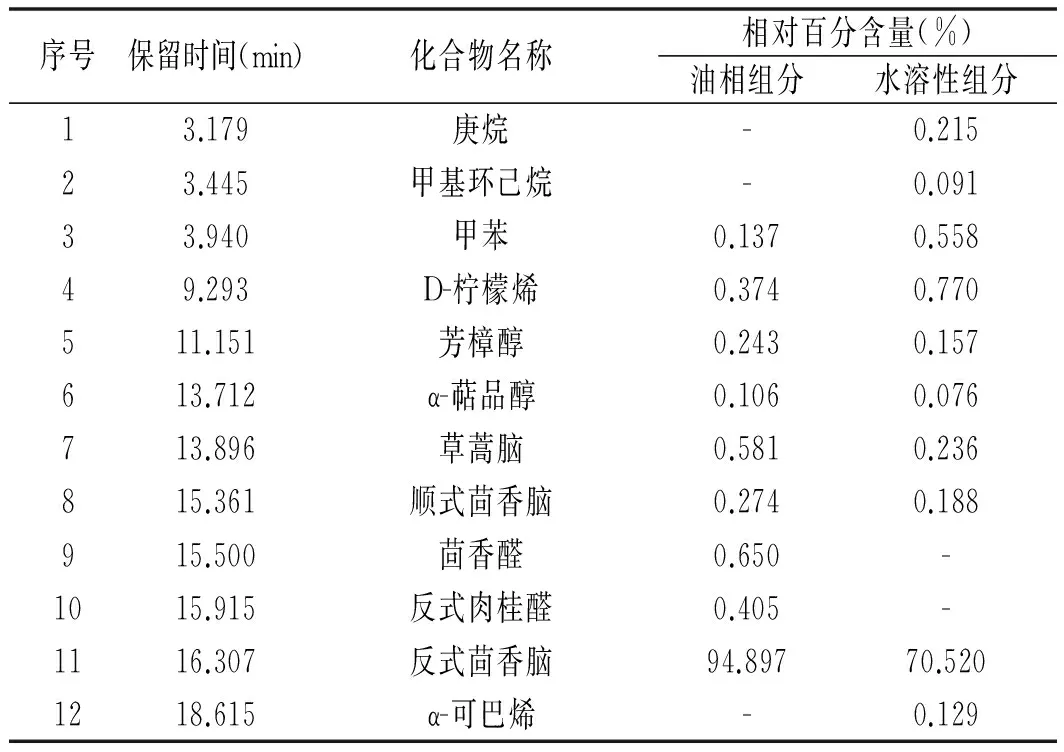
表2 油相组分和水溶性组分化学组成分析

续 表
注:“-”表示该物质未被检出。
由表2可知,油相组分和水溶性组分各鉴定出12种和45种化合物,分别占各自总量的100.000%和98.076%,两者共有组分9种。油相组分主要含有芳香烃(1种)、单萜(1种)、单萜的醇(2种)、醚类(5种)、醛类(2种)、倍半萜(1种),水溶性组分主要含有烷烃(21种)、芳香烃(1种)、单萜(1种)、单萜的醇(2种)、醚类(5种)、倍半萜(7种)、酯类(3种)、酚类(1种)、倍半萜的醇(1种)、羧酸(1种)、烷醇(1种)、烯烃(1种)。油相组分的特征成分是茴香醛、反式肉桂醛和甲基丁香酚,水溶性组分的特征成分类型是烷烃、酯、酚、羧酸、烷醇、烯烃、倍半萜的醇,且倍半萜类成分的种类比油相组分多6种。油相组分和水溶性组分的最主要成分都是反式茴香脑,反式茴香脑是八角茴香的特征风味成分[14],油相组分的反式茴香脑含量(94.897%)远高于水溶性组分(70.520%),这也是对油相组分八角茴香气味浓烈的有利解释。同时,反式茴香脑也是一种安全的天然食品添加剂,并具有较强的杀菌和抗氧化作用[15,16],水溶性组分中反式茴香脑的相对含量达到70.520%,收集水溶性组分可使反式茴香脑的收率得到很大提高。
2.3 油相组分和水溶性组分对同一菌种的抑制活性比较
油相组分和水溶性组分对同一菌种的抑制活性,见图1。
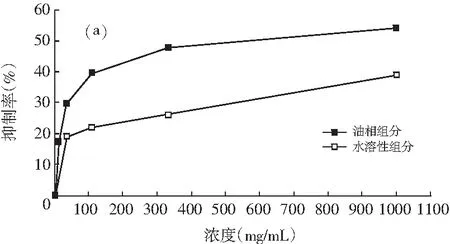
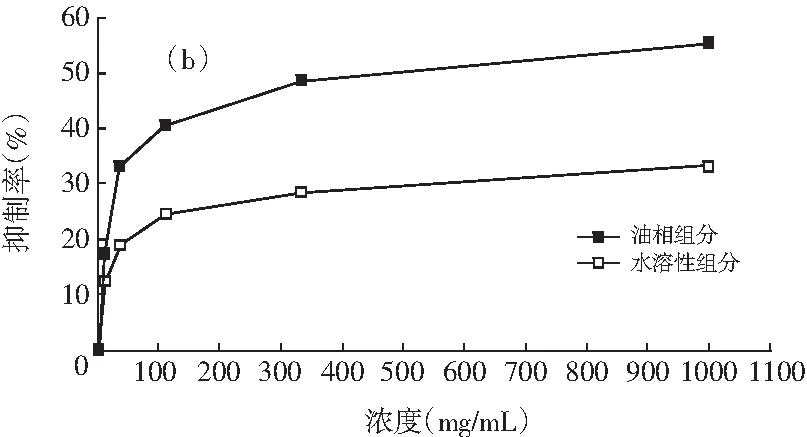
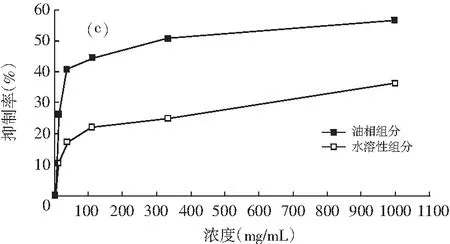
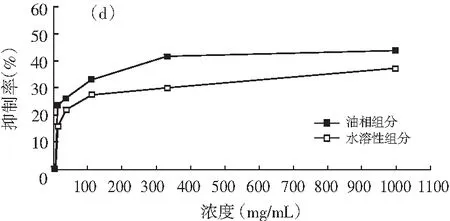
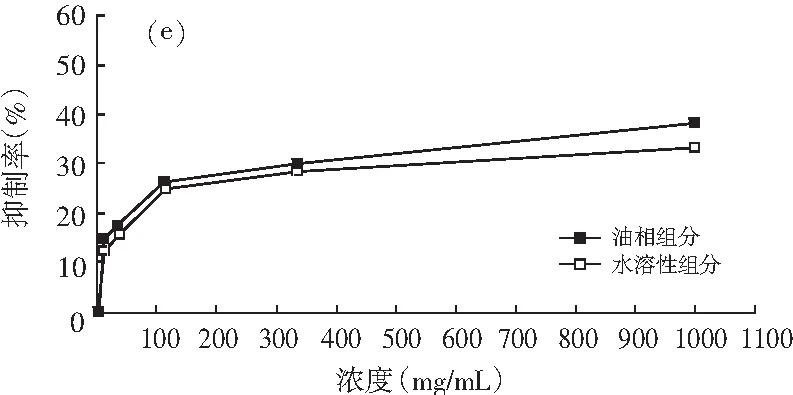
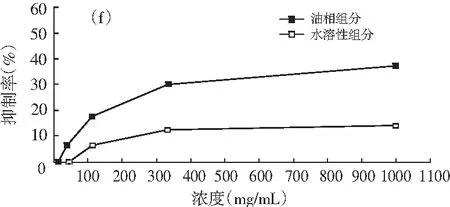
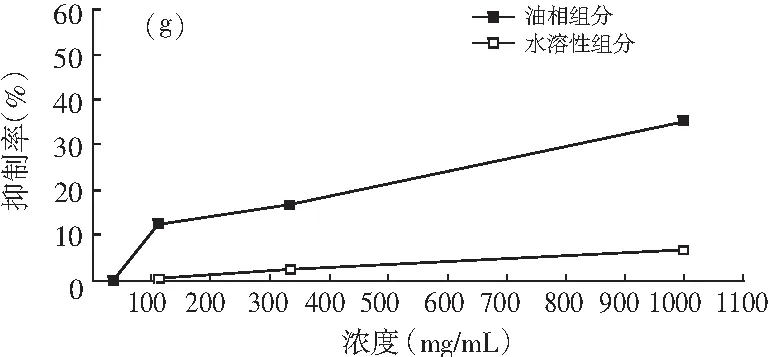
图1 油相组分和水溶性组分对同一菌种的抑制作用
注:(a)为大肠杆菌;(b)为产气肠杆菌;(c)为枯草芽孢杆菌;(d)为啤酒酵母;(e)为酿酒酵母;(f)为青霉;(g)为黑曲霉。
由图1可知,随着浓度的增加,油相组分和水溶性组分对供试菌种的抑制作用加强。不同浓度的油相组分对7种供试菌种的抑制效果均比水溶性组分好。八角茴香挥发性成分的抗菌性与其主要成分反式茴香脑密切相关,反式肉桂醛和甲基丁香酚也具有显著的抗菌效果[17-19]。由GC-MS分析结果可知,油相组分中反式茴香脑的相对含量明显比水溶性组分高,反式肉桂醛和甲基丁香酚也是油相组分的特征成分,这些都是对油相组分抗菌效果好于水溶性组分的有利证明。虽然油相组分对供试菌种的抑制效果比水溶性组分强,但是浓度为1000.0 mg/mL的水溶性组分对供试菌种也表现出一定的抑制效果,分别达到39.13%(大肠杆菌),33.33%(产气肠杆菌),36.36%(枯草芽孢杆菌),37.33%(啤酒酵母),33.33%(酿酒酵母),14.32%(青霉),6.67%(黑曲霉),尤其是对供试细菌和酵母菌抑制效果好于霉菌。
琼脂-孔洞扩散法测定油相组分抑菌活性的培养皿照片。

图2 琼脂-孔洞扩散法测定油相组分抑菌活性的培养皿照片
注:a为大肠杆菌;b为产气肠杆菌;c为枯草芽孢杆菌;d为啤酒酵母;e为酿酒酵母;f为青霉;g为黑曲霉。
由图2可知,抑菌圈形状完整、清晰,此方法测定结果准确可靠。
2.4 油相组分和水溶性组分对不同菌种的抑制活性比较
油相组分和水溶性组分对不同菌种的抑制作用比较结果见图3。
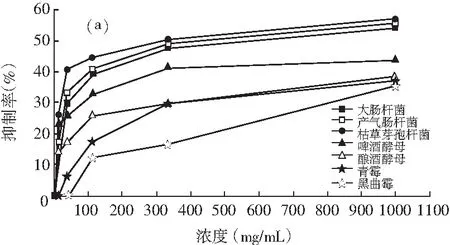
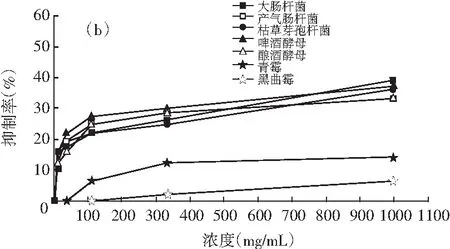
图3 油相组分和水溶性组分对不同菌种的抑制作用
注:a为油相组分,b为水溶性组分。
由图3中a可知,油相组分对细菌的抑制作用最强,其次是酵母,最后是霉菌,对枯草芽孢杆菌抑制效果最好,黑曲霉对油相组分最不敏感。油相组分对3种细菌的抑制作用由强到弱的顺序为:枯草芽孢杆菌>产气肠杆菌>大肠杆菌,说明其对革兰氏阳性菌的抑制作用大于革兰氏阴性菌,这与Wang等人报道的结果一致,油相组分对啤酒酵母的抑制作用高于酿酒酵母,对青霉的抑制效果好于黑曲霉。由图3中b可知,浓度为1000.0 mg/mL的水溶性组分对大肠杆菌的抑制效果最好,其次是啤酒酵母,对黑曲霉的抑制效果最差,而浓度为333.3,111.1,37.0 mg/mL的水溶性组分对啤酒酵母表现出最强的抑制效果,这点与油相组分不同。此外,水溶性组分对啤酒酵母的抑制作用高于酿酒酵母,对青霉的抑制效果好于黑曲霉,这点与油相组分的规律一致。
3 结论
本文比较了八角茴香挥发性成分的油相组分和水溶性组分的化学组成和抗菌活性,结论如下:油相组分的和水溶性组分的提取率分别为8.50%和4.19%,挥发性成分的总提取率为12.69%,两者均为浅黄色透明液体,油相组分八角茴香气味更加浓烈。油相组分和水溶性组分各鉴定出12种和45种化合物,分别占各自总量的100.000%和98.076%,两者共有组分9种。油相组分的特征成分是茴香醛、反式肉桂醛和甲基丁香酚,水溶性组分的特征成分类型是烷烃、酯和羧酸等。油相组分和水溶性组分的最主要成分都是反式茴香脑,含量分别为94.897%(油相组分)和70.520%(水溶性组分),收集水溶性组分可使反式茴香脑的收率得到很大提高。随着浓度的增加,油相组分和水溶性组分对供试菌种的抑制作用加强。虽然油相组分对7种供试菌种的抑制效果都比水溶性组分强,但高浓度的水溶性组分对供试菌种也表现出一定的抑制效果。油相组分对枯草芽孢杆菌抑制效果最好,水溶性组分对啤酒酵母展现出很强的抑制效果。在实验浓度范围内,油相组分和水溶性组分对供试青霉和黑曲霉抑制效果较弱。综上所述,八角茴香挥发性成分的水溶性组分不仅具有一定的抑菌效果,而且反式茴香脑的含量也很高,还富含多种油相组分没有的化合物类型,因此,在提取八角茴香挥发性成分的油相组分同时,还应该收集并利用水溶性组分,达到八角茴香挥发性成分的综合利用。
[1]Costa Cristina,Lucera Annalisa,Conte Amalia,et al.In vitro and in vivo application of active compounds with anti-yeast activity to improve the shelf life of ready-to-eat table grape[J].World Journal of Microbiology and Biotechnology,2013,29(6):1075-1084.
[2]K Vatavali,L Karakosta,C Nathanailides,et al.Combined effect of chitosan and oregano essential oil dip on the microbiological, chemical, and sensory attributes of red porgy (Pagruspagrus) stored in ice[J].Food and Bioprocess Technology,2013,6(12):3510-3521.
[3]Wang Lina,Liu Fei,Jiang Yanfeng,et al.Synergistic antimicrobial activities of natural essential oils with chitosan films[J].Journal of Agricultural and Food Chemistry,2011,59(23):12411-12419.
[4]王琴,蒋林,温其标,等.气质联用对不同提取法的八角茴香油化学成分的分析[J].食品工业科技,2006,27(10):189-192.
[5]Dragana Kocevski,Muying Du,Jianquan Kan,et al.Antifungal effect ofAlliumtuberosum,Cinnamomumcassia,andPogostemoncablinessential oils and their components against population ofAspergillusspecies[J].Journal of Food Science,2013,78(5):731-737.
[6]Cai Ming,Guo Xiangyang,Liang Hanhua,et al.Microwave-assisted extraction and antioxidant activity of star anise oil fromIlliciumverumHook.f.[J].International Journal of Food Science & Technology,2013,48(11):2324-2330.
[7]Athanasios C Kimbaris,George Koliopoulos,Antonios Michaelakis,et al.Bioactivity ofDianthuscaryophyllus,Lepidiumsativum,Pimpinellaanisum,andIlliciumverumessential oils and their major components against the West Nile vectorCulexpipiens[J].Parasitology Research,2012,111(6):2403-2410.
[8]Wang Qin,Ou Zibian,Lei Hanwu,et al.Antimicrobial activities of a new formula of spice water extracts against foodborne bacteria[J].Journal of Food Processing and Preservation,2012,36(4):374-381.
[9]李瑞红,王宗义,仝其根.不同提取方法制得茴香油的甄别研究[J].中国粮油学报,2012,27(11):50-53.
[10]王同禹,田玉红.八角茴香水溶性挥发成分的提取和分析[J].安徽农业科学,2009,37(14):6308-6309.
[11]程丽娟,薛泉宏.微生物学实验技术(第二版)[M].北京:食品科学技术出版社,2012:30,61.
[12]Wang Dacheng,Sun Suhua,Shi Lina,et al.Chemical composition,antibacterial and antioxidant activity of the essential oils ofMetaplexisjaponicaand their antibacterial components[J].International Journal of Food Science and Technology,2015,50(2):449-457.
[13]王树林,王蕊,王秀玉.藏茴香水溶性抑菌活性成分的分离与纯化研究[J].食品研究与开发,2015,36(12):31-35.
[14]李祖光,许丹倩,徐振元.八角茴香挥发性风味成分的研究[J].中国调味品,2003(10):13-15,20.
[15]Soher E Aly,Bassem A Sabry,Mohamed S Shaheen,et al.Assessment of antimycotoxigenic and antioxidant activity of star anise (Illiciumverum) in vitro[J].Journal of the Saudi Society of Agricultural Sciences,2016,15(1):20-27.
[16]Yang Chenghong,Chang Fangrong,Chang Hsuehwei,et al.Investigation of the antioxidant activity ofIlliciumverumextracts[J].Journal of Medicinal Plants Research,2012,6(2):314-324.
[17]Huang Yongfu,Zhao Jianglin,Zhou Ligang,et al.Antifungal activity of the essential oil ofIlliciumverumfruit and its main component trans-anethole[J].Molecules,2010,15(11):7558-7569.
[18]Afef Ben Arfa,Laurence Preziosi-Belloy,Pascale Chalier,et al. Antimicrobial paper based on a soy protein isolate or modified starch coating including carvacrol and cinnamaldehyde[J].Journal of Agricultural and Food Chemistry,2007,55(6):2155-2162.
[19]Carmen M G,Carlos A G,Ana M C,et al.Use of herbs and spices for food preservation: advantages and limitations[J].Current Opinion in Food Science,2015(6):38-43.
Comparison of Oil-phase Components and Water-soluble Components of Star Anise Volatile Constituents
LI Ping, SHEN Xiao-xia, SHU Ting, SHI Chun-tao
(College of Basic Science,Tianjin Agricultural University,Tianjin 300384,China)
Objective: The chemical composition and antimicrobial activities of oil-phase components and water-soluble components of star anise volatile constituents are compared in this study. Methods: The oil-phase components of star anise volatile constituents are extracted by steam distillation, and the water-soluble components are also obtained from the distillation residues with petroleum ether as solvent. The chemical composition and antimicrobial activities of the two kinds of extracts are also investigated by gas chromatography-mass spectrometry(GC-MS)and agar-hole diffusion assay respectively.Results: The yield of oil-phase components and water-soluble components of star anise volatile constituents is 8.50% and 4.19% respectively, and the total yield of volatile constituents is 12.69%.12, 45 compounds are identified from the oil-phase components and water-soluble components, accounting for 100.000% and 98.076% of the total amount respectively.Moreover,the most abundant component in the two kinds of extracts is trans-anethole, and the content is 94.897% for oil-phase components and 70.520% for water-soluble components respectively. The oil-phase components show higher antimicrobial activity against all the seven tested strains than water-soluble components, however, the water-soluble components with high concentration also exhibit some degree of inhibitory effect.Bacillussubtilisis found to be the highly sensitive to the oil-phase components, and beer yeast is found to be the most sensitive to the water-soluble components among the tested strains. In addition, the inhibitory effects of oil-phase components and water-soluble components on the tested two molds are weak in the range of experimental concentration.Conclusion: The water-soluble components should be collected and used when extracting the oil-phase components in order to achieve the comprehensive utilization of star anise volatile components.
star anise; volatile constituent; oil-phase component; water-soluble component; chemical composition; antimicrobial activity
2016-11-16
李萍(1979-),女,天津人,讲师,硕士,研究方向:香辛料有效成分的提取和应用。
TS264.3
A
10.3969/j.issn.1000-9973.2017.05.009
1000-9973(2017)05-0042-07

