一株果胶酶产生菌的筛选、鉴定及其产酶条件研究
袁志辉
湖南科技学院生命科学与化学工程系,永州 425100
果胶酶(E.C.3.2.1.15)是一类分解果胶质的酶的总称[1],是含有多种组分的复合酶,在食品工业、医药工业、纺织工业、造纸工业、环境领域、生物技术领域、烟叶处理和饲料工业等行业或领域中具有广泛用途[2-5]。天然来源的果胶酶广泛存在于动植物和微生物中,但由于材料获取不易、提取条件复杂等原因,动植物来源的果胶酶难以大规模的提取制备。而微生物具有生长周期短,培养条件简单易控,分布范围广泛等优势,因此微生物成为果胶酶生产和提取的重要来源。
目前生产微生物果胶酶的菌种很多,来源极其广泛,包括细菌、霉菌、酵母菌和放线菌。如芽孢杆菌属(Bacillus)、青霉属(Penicillum)、欧文氏菌(Erwinia)、根霉属(Rhizopus)、曲霉属(Aspergillus)、克鲁维酵母属(Kluyveromyces)、侧孢霉属(Sporotrichum)、多子菌属(Polyporus)、密螺旋体菌属(Treponema)、酵母属(Saccharomyces)、刺盘孢属(Colletotrichum)、螺孢菌属(Spirillospora)、假单胞菌属(Pseudomonas)、毛霉属(Mucor)、毕赤氏酵母属(Pichia)等。细菌在微生物中具有生长时间更短,生长条件更为简单的特点,因此本文以细菌为研究目标,从富含果胶质的土壤中筛选分离能高效产生果胶酶的菌株。
1 材料与方法
1.1 材料
1.1.1 土样
湖南省永州市零陵区郊苎麻地表层土壤。
1.1.2 试剂
果胶,美国 Sigma公司产品;3,5-二硝基水杨酸、KH2PO4、K2HPO4、乙酸铜,国药集团化学试剂有限公司产品;乙二胺四乙酸二钠,天津纵横兴工贸有限公司产品;蛋白胨,北京奥博星生物技术有限公司产品;葡萄糖、蔗糖等均为国产化学分析纯试剂。
富集培养基(g/L):牛肉膏2,蛋白胨2,NaCl 5,K2HPO41,KH2PO40.3,pH 7.0-7.2,分别逐量加入果胶至5、10、15、20 g/L完成富集驯化过程。分离培养基(g/L):果胶 5,蛋白胨 20,酵母抽提物 5,NaCl 5,牛肉膏 5,琼脂 20,pH 7.0-7.2。产酶液体培养基(g/L):果胶10,LB肉汤培养基21,pH 7.0-7.2。基准培养基(g/L):葡萄糖 10,蛋白胨 10,K2HPO41,KH2PO40.3,pH 7.0-7.2。所有培养基均为121℃灭菌20 min。
1.2 方法
1.2.1 富集驯化
称取土壤样品1 g,加入到一个盛有99 mL无菌水带有玻璃珠的三角瓶中,将样品充分打散、混匀,即成10-2泥浆稀释液,然后再按10倍稀释法依次稀释到10-5。吸取10 mL稀释液至90 mL富集培养基中,37℃振荡培养1~2 d。
1.2.2 初筛分离
取富集培养液10 mL梯度稀释至10-5,然后取1 mL稀释液均匀涂布于分离培养基平板上37℃倒置培养1~2 d。将待鉴定的菌落用牙签转移到另一分离培养基平板上,37℃培养2~4 d;往培养皿中加入适量的饱和乙酸铜溶液,染色15 min;弃去染液,若细菌产生果胶酶,则在菌落的周围会出现清晰的透明圈,依据是否产生透明圈来选择产酶菌株[6]。将得到的产酶菌株进行划线纯化,用于下一步的复筛。
1.2.3 复筛及酶活测定
通过DNS法测定果胶酶活性进行复筛[7]。将纯化后的菌落接种到30 mL产酶液体培养基中,于37℃、180 rpm下振荡培养48 h,培养液3000 rpm、4℃离心5 min,上清液即为粗酶液。取0.5%果胶溶液5 mL与5 mL粗酶液混合,37℃温育0.5 h,沸水浴中加热5 min灭活。取1 mL反应液与1 mL DNS试剂、8 mL蒸馏水混合,沸水浴加热5 min,迅速冷却。用分光光度计在540 nm处测其吸光度值C。对照液配制:沸水浴加热灭活10 min的0.5 mL的稀释酶液与0.5 mL 0.5%果胶溶液充分混合。
隐匿阴茎是一种先天性外生殖器畸形,指原本正常的阴茎被埋藏于皮下,包皮口与阴茎根距离短。病因是由于胚胎发育期间,正常延伸至生殖结节的尿生殖窦远端发育不全所致[3]。外观呈“鸟嘴样”或“山丘样”(图1)。按压阴茎周围皮肤可暴露正常的阴茎体,放手后恢复原状。儿童隐匿性阴茎的诊断成立,需要具备5个条件:①阴茎外观似宝塔状,②具有发育正常的阴茎体,③下按阴茎周围组织可显示阴茎全貌,松开后即恢复如初,④需排除其他先天性尿道疾患及海绵体发育不良的阴茎疾患,⑤排除肥胖病因。
酶活=(A×S×D×1000)/(0.5×10)
式中,A为吸光度,S为测得光吸收在标准曲线上对应的半乳糖醛酸量,D为酶液的稀释系数。标准曲线的制作参考王薇[1]等的方法。在以上测定条件下,1 min水解果胶产生1 μg还原糖(以半乳糖醛酸计)所需酶量定义为1个酶活力单位(U)。
1.2.4 菌株的形态学和生理生化鉴定
按《伯杰细菌鉴定手册》(第8版)中菌种鉴定方法进行。
1.2.5 产酶条件优化
分别将不同碳源、氮源、pH值替代基准培养基中相应因素及不同生长时间和生长温度进行单因素实验。根据单因素实验结果选取碳源浓度、氮源浓度及pH值3个重要因素,进行3因素3水平L9(33)正交实验。根据得出的最佳产酶条件进行实验验证并测定其酶活。
2 结果与分析
2.1 菌株筛选
经过富集培养基的驯化及分离培养基的初筛分离,从采集的土样中共获得能够产生水解透明圈的菌株11株。DNS法测定酶活的结果表明,在筛选到的11个菌株中,最高酶活为312 U/mL,最低酶活为107 U/mL。将最高酶活的菌株命名为HYL6,将其作为进一步研究对象。
2.2 菌株鉴定
HYL6菌株在分离培养基上的特征为:菌落较大,乳白色,表面干燥,中央有褶皱,不透明。油镜观察菌体形态及革兰氏染色、芽孢染色结果显示:菌体呈直杆状,两端为圆形,无荚膜,鞭毛侧生,单个细胞大小约为0.8×3 μm,革兰氏染色为阳性,产芽孢,大小约为0.8×1.5 μm,形状圆柱形,位置靠近细胞中央。生理生化实验结果见表1。综合菌落特征、菌体形态及生理生化特征,初步判断HYL6为芽孢杆菌属。

表1 HYL6菌株生理生化特性Table 1 Biochemical and physiological characteristics of strain HYL6

葡萄糖Glucose +蔗糖Sucrose +尿素Urea -明胶液化Gelatine hydrolysis +马尿酸盐Hippurate -D-阿拉伯糖 D-Arabinose +甘露醇Mannitol +M.R. +产气Gas producing -接触酶Catalase -V.P. -柠檬酸盐利用Utilization of Citrate +吲哚Indole +溶菌酶Lysozyme +
2.3 产酶条件优化
2.3.1 最佳产酶时间
在产酶液体培养基中,37℃、180 rpm培养不同时间,菌株HYL6产果胶酶情况见图1。由图可知,培养液中果胶酶活力的变化趋势与细菌的生长曲线较相似,即在细菌生长的不同阶段,其产酶活力会发生变化,说明果胶酶的产生与其生长有着较为密切的关系。果胶酶活力在HYL6生长至34 h达到最大,为320 U/mL。

图1 不同生长时间产酶活力曲线Fig.1 The curve of pectinase production at different growth period
2.3.2 最佳产酶温度
在产酶液体培养基中,不同培养温度、180 rpm培养34 h,菌株HYL6产果胶酶情况见图2。由图可知,发酵温度为36℃时,果胶酶活力最高,为309 U/mL,此温度与HYL6的最佳生长温度37℃接近,因此也可以37℃作为最佳产酶温度。生长温度大于36℃时,果胶酶活力下降,在38℃时,下降幅度不大,酶活为298 U/mL。当温度高于38℃时,酶活出现明显的下降,至42℃时,其活力降为143 U/mL。这种现象与HYL6在偏离最佳生长温度之外的生长情况是一致的。

图2 不同生长温度下产酶活力Fig.2 Pectinase production at different culturing temperature
2.3.3 最佳产酶pH值
将HYL6接种于不同pH值的产酶液体培养基中,36℃、180 rpm振荡培养34 h,产果胶酶情况见图3。从图上可以看出,在pH6-8的范围内,HYL6都能产生较高的果胶酶活,其中在pH7.5时为最高的321 U/mL。

图3 不同生长pH值下产酶活力Fig.3 Pectinase production at different culturing pH
2.3.4 最佳产酶氮源
将HYL6菌株接种于用10 g/L不同氮源替代基础培养基中的蛋白胨,pH 7.5、36℃、180 rpm振荡培养34 h,产果胶酶情况见图 4。由图可知,(NH4)2SO4为氮源时酶活最低102 U/mL,以蛋白胨为氮源时活力最高为204 U/mL。

图4 不同氮源条件下产酶活力Fig.4 Pectinase production at different nitrogen sources conditions
2.3.5 最佳产酶碳源
用不同碳源取代基础培养基中的葡萄糖,pH 7.5、36℃、180 rpm振荡培养34 h进行最佳产酶碳源研究,结果见图5。由图可知,产酶活力最高碳源为可溶性淀粉,为321 U/mL。

图5 不同碳源条件下产酶活力Fig.5 Pectinase production at different carbon sources conditions
2.3.6 果胶酶发酵最佳条件
根据以上实验结果,设计了3因素3水平的正交试验(3个重复),分析结果见表2。
由表2结果可知,对果胶酶发酵影响最大是pH值,发酵最佳的条件组合是A1B3C2即可溶性淀粉5 g/L,蛋白胨15 g/L,pH 值7时,36 ℃、180 rpm 振荡培养34 h。验证实验结果显示,利用这一条件组合进行发酵,产生的果胶酶活力可达415 U/mL。
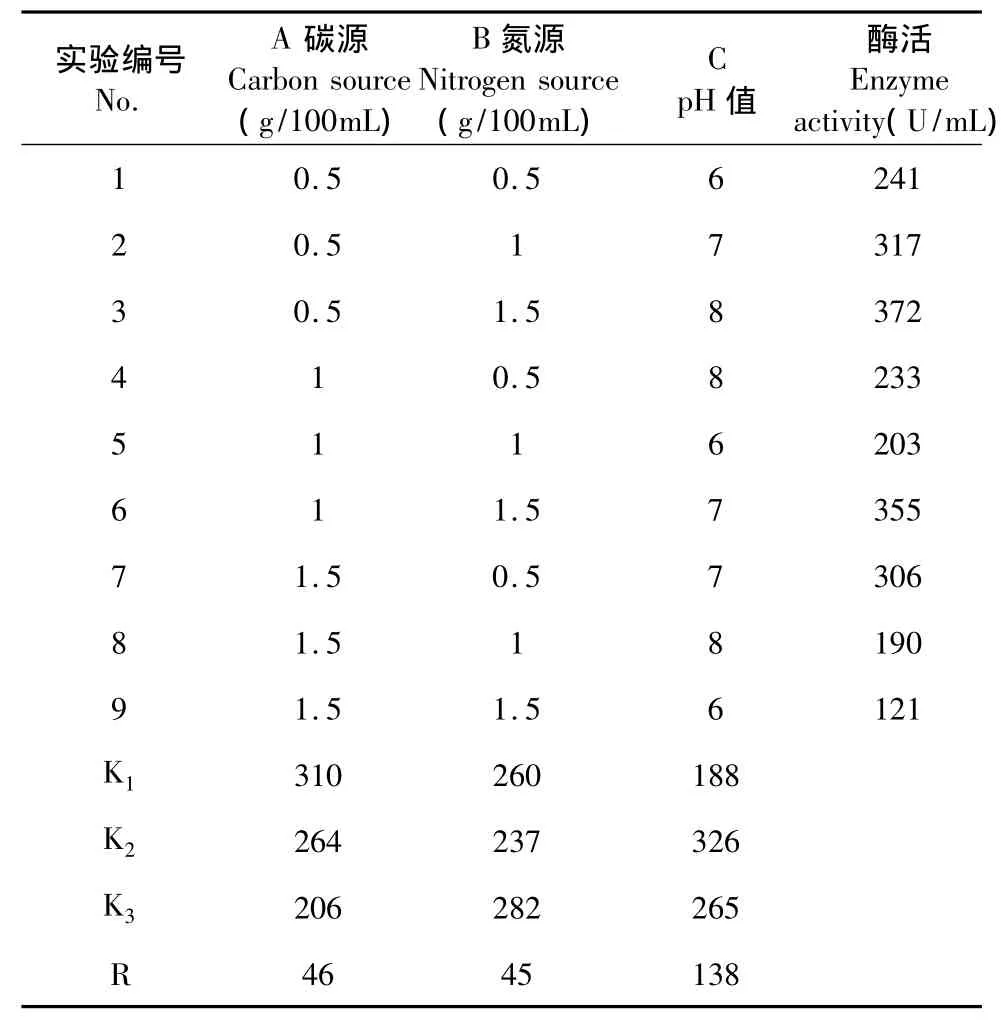
表2 果胶酶发酵的正交试验表Table 2 Result of orthogonal test for pectinase fermentation
3 结论
从富含果胶质的土壤中取样,经过确定一套有效可行的筛选方法,从中筛选出11株能够在含果胶的平板上产生水解透明圈的细菌菌株。通过DNS法测定酶活,选择一株产酶活力最高的菌株命名为HYL6,进行鉴定及初步的发酵条件优化研究。
HYL6菌株经过形态学观察和生理生化实验初步确定为芽孢杆菌属。通过一系列产酶因素的研究,确定最佳产酶生长时间为34 h,最佳产酶生长温度为36℃,最佳利用碳源和氮源分别是可溶性淀粉和蛋白胨,pH值为7.5。在单因素研究的水平上选择碳源、氮源、pH值进行3因素3水平正交试验,结果表明发酵最佳的条件组合是:可溶性淀粉5 g/L,蛋白胨15 g/L,pH值7时,36℃、180 rpm振荡培养34 h。验证实验确证了这一结果。
用HYL6菌株在正交实验优化的条件下进行发酵,最高产酶活力可达415 U/mL,该结果与王媛等[8]的10758 U/mL相比有较大差距,但其所使用的菌株是何种何属在结果中没有报道,并且其所采用酶活单位在文中也没有明确定义,因此不具可比性。而同是芽孢杆菌属产果胶酶发酵条件研究的翟秋梅等[9]并没有说明其产酶活力大小,因此也无从比较。因此只能从本文所筛选到的11株菌进行比较,本研究所选择的菌株产酶活力比筛选到的最低产酶活力高出大约4倍,具备进一步研究的潜力如通过人工诱变的方法进一步提高其产酶活力。
1 Wang W(王薇),Zhang X(张琇),Bao YW(包邑汶),et al.Separation of pectinase producer and study on its pectinase-producing condition.J Anhui Agric Sci(安徽农业科学),2011,39:11944-11946.
2 El-Sheekh MM,Ismail AS,El-Abd MA,et al.Effective technological pectinases by Aspergillus carpus NRCI utilizing the Egyptian orange juice industry scraps.Int Biodeterior Biodegrad,2009,63:12-18.
3 Ahlawat S,Dhiman SS,Battan B,et al.Pectinase production by Bacillus subtilis and its potential application in biopreparation of cotton and micropoly fabric.Process Biochem,2009,44:521-526.
4 Kashyap DR,Vohra PK,Chopra S,et al.Applications of pectinases in the commercial sector:a review.Bioresour Technol,2001,77:215-227.
5 Dai TC(代同成),Fan JQ(范坚强),Zheng HN(郑湖南),et al.Identification of pectin-degrading strains isolated from tobacco strips and evaluation of its pectinase activity.Microbiol Chin(微生物学通报),2011,38:816-824.
6 Chen J(陈静),Wang SJ(王淑军),Yang CF(杨从发),et al.Screening and breeding of pectinase producer.J Huaihai Inst Technol:Nat Sci Ed(淮海工学院学报),1999,8(3):63-65.
7 Gu YS(顾燕松).Method for determination of pectinase activity used as biological textile auxiliaries.Tex Sci Res(纺织科学研究),2002,3:29-35.
8 Wang Y(王媛),Han SY(韩舜愈),Zhu X(祝霞),et al.Screening of pectinase producing strains and optimizing of its fermentation condition.J Gansu Agric Univ(甘肃农业大学学报),2010,45:117-121.
9 Zhai QM(翟秋梅),Xue WW(薛卫巍),Xue YC(薛永常),et al.The optimization of pectinase fermentation from Bacillus subtilis FM208849.J Dalian Polytech Univ(大连工业大学学报),2010,29(2):93-97.

