四乙胺对Aβl-40致伤的神经干细胞的存活及其Caspase-3表达的影响
盛宝英 田嘉莹 田国忠 齐志国 熊庆华
·论著·
四乙胺对Aβl-40致伤的神经干细胞的存活及其Caspase-3表达的影响
盛宝英 田嘉莹 田国忠 齐志国 熊庆华
目的探讨钾通道阻滞剂四乙胺(tetraethy-lammonium, TEA)在Aβl-40致伤的神经干细胞增殖及凋亡中的作用。方法Aβl-40与神经干细胞共孵育,诱导神经干细胞损伤,以 TEA作用于Aβl-40致伤的神经干细胞,利用MTT 法和比色法分别检测神经干细胞在不同的时间点的存活率及Caspase-3活性。结果Aβl-40可使神经干细胞的存活率降低,呈时间依赖性; Aβl-40与神经干细胞在不同的时间点共孵育后,Caspase-3活性逐渐增加,在24 h达到高峰;加入TEA后,Aβl-40致伤的神经干细胞的存活率增加,Caspase-3活性表达下降。结论Aβl-40对神经干细胞的致伤作用可能与钾通道的激活相关,TEA能够降低Aβl-40对神经干细胞的致伤作用,减少神经干细胞的凋亡为治疗阿尔茨海默病提供了新的方法。
阿尔茨海默病;四乙胺;β-淀粉样多肽;神经干细胞
阿尔茨海默病(Alzheimer’s disease, AD)是与衰老相关, 以严重的高级认知功能障碍为特征的隐袭性、逐渐性进展的退行性脑病[1,2]。AD 发病机制极其复杂, 主要病理学特点是β-淀粉样多肽(Aβ)聚集形成的老年斑(SP) 和神经原纤维缠结 (NFT) 的形成, 伴脑皮质层神经元减少[3,4]。在研究中发现,AD患者常伴发大脑海马区的萎缩和神经干细胞的减少。同时也证实Aβ具有神经元毒性作用[5]和诱导神经干细胞的凋亡[6],Aβ诱导的神经元凋亡的同时均伴随钾通道激活,尤其是延迟整流钾电流增强[7]。TEA是钾通道阻滞剂,研究证实心肌细胞凋亡中钾通道阻滞剂能起到保护和抑制的作用[8]。本研究以钾离子通道阻滞剂TEA作用于Aβl-40诱导的神经干细胞,观察神经干细胞存活和Caspase-3活性的变化,探讨Aβ致伤的神经干细胞凋亡时钾通道阻滞剂TEA在其中的作用。
1 资料与方法
1.1实验动物、主要试剂及仪器 雄性 Wistar 大鼠(<24 h),由佳木斯大学动物中心提供;DMEM/F12(Gibco); 四乙胺(tetraethylammonium,TEA)、四甲基偶氮唑蓝(MTT)、多聚赖氨酸 (Sigma公司);胎牛血清(北京中杉金桥公司);酶标计数仪ELX800(Bio-TEK公司);Aβ1-40(Biosouxee公司);Caspase分析试剂盒(美国Promega公司)。Nestin(北京博奥森生物技术有限公司);IBE2003倒置荧光显微镜(重庆光学仪器厂)。
1.2大鼠海马区神经干细胞的分离与传代培养及鉴定 新生的Wistar 大鼠(<24 h),无菌操作打开颅腔并取海马组织,用Hank’s液进行漂洗,将组织剪成1 mm3左右的小块加入培养液(DMEM/F12 1 ∶ 1,2%B27,bFGF 20 μg/L,表皮生长因子20 μg/L)5 ml,细滴管轻轻吹打后,制成单细胞悬液,调整一定浓度后接种于培养瓶中,将其放入5%CO2培养箱中,每3 d换半量培养液一次,每7 d传代一次,方法同上。取传代培养的神经球涂布在0.01%多聚赖氨酸的无菌盖玻片上,37℃,5%CO2培养箱培养2 h后,用0.01 mPBS漂洗,吹干后行Nestin细胞免疫化学检测。
1.3实验分组 实验共分四组:Aβ1-40组:在传三代后的神经干细胞加入Aβ1-405 μM;Aβ1-40+TEA组:在Aβ1-405 μM孵育前30 min加入TEA 5 mM;空白对照组:加入等量的培养液的神经干细胞培养组;TEA对照组:神经干细胞加入TEA 5 mM。上述各组分别在0 h,12 h,24 h和48 h个时间点行细胞活性及凋亡检测。
1.4MTT法检测神经干细胞的存活率 四组传代后的神经干细胞经不同处理后,停止培养前4 h将每孔加入MTT溶液(5 mg/ml)20 μl使终浓度为 1 mg/ml,放置37℃培养箱继续培养4 h,用翻板法将96孔板内的培养基弃去,在每孔中加入溶解液 DMSO 150 μl,振荡 10 min使其充分溶解结晶产物。在酶标仪上以波长570nm检测每孔的OD值。所检测OD值的大小可反映细胞代谢活性的强弱。每组设3个孔,实验重复3次,细胞存活率的计算:细胞存活率=试验组光吸收值/对照组光吸收值×100%。
1.5比色法检测神经干细胞Caspase-3的表达 将不同处理组的神经干细胞,用PBS在细胞表面漂洗两次,然后收集到EPPendoff管内,450×g,4℃离心10 min收集细胞。放于冰上,用冰冷的PBS漂洗一次,然后悬浮在100 μl细胞裂解缓冲液中。以液氮-常温的方式裂解细胞,然后在冰上孵育 15 min。15,000×,4℃离心 20 min后收集上清液。用Bradford方法测蛋白的浓度。按试剂盒依次在96孔板内依次加样。加2 μl DEVD-pNA底物(10 mM)到96孔板内。用parafilm封口膜将板子封严,37℃孵育4 h。在405nm测量吸光度。计算Caspase-3特异性活性。
2 结果
2.1神经干细胞培养及Nestin抗原表达 新生大鼠海马区新鲜分离的单个神经干细胞呈透亮的圆形(见图1),传代培养至第三代可见培养液中形成较大的神经球(见图2),神经干细胞标记性蛋白Nestin传代培养神经球的表达(见图3)。
2.2TEA对Aβ1-40诱导的神经干细胞存活率的影响 加入Aβ1-40后,神经干细胞在不同的时间点,细胞存活明显减少(P<0.05),且随时间延长,细胞存活减少的愈加明显。Aβ1-40+TEA组较Aβ1-40组细胞存活明显增加(P<0.05),而空白对照组和TEA对照组神经干细胞存活无明显改变(P>0.05),且细胞数明显增加。镜下可见细胞形态无明显示变化。(见表1)
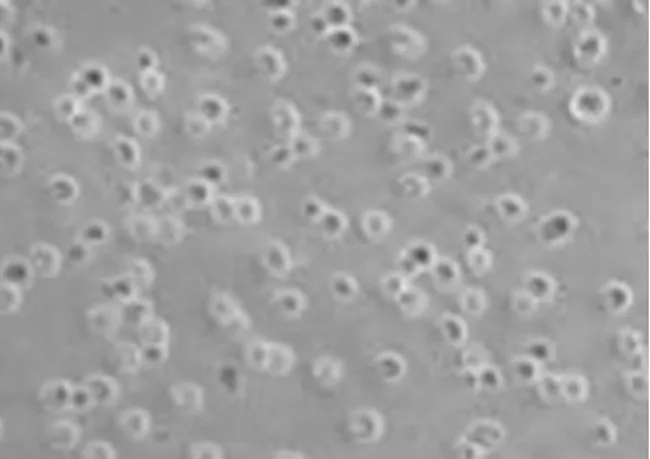
图1 新鲜分离的NSCs(×100)
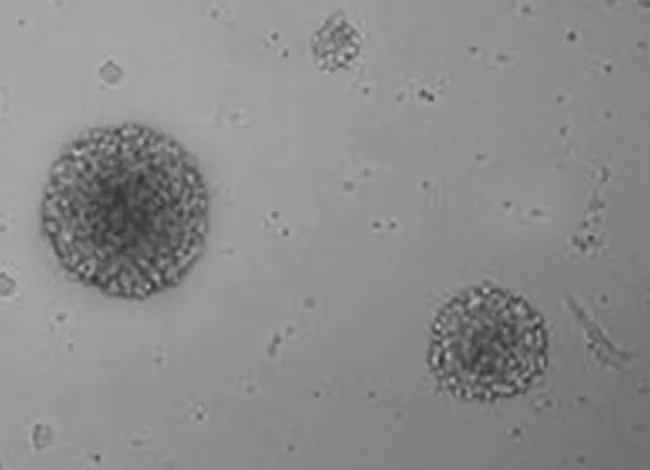
图2 传至第三代的NSCs(×200)

图3 NSCs呈Nestin阳性
2.3TEA对Aβ1-40诱导神经干细胞caspase-3活性的变化 Aβ1-40分别孵育后上述各时间点, Caspase-3活性逐渐增加(P<0.05),在24 h达到高峰(P<0.01)。与Aβ1-40+TEA组在各时间点均可降低Caspase-3的表达(P<0.05),特别在24 h这种趋势更为明显(P<0.01),而空白对照组和TEA对照组在0 h,12 h,24 h和48 hCaspase-3特异性活性未发生明显改变(见表2)
表1 不同培养时间各组神经干细胞存活率的变化
注:1.Aβ1-40组与空白对照组相比,aP<0.05;2.Aβ1-40+TEA组与Aβ1-40处理组相比,bP<0.05;
表2 不同时间点各组神经干细胞Caspase-3活性的变化
注:Aβ1-40组与空白对照相比,aP<0.05;12 h Aβ1-40组与24 hAβ1-40组相比,bP<0.01;48 h Aβ1-40组与24 h Aβ1-40组相比,cP<0.01;Aβ1-40+TEA组与Aβ1-40组相比,dP<0.05;24 hAβ1-40组与24 hAβ1-40+TEA组相比,eP<0.01
3 讨论
正常脑组织中在室管膜下区、海马和脉络膜丛存在大量的神经干细胞,这些细胞增生活跃,特别在缺血缺氧情况下,可刺激这些区域神经干细胞的增殖、迁移并分化。研究表明,AD患者的上述各区神经干细胞数目明显减少,且分化不良。其具体的致病原因还不十分清楚。本实验研究发现,Aβ1-40致伤后神经干细胞增殖减速,且凋亡增加,可能是导致其中的致病机体发病原因之一。以往研究表明AD患者神经元减少,凋亡明显[9]。在本实验中可见与Aβ1-40共同培养后,神经干细胞的存活减少,凋亡增加,这也可能是AD患者神经干细胞无法分化成为神经元,而导致神经元缺失增多的原因。
凋亡,是能量依赖细胞内程序性死亡。在通常情况下,组织细胞发育和细胞更新,进而保持组织细胞的动态平衡中,凋亡起到相当重要的作用。但是在一些化学、物理、环境或遗传学等方面的损伤因素作用下可介导病理性自主性有序性的细胞死亡[10]。
凋亡不仅由基因调控,凋亡的启动有多种机制,特别是细胞内的离子稳态尤其是K+的稳态调控在凋亡中起重要作用。有研究发现,将神经元培养液中加入一定浓度的Aβ1-40后,神经元细胞膜钾通道被异常激活,同样胆碱能干细胞株SN56神经元与Aβ共培养也得到相同的结果,TEA抑制Aβ1-40毒性68%以上[11]。本研究发现将钾通道阻滞剂TEA加入Aβ1-40致伤的神经干细胞后,可将神经干细胞的存活率增加,而凋亡率下降。这说明钾通道在Aβ1-40致伤神经干细胞,调控凋亡中起到一定的作用。在对AD患者中的研究也同样发现,延迟整流钾通道异常激活,电流密度增加,神经元存活减少,钾通道阻滞剂TEA阻断此通道或者高K+均可抑制外向电流,延长动作电位时程,升高细胞内[Ca2+]浓度,从而抑制神经元的Aβ1-40毒性[12]。该结果与本实验的神经干细胞被Aβ1-40致伤后TEA发挥的作用基本相似。
凋亡信号起动Caspase-3活化[13],活化的Caspase-3作用于底物蛋白,促进底物分解,引起凋亡[14]。因此,通过 检测Caspase-3 的活性大小即可了解细胞凋亡的变化。本实验中,Aβ1-40致伤神经干细胞后,Caspase-3活性增加,且其活性与时间呈正比,当达到一定时间后这种比例关系破坏,即Caspase-3活性不会因时间延长而增加,而是保持相当的活性水平。这种作用在被TEA所阻断,外源性钾离子通道阻滞剂TEA能够降低Aβl-40对神经干细胞的致伤作用,减少神经干细胞的凋亡。虽然神经干细胞Aβ1-40致伤后钾通道通过什么途径激活神经干细胞凋亡,其机制还不是十分清楚,但神经干细胞钾通道阻滞剂TEA在AD患者中的变化对研究AD的发病机制和药物干预提供新的思路。
[1] Villaflores OB, Chen YJ, Chen CP, et al.Curcuminoids and resveratrol as anti-Alzheimer agents. Taiwanese journal of obstetrics & gynecology,2012 Dec;51(4):515-525.
[2] Baenekow A, Jahn R, Seheller M. Synaptophysin: A substrate for the Protein tyrosine kinase PP60 csrc in intact synaptic vesicles. oneogene,1990,5(6):1019-1024.
[3] Bailey JA, Lahiri DK, et al. Neuronal differentiation is accompanied by increased levels of SNAP-25 protein in fet al rat primary cortical neurons:implications in neuronal plasticity and Alzheimer’s disease.Annals of the New York Academy of Sciences,2006,Nov,1086:54-65.
[4] Vescovi AL, Parati EA. Gritti A, et al.Isolation and cloning of multi-potential stem cells from the embryonic human CNS an establishment of transplantable human neural stem cell lines byepigenetic stimulation. Exp Neurol,1999,156(1):71-83.
[5] Liu YH, Giunta B, Zhou HD, Tan J, et al. Immunotherapy for Alzheimer disease-the challenge of adverse effects. Nature reviews. Neurology,2012,8(8):465-469.
[6] He P, Shen Y, et al. Interruption of beta-catenin signaling reduces neurogenesis in Alzheimer’s disease. the official journal of the Society for Neuroscience, 2009, 20; 29 (20):6545-6557.
[7] Yu HB, Li ZB, Zhang HX, et al. Role of potassium channels in Abeta(1-40)-activated apoptotic pathway in cultured cortical neurons. neuroscience research,2006,84 (7):1475-1484.
[8] Nishikawa S, Tatsumi T, Shiraishi J, et al.Nicorandil regulates Bcl-2 family proteins and protects cardiac myocytes against hypoxia-induced apoptosis.Mol Cell Cardiol,2006,Apr;40(4):510-519.
[9] Yagi T, Ito D, Okada Y, et al. Modeling familial Alzheimer’s disease with induced pluripotent stem cells. Clinical neurology,2012; 52 (11):1134-6.
[10] Verweij FJ, Middeldorp JM, Pegtel DM, et al. Intracellular signaling controlled by the endosomal-exosomal pathway. Communicative & integrative biology,2012, 5(1):88-93.
[11] Yu SP, Farhangrazi ZS, Ying HS, et al. Enhancement of outward potassium current may participate in β-amyloid peptide-induced cortical neuronal death. Neurobiol Dis, 2007, 5:81-88.
[12] Yu SP, Yeh CH, Gottron F, et al. Role of the outward delayed rectifier K+current in ceramide-induced caspase activation and apoptosis in cultured cortical neurons.J Neurochem, 2008, 73:933-941.
[13] Hughes Jr FM, Bortner CD, Purdy GD, et al. Intracellular K+suppresses the activation of apoptosis in lymphoeytes.J Biol Chem, 2001, 272:30567-30576.
[14] Ho TC, Chen SL, Yang YC, et al. Cytosolic phospholipase A2-{alpha} is an early apoptotic activator in PEDF-induced endothelial cell apoptosis. American journal of physiology. Cell physiology, 2009, 296 (2):273-284.
Theeffectsoftetraethyl-lammoniumtothesurvivalandCaspase-3expressionofAβl-40-inducedneuralstemcells
SHENGBao-ying,TIANJia-ying,TIANGuo-zhong,etal.
ObjectiveUsing tetraethyl-lammonium (TEA), this acts as a potassium channel blocker, to interfere the Aβl-40-injured neural stem cells (Aβl-40-NSCS),and observing the survival and Caspase-3 expression of Aβl-40-NSCS, we wants to know the effects of potassium channels blocker TEA in the proliferation and apoptosis of Aβl-40-NSCS.MethodsWe incubated neural stem cells with Aβl-40(TEA), which were known as the Aβl-40-injured neural stem cells (Aβl-40-NSCS). Then the Aβl-40-NSCS were dealt with TEA. We measured the survival and Caspase-3 activity of Aβl-40-NSCS at different time points by MTT and colorimetric methods.ResultsA certain concentration of Aβl-40can reduce the survival of NSCS, which was time dependent. The Caspase-3 activity of the Aβl-40-NSCS gradually increased and reached the peak at 24 h Caspase-3 activity. Treated with TEA, the survival rates of the Aβl-40-NSCS increased and the expression of Caspase-3 activity decreased.ConclusionAβl-40 can induce the injury of NSCS, resulting in decreased proliferation, survival and increased apoptosis of NSCS. The TEA, which acts as a potassium channel blocker, can reduce the injury effects of Aβl-40to NSCS and apoptosis of NSCS. Therefore, the injury effects of Aβl-40to NSCS may be related with the activation of pstassium ion channels, and the TEA may be a new molecule target of Alzheimer’s disease.
Alzheimer’s disease; Tetraethy-lammonium; Aβ; Neural Stem Cells(NSCs)
黑龙江省佳木斯大学研究生创新科研项目资金(项目编号:YJSCX2011-021JD);黑龙江省科学技术研究项目(项目编号:2012772)
154000 佳木斯大学

