抗微小隐孢子虫Apple结构域单克隆抗体的制备*
张 颖 孔令聪 张 静 赵 权** 尹继刚**
(1.吉林农业大学动物科学技术学院, 长春 130118; 2. 人畜共患病教育部重点实验室,吉林大学人畜共患病研究所,长春 130062)
隐孢子虫Cryptosporidiumparvum是一种在医学和兽医学上危害严重的重要寄生原虫,该虫可感染包括人类在内的大多数脊椎动物,引起免疫正常个体的自限性腹泻,及免疫功能受损患者的渐进性、致死性腹泻。顶复器原虫有一个共同的侵入机制,是依赖于侵入虫体顶端特殊的分泌器官(微线、棒状体和致密颗粒) 分泌的一系列物质,以一种独特的滑移运动方式侵入宿主细胞(Dubremetzetal.,1998)。
Apple结构域属于PAN蛋白超家族的一类,该蛋白家族已在纤溶酶原相关蛋白中发现,如凝血因子VI,血浆前激肽释放酶、肝细胞生长因子和巨噬细胞刺激因子,同时在一些线虫蛋白也发现了该结构域。Apple/PAN结构域含有3个保守的二硫键可稳定其三级结构,但在一级结构水平上的同源性通常较低,这可能与其不同的配体结合特性相关。Apple/PAN结构域也存在于一些顶器门原虫的微线蛋白中,如EtMIC5、TgMIC4 和TRAP-C1(Carruthersetal.,2008)。对TgMIC4的研究表明,该蛋白质通常与TgMIC1和TgMIC6形成复合体。TgMIC4的前2个apple 结构域与TgMIC的TSR-like结构域直接作用,如果没有TgMIC1,TgMIC4不能与宿主细胞结合(Saourosetal.,2005)。近来的研究发现(Kelleretal.,2004),含有Apple结构域的TgAMA1 蛋白能够与棒状体颈部蛋白(RON)形成并维持活动连接的结构,参与虫体的侵入过程。为了更好地研究隐孢子虫含有Apple结构域蛋白的功能,本研究利用PCR方法从牛微小隐孢子虫子孢子cDNA文库中克隆得到cgd3-520序列中的Apple结构域基因,并对其进行原核表达,以纯化的GST-Apple重组蛋白为免疫原,制备了高特异性的抗重组Apple单克隆抗体,为进一步研究Apple结构域类蛋白功能,及探索隐孢子虫黏附侵入机制奠定基础。
1 材料与方法
1.1 实验材料
大肠埃希菌DH5α、BL21、原核表达载体pGEX-4T-1为本实验室传代保种;微小隐孢子虫cDNA文库为本实验室构建;骨髓瘤细胞购自中科院上海细胞库;Balb/c小鼠购自吉林大学基础医学院实验动物中心;Ex Taq DNA聚合酶、DNA Marker、BamHI、XhoI和T4 DNA连接酶、IPTG购自大连宝生物公司(TaKaRa);碱性磷酸酶标记的山羊抗小鼠IgG抗体、显色剂BCIP/NBT、弗氏完全佐剂、弗氏不完全佐剂为Sigma公司产品;HT培养基、HAT选择培养基、胎牛血清、1640培养液为HyClone公司产品;凝胶片段回收纯化试剂盒和质粒提取试剂盒购自Axygen公司;鼠单克隆抗体亚类检测试剂盒为Sigma产品。
1.2 方法
1.2.1微小隐孢子虫Apple结构域基因的体外扩增:根据微小隐孢子虫基因库中cgd3-520序列中的编码Apple结构域基因加上相应酶切位点,设计并合成引物: Apple:上游(5′-GGATCCGGATCATCATTTACAGGA-3′)下游:(5′-CTCGAGTCATGGACAAGAAACTGACC-3′),下划线部分为酶切位点。以本实验室已构建的微小隐孢子虫cDNA文库为模板,PCR扩增目的基因。
1.2.2微小隐孢子虫Apple结构域基因的克隆:将扩增的Apple结构域基因纯化的PCR产物与克隆载体pMD18-T于16℃连接12 h,将连接产物转化至感受态大肠埃希菌DH5α中。从LB平板上挑取单个菌落,将其接种在含有氨苄青霉素的液体LB培养基中,37℃摇床培养过夜,用质粒提取试剂盒提取质粒,用限制性内切酶BamHⅠ、XhoⅠ进行双酶切鉴定,将阳性克隆命名为pMD18-T-Apple,送至上海生工测序鉴定。
1.2.3质粒pGEX-4T-1与Apple 基因的连接及重组质粒的转化:将pMD18-T-Apple质粒和pGEX-4T-1质粒分别用BamHⅠ、XhoⅠ双酶切后进行凝胶电泳。胶回收试剂盒回收Apple结构域基因的目的片段与表达质粒pGEX-4T-1,并用T4 DNA连接酶16℃连接12 h。将连接产物转化到大肠埃希菌BL21感受态中,涂板后提取质粒并酶切鉴定。阳性质粒送至上海生工测序鉴定。将阳性重组质粒命名为pGEX-4T-1-Apple。
1.2.4GST-Apple重组蛋白的表达及纯化:阳性重组菌1%接入200 mL含氨苄青霉素的LB培养基中,37℃震荡培养至菌液OD值达到0.6,液体中加入IPTG诱导表达4 h,12%SDS-PAGE分析。应用Gluthathione-Sepharose 4B亲和纯化GST融合蛋白。整个纯化过程在低温下进行,以减缓重组蛋白的降解速度。纯化结果用12%SDS-PAGE分析,并用抗GST抗体对重组蛋白进行Western-blot分析,将纯化后的重组蛋白命名为GST-Apple。
1.2.5动物免疫:选择8周龄Balb/c雌性小鼠,以纯化的GST-Apple作为免疫原,首免用20 μg与等体积弗氏完全佐剂乳化,腹腔免疫;在首免后第14、28 d,用20 μg与弗氏不完全佐剂乳化,腹腔免疫。在第42 d尾尖采血,分离血清并用间接ELISA方法检测效价。
1.2.6细胞融合:融合前3 d用20 μg免疫原溶液不加佐剂尾部静脉注射加强免疫。按常规方法进行融合(Kohler,1976)。将SP2/0细胞与免疫脾细胞按1∶10比例混合,在50%聚乙二醇(PEG 1500)作用下融合, 用HAT培养液悬浮,滴入96孔板,于37℃,5%CO2培养箱中培养,第10 d后改用HT培养液,第20 d后改用20%1640完全培养液。
1.2.7单克隆抗体的的筛选及亚克隆:常规融合后10~12 d,待细胞集落长至1/4培养孔大小时,用已建立的ELISA技术进行检测、筛选。阳性克隆孔采用有限稀释法进行3次亚克隆,阳性率约达到100%时可扩大培养。
1.2.8诱生腹水:在预先1周注射石蜡油致敏的Balb/c小鼠腹腔接种已建立的杂交瘤细胞约1×106个,待1周后腹腔膨大,采取腹水并3 500 r/min离心10 min,去除沉淀,取上清,分装后冻存于-80℃备用。
1.2.9Ig亚型与亚类鉴定:用阳性杂交瘤细胞株培养上清,参照Ig亚类与亚型试剂盒产品说明书进行操作。
1.2.10单克隆抗体的Western-blot分析:将纯化的重组蛋白GST-Apple进行SDS-PAGE后,半干法转印至NC膜上,10%脱脂牛奶37℃封闭 1 h,分别加入2H6株和5F11株杂交瘤细胞培养上清作为一抗,于37℃孵育1 h,PBST洗涤4次;加入AP标记的羊抗小鼠IgG作为二抗,于37℃孵育1 h,PBST洗涤4次,加入BCIP/NBT显色。
1.2.11间接ELISA法测定抗体效价:以免疫GST-Apple小鼠血清为阳性对照,未免疫小鼠血清为阴性对照,PBS为空白对照。重组GST-Apple蛋白以10 μg/mL包被ELISA板,将两株单抗按1∶4 000、1∶8 000倍比稀释至1∶8.192×106,二抗为1∶2 000稀释的羊抗小鼠IgG,PNPP显色后用酶标仪读取数值。
2 结果
2.1 重组质粒的PCR、酶切鉴定和测序
扩增产物经1%琼脂糖凝胶电泳观察, Apple基因在100~250 bp之间有一条带,与目的基因210 bp大小相符(图1)。

图1 微小隐孢子虫含Apple结构域基因的PCR扩增Fig.1 PCR amplification of Apple gene of Cryptosporidium parvumM: DL2000 DNA marker;1~2: Apple基因PCR产物.M: DL2000 DNA marker;1-2: PCR amplification of Apple gene.
pGEX-4T-1-Apple重组表达质粒经BamHⅠ和XhoⅠ双酶切验证,1%琼脂糖凝胶电泳观察酶切产物,在100~250 bp之间及5 000 bp附近可见条带(图2)。经酶切鉴定的阳性克隆菌,送至上海生工生物公司测序。测序结果用DNAMAN与cDNA文库中的Apple基因序列对比,碱基序列完全正确。

图2 重组质粒pGEX-4T-1-Apple酶切验证Fig.2 Identification of recombinant pGEX-4T-1-Apple by enzyme digestionM: DL2000 DNA marker;1~2: BamHⅠ和XhoⅠ双酶切pGEX-4T-1-Apple.M: DL2000 DNA marker; 1-2: pGEX-4T-1-Apple digested by BamHⅠ+ XhoⅠ.
2.2 GST-Apple重组蛋白的表达与纯化
经表达条件摸索分析,GST-Apple重组蛋白在25℃,0.1 mmol/L条件下呈可溶性高效表达,将诱导表达后的菌体裂解液上清用Gluthathione-Sepharose 4B纯化,并用SDS-PAGE和Western-blot分析,得到较纯的目的条带,重组蛋白大小约为34 kDa(图3~4)。

图3 纯化后的重组蛋白GST-Apple的SDS-PAGE分析Fig.3 SDS-PAGE analysis of purified recombinant GST-AppleM: 低分子量蛋白marker; 1~2: 纯化后的GST-Apple蛋白; 3: 纯化后的GST载体蛋白.M: Protein mid-molecular weight marker;1-2: The purified product of recombinant GST-Apple; 3: The purified GST protein.
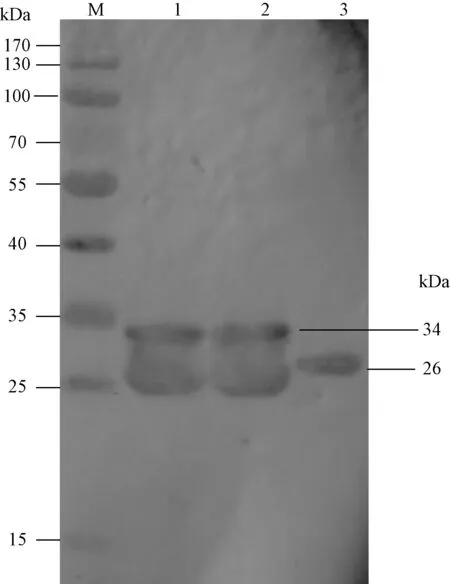
图4 GST-Apple重组蛋白的Western-blot分析Fig.4 Western-blot of recombinant GST-Apple proteinsM:预染marker; 1~2:纯化后的GST-Apple蛋白; 3: 纯化后的GST载体蛋白.M: Prestained protein Marker; 1-2: The purified product of recombinant GST-Apple; 3: The purified GST protein.
2.3 免疫小鼠的效价测定
常规间接ELISA方法分别测定3只Balb/c小鼠的血清效价,血清稀释倍数为100、200、400、800、1 600、3 200、6 400、12 800、25 600、51 200,结果证明3只小鼠血清51 200倍稀释均为阳性,适宜融合。
2.4 杂交瘤细胞株的建立
本实验融合2次,铺6块96孔板进行细胞培养,融合7天后观察其融合率为51%。用纯化的GST-Apple重组蛋白和GST载体蛋白进行筛选,其中15个孔为阳性,经3次亚克隆筛选,得到2株分泌抗体仅与GST-Apple重组蛋白反应而与GST蛋白不发生反应的杂交瘤细胞株,命名为2H6和5F11。挑取单个克隆进行扩大培养,每传2代检测1次效价,至20代以上仍然呈稳定阳性,扩大培养后液氮冻存,经复苏后对细胞上清进行检测仍保持抗体分泌能力。
2.5 抗体类型及亚型
检测得知2株杂交瘤细胞分泌的重链均为IgG1,轻链均为κ。
2.6 单克隆抗体的特异性鉴定
Western-blot结果显示2株单抗均能与GST-Apple重组蛋白发生特异性结合,与GST载体蛋白无反应(图5),表明这两株单抗能够特异性识别重组Apple结构域蛋白。

图5 单克隆抗体识别重组蛋白GST-Apple的Western-blot 分析Fig.5 Western-blot analysis of McAbs VS recombinant Apple proteinsM:预染marker;1: 2H6株细胞上清与GST蛋白;2: 5F11株细胞上清与 GST蛋白;3: 2H6株细胞上清与 GST-Apple重组蛋白;4: 5F11株细胞上清与 GST-Apple重组蛋白.M. Prestain marker;1: 2H6 culture supernatant with GST protein; 2: 5F11 culture supernatant with GST protein; 3: 2H6 culture supernatant with recombinant GST-Apple protein; 4: 5F11 culture supernatant with recombinant GST-Apple protein.
2.7 抗体效价
2H6、5F11两株单抗稀释后均能与重组蛋白GST-Apple发生特异性反应,且2H6腹水效价可达1∶1.024×106倍、5F11腹水效价可达1∶2.048×106倍。
3 讨论
原虫和宿主细胞间相互作用是近几年国内外研究的热点之一。隐孢子虫子孢子表膜配体与宿主上皮细胞表面受体的识别黏附是虫体侵入的关键(Sandersonetal., 2008)。很多含Apple结构域蛋白广泛存在于顶复器原虫,如弓形虫MIC4(Beghettoetal., 2005; 李学瑞等, 2007)、艾美耳球虫MIC5(Perizetal., 2007)和肉孢子虫的SML-2蛋白(Mulleretal., 2011)。弓形虫的MIC4含有6个Apple结构域,每个Apple结构域包含6个保守的半胱氨酸残基,已证实其C末端的6个Apple结构域为主要的黏附区域,其中第5个Apple结构域具有半乳糖结合活性(Marchantetal., 2012)。Brown等(2000)克隆了艾美耳球虫的MIC5基因,该基因全长3 334 bp,编码1个分子量约为105 kDa的蛋白质。序列分析表明,MIC5在结构上含有11个半胱氨酸序列,组成4个Apple结构域,其Apple结构域与血栓凝聚因子XI和血浆前激肽释放酶等结构相似,都与细胞黏附相关。结构域分析提示,MIC5可能在子孢子附着和侵入宿主细胞过程中介导蛋白与受体的相互作用,从而促进子孢子的侵入。最新的研究发现,弓形虫PL104蛋白质含有11个Apple/PAN结构域,可介导与宿主细胞的黏附(Gongetal., 2012)。肉孢子虫的微线体蛋白SML-2属于半乳糖外源凝集素类,通过Apple结构域形成二聚体形式,Apple结构域的末端还有半乳糖支架结构,是SML-2蛋白的高度特异性结合位点(Mulleretal., 2011),其半乳糖结合位点与弓形虫的MIC4蛋白的半乳糖结合位点高度相似,并且Apple结构域所特有的高度疏水特性和内部的24个氢键可以稳定二聚体结构,以此来增强寄生虫表面蛋白对水解作用的抵抗性,保证虫体在终末宿主肠道中的存活。
与已报道的制备抗隐孢子虫单克隆抗体方法相比,本实验采用原核表达并纯化的可溶性Apple结构域蛋白代替天然蛋白作为免疫原,这样可以减少了阳性杂交瘤细胞株筛选的工作量,而且更容易获得特异性的单克隆抗体(吴锦雅等, 2005)。在杂交瘤细胞的筛选过程中,本实验采用Apple结构域重组蛋白筛选出阳性杂交瘤细胞株后,还用GST载体蛋白对阳性杂交瘤细胞株进行负筛选,以排除假阳性,保证制备的单克隆抗体为针对Apple结构域蛋白表位,从而得到免疫反应亲和力强,特异性好的单克隆抗体杂交瘤细胞株。为定位微小隐孢子虫含Apple结构域蛋白质和其功能的研究奠定了基础。

