猪附红细胞体DnaJ基因PCR诊断方法的建立及应用
张 影,贾立军,薛书江,钱年超,张守发
(延边大学农学院动物医学系,吉林 延吉133002)
附红细胞体病是由附红细胞体(Mycoplasma)寄生于多种动物和人红细胞表面及血浆、骨髓内而引起的一种人兽共患病。目前,针对附红细胞体病的诊断已建立了多种检测技术,补体结合试验、荧光抗体试验、间接血凝试验、酶联免疫吸附试验等血清学技术已用于检测附红细胞体抗体[1-3]。但国内外比较公认的是检测到病原体的存在,常用的方法有姬姆萨染色镜检病原体和PCR检测核酸的方法,Gwaltneys等证实PCR方法是进行附红细胞体病诊断和研究的一种有价值的方法,而且具有较高的特异性和敏感性[4-6]。本试验选择了猪附红细胞体热休克蛋白DnaJ基因建立猪附红细胞体病PCR诊断方法,旨在为猪附红细胞体病的快速诊断建立准确、特异、敏感的检测技术。
1 材料与方法
1.1 血样来源 猪附红细胞体阳性血样由延边大学预防兽医学实验室鉴定并保存,53份待检猪血液样品采自吉林省延边地区。
1.2 试剂 血液基因组DNA提取试剂盒、dNTP、ExTaq酶、琼脂糖、DNA Marker 2 000等,均购自宝生物工程(大连)有限公司;其他试剂为进口或国产分析纯产品。
1.3 引物设计 根据GenBank上发表的猪附红细胞体(猪支原体 NC_015153.1)全基因组序列中DnaJ基因序列,应用Primer Premier 5.0和Oligo 6.31软件设计了1对特异的引物D1和D2,由上海生工生物工程技术服务有限公司合成。
引物序列为:上游D1:5′-ATCATCCCGACATTAACAA-3′;下游 D2:5′-CCCATTCCCTTTAGT-TTCA-3′。
1.4 附红细胞体DNA的提取 猪附红细胞体阳性血样基因组DNA按照全血基因组DNA提取试剂盒的操作说明书进行。
1.5 PCR扩增、退火温度的筛选 以提取的猪附红细胞体DNA为模板,进行PCR扩增,反应条件:94℃预变性5min,94℃变性30s,退火温度梯度为53℃~59℃45s,30个循环,最后72℃延伸5min。
1.6 PCR扩增产物的回收、鉴定与测序 将868 bp的PCR扩增产物片段按照DNA提取试剂盒说明对目的片段进行回收纯化,经琼脂糖凝胶电泳检测正确后,将回收的目的片段克隆连接到pMD18-T载体上,转化到大肠杆菌E.coliDH5α感受态细胞中,在氨苄平板上筛选出阳性克隆,将阳性克隆菌送往上海英骏生物技术有限公司测序。
1.7 特异性试验 分别以犬新孢子虫、牛附红细胞体、犬附红细胞体、牛瑟氏泰勒虫的DNA为模板,按照最佳反应条件进行PCR扩增,琼脂糖凝胶电泳检测结果。
1.8 敏感性试验 用紫外分光光度仪测定上述提取的猪附红细胞体DNA的OD260nm值,计算DNA含量。以10倍为梯度连续稀释成6个不同浓度,用最佳反应条件进行PCR扩增,以此来确定PCR方法的敏感性。
1.9 DnaJ基因PCR与姬姆萨染色镜检的比较 将采自吉林省延边地区的53份待检猪血液样品,进行DnaJ基因PCR检测,同时与姬姆萨染色镜检进行比较。
2 结果与分析
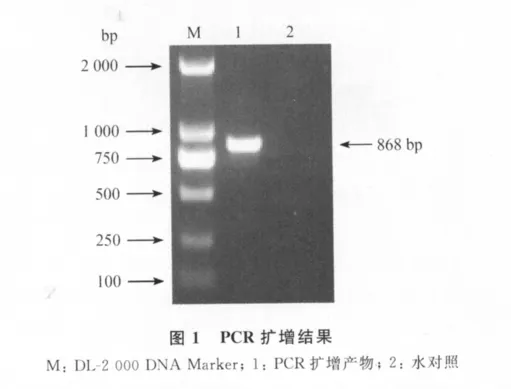
2.1 PCR扩增 以猪附红细胞体DNA为模板,经PCR扩增出大小为868bp的基因片段,与预期结果相符(图1)。
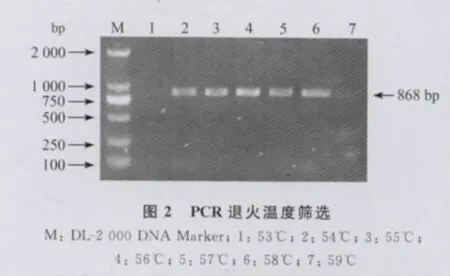
2.2 最适退火温度的筛选 对猪附红细胞体DNA进行梯度PCR扩增,在56℃时条带最亮,将56℃定为最佳退火温度(图2)。
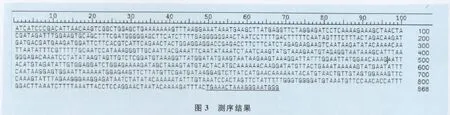
2.3 阳性质粒的测序结果 PCR产物测序结果如图3所示,下划线位置为引物位置,序列分析表明与GenBank中(NC_015153.1)同源性为99%。
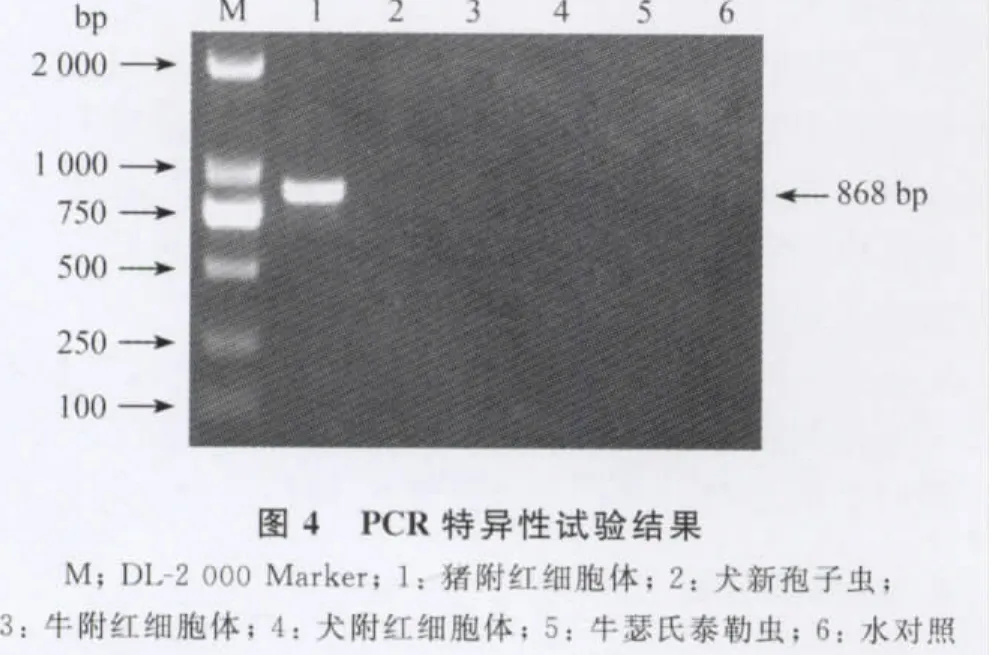
2.4 特异性试验 以猪附红细胞体、犬新孢子虫、牛附红细胞体、犬附红细胞体、牛瑟氏泰勒虫的DNA为模板,以D1、D2为引物,进行PCR扩增。结果显示,只有猪附红细胞体在868bp处扩增出了特异性条带,其他样品无特异性条带(图4),说明该方法具有较好的特异性。
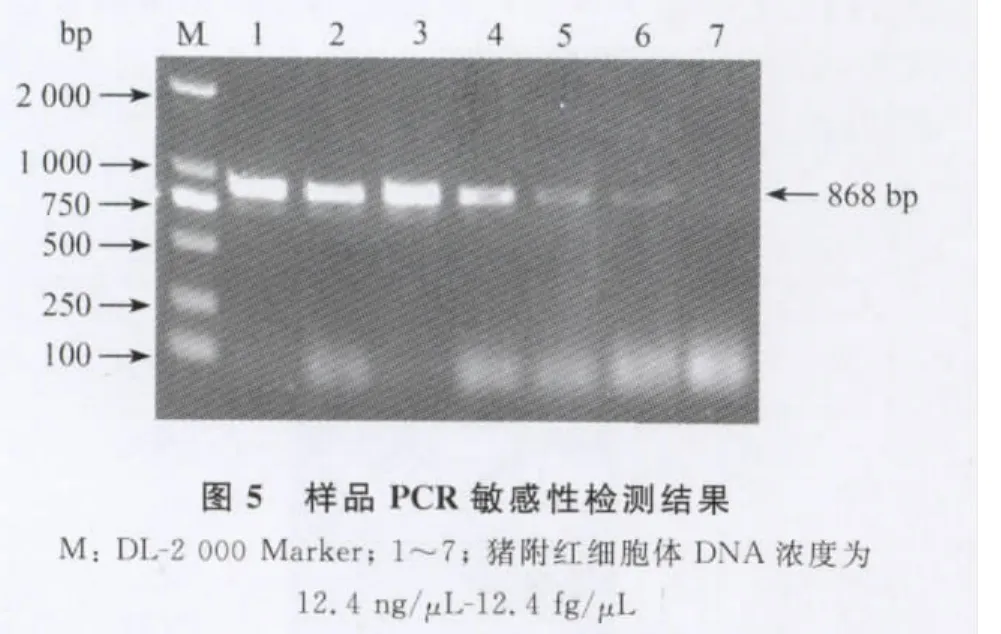
2.5 敏感性试验 取PCR检测为猪附红细胞体病阳性血液DNA,按101~106进行倍比稀释,用D1、D2引物对不同稀释倍数的DNA依次进行PCR扩增。结果显示,样品经稀释后,经PCR扩增能检出106倍稀释的DNA,此时DNA的浓度值为124fg/μL。
2.6 DnaJ基因PCR与姬姆萨染色镜检的比较以53份猪血液样本DNA为模板,进行DnaJ基因PCR扩增,与姬姆萨染色镜检结果进行比较。结果显示,检测的53份血液样本,DnaJ基因PCR方法的猪附红细胞体阳性检出率为86.8%(46/53),姬姆萨染色镜检方法的猪附红细胞体的阳性检出率为15.1% (8/53),其中染色镜检为阳性的血液样本,PCR检测也均为阳性(表1)。

表1 DnaJ基因PCR扩增和姬姆萨染色镜检方法的比较
3 讨论
近年来,由于附红细胞体病具有广泛的流行性、高度的感染性,该病的感染动物数量和种类也呈上升趋势[7-8]。有关附红细胞体病的病原学、分子生物学诊断技术的研究已取得了一定进展,其中PCR方法具有快速、敏感、准确等特点,对猪附红细胞体病的检测具有高度的特异性和敏感性,对隐性感染猪群具有良好的检测效果。本试验经对53份现地血液样品的检测发现,PCR检测则为阳性率高于姬姆萨染色镜检阳性率,说明本试验建立的PCR检测方法比染色镜检方法更为敏感,能够检测到猪附红细胞体病的隐性感染,为提早的预防和治疗该病提供了重要的参考价值。
本试验基于猪附红细胞体DnaJ基因的序列,设计一对特异性引物,经PCR扩增出约868bp大小的基因片段,并进行PCR条件的优化,建立了猪附红细胞体DnaJ基因PCR检测技术。通过血涂片姬姆萨染色镜检和PCR方法对53份血样进行猪附红细胞体的检测比较,结果PCR检测方法的阳性检出率明显高于姬姆萨染色镜检,进一步证明了PCR检测方法的灵敏度高,更适合对猪附红细胞体的检测。
[1] Heinritzi K.A contribution on splenectomy in swine[J].Tierarztl Prax,1984,12:451-454.
[2] Ludwig E H,Dagmar A,Katharina H.Development of a diagnostic PCR assay based on novel DNA sequences for the detection ofMycoplasmasuis(Eperythrozoonsuis)in porcine blood[J].Veterinary Microbiology,2003(93):185-196.
[3] Gwaltney S M,Oberst R D.Comparision of an improved polymerase chain reaction protocol and the indirect hemagglutination assay in the detection ofEperythrozoonsuisinfection[J].Journal Veteri-nary Diagnosis Investigation,1994,6(3):321-325.
[4] 王妍,张守发,刘思国,等.猪附红细胞体PCR检测方法的建立[J].中国农业科学,2005,38(10):2153-2156.
[5] Oberst R D,Hall S M,Schoneweis D A.Detection ofEperythrozoonsuisDNA from swine blood by whole organism DNA hybridizations[J].Veterinary Microbiology,1990,24:127-134.
[6] 韩子强,杨宏军,李建基.动物附红细胞体病的研究进展[J].动物科学与动物医学,2002,19(7):21-24.
[7] 王君玮,王志亮,张喜悦.猪附红细胞体研究进展[J].中国动物检疫,2003,20(7):44-46.
[8] 李月梅,薛书江,其木格,等.应用PCR方法调查东北三省部分地区猪附红细胞体病流行情况[J].畜牧与兽医,2008,40(11):36-37.

