AC133抗原联合EpCAM识别转移性结直肠癌干细胞的研究
杜航向 杨治力 杨逸 盛能全 王志刚
结直肠癌是全球高发的消化系统恶性肿瘤,其发病率不断上升,在中国肿瘤死因中占第4位[1]。尽管结直肠癌的诊疗水平不断提高,但术后复发率高,五年生存率低。肿瘤干细胞是肿瘤细胞中具有自我更新和多向分化能力的细胞亚群,在肿瘤中所占比例很小[2],被认为是肿瘤耐药、复发和转移的根源[3-6]。
肿瘤干细胞表面标志分子是存在于肿瘤细胞表面的特异性蛋白分子,是肿瘤干细胞的身份象征,可被用来筛选肿瘤干细胞。最初AC133抗原被发现选择性表达在人类胚胎的肝、骨髓、脐血及外周血CD+34造血细胞中[7],随着研究进展,在干细胞表面也发现有AC133抗原的表达。目前该抗原已被认为是一个崭新的、极有研究和应用价值的干细胞表面标志。
最近,结直肠癌中也发现了上皮细胞粘附分子(epithelial cell adhesion molecule,EpCAM)阳性的可疑肿瘤干细胞[8]。EpCAM是由GA-733-2基因编码的相对分子质量为40 000的糖蛋白,表达在人类大多数上皮细胞的基底侧,是最早被发现的肿瘤标志物之一。
肿瘤干细胞理论的提出及证实[9-11],为恶性肿瘤的诊断和治疗提供了新思路。近年来,肿瘤干细胞学说是肿瘤生物学领域非常重要的研究进展,该理论不但提供了肿瘤生成的可能原因,更解释了肿瘤产生抗药性导致难以治愈的可能原因。因此,对于各种肿瘤干细胞的鉴定及相关生物学理论的研究成为当前研究的热点[12-15]。
本研究尝试以EpCAM和AC133为肿瘤干细胞表面标记,对结直肠癌细胞进行标记后以流式细胞仪进行分选,从结直肠癌组织中分离出 AC133+EpCAM+结直肠癌干细胞,并对其进行生物学鉴定,以期为结直肠癌干细胞的功能研究奠定基础。
资料与方法
一、一般资料
50例结肠腺癌组织标本取自上海市第六人民医院普外科2012年6月至8月间接收手术治疗的结肠癌患者。其中,男性33例,女性17例;年龄41~83岁(中位年龄62岁)。术中冰冻切片及术后病理切片均证实为腺癌组织。术前术后未经过任何化疗药物干扰。组织获取均经过患者同意,并通过医学伦理委员会批准。
二、方法
1.主要试剂:藻红蛋白(PE)标记的AC133单抗(德国 Miltenyi Bio-tec公司),异硫氰酸荧光素(FITC)标记的 EpCAM抗体(美国 Ebioscience公司),DMEM/F12培养基(美国Hyclone公司),碱性成纤维生长因子(bFGF)、表皮生长因子(EGF)(美国 Peprotech公司),DMEM细胞培养基(美国GIBCO公司)。
2.实验动物:Balb/C裸鼠30只均购自上海实验动物中心,4~6周龄,体重15~20 g,雌雄不限,在无特殊病原体动物饲养室喂养。常规饲料喂饲和饮水。
3.肿瘤组织取材:取新鲜结肠癌患者手术后标本,0.9%生理盐水冲洗后切取肿瘤边缘约1 cm×2 cm大小的非坏死组织。用清洗液(青霉素1 mg/ml、卡那霉素 0.5 mg/ml、两性霉素 2.5 ug/ml的生理盐水)清洗癌组织5次,4℃保存液中保存备用。
4.原代结肠癌细胞提取:在无菌条件下,用细胞清洗液清洗肿瘤组织3次,将其剪碎后用9 ml清洗液清洗后收集到50 ml离心管中,加入0.25%分散酶 1.5 ml、0.4% 胶原酶 0.5 ml胎牛血清(FSC)50 ul,放入37℃培养箱中振荡消化1 h。离心后用60目筛网过滤,收集,再次离心后的组织与10 ml培养液混匀后放入25 cm2细胞培养瓶中过夜培养。第二天将上清悬浮细胞吸除,保留贴壁活性细胞。胰酶消化后用120目筛网过滤,计数后备用。
5.流式细胞术分选:取上述制备好的单细胞悬液1×106个/ml,加入20 ul PE标记的AC133抗体、80 ul FITC标记的 EpCAM抗体,4℃避光孵育30 min,用PBS漂洗后,用流式细胞仪分选AC133+EpCAM+细胞和AC133-EpCAM-细胞,收集待用,采用WinMDI 2.9软件分析流式细胞仪数据。
6.细胞的体外培养和形态观察:将 AC133+EpCAM+细胞和AC133-EpCAM-细胞在无血清培养基上进行传代培养,用倒置相差显微镜观察细胞形态变化及生长状况并拍照。
7.体外克隆形成实验:取对数生长期AC133+EpCAM+细胞和 AC133-EpCAM-细胞,0.25% 胰酶消化并吹打成为单细胞,用含20%胎牛血清的DMEM培养液调整细胞密度至1×106个/L,然后根据实验要求作梯度倍数稀释;用蒸馏水分别制备出1.2%和0.7%两个浓度的低熔点琼脂糖液,高压灭菌,维持在40℃确保不凝;按1:1比例使1.2%的琼脂糖液和2×DMEM培养基(含2×抗生素和20%小牛血清)混匀后,取3 ml混合液注入到直径6 cm的平皿中,冷却凝固,待用;按1:1比例使0.7%的琼脂糖液和2×DMEM培养基在无菌试管中混匀,再向管中加入0.2 ml的细胞悬液,充分混匀,注入待用的平皿中,形成双琼脂层,待上层琼脂凝固后,置于37℃ 5%CO2培养箱中培养10~14 d;把平皿放在倒置显微镜下,观察细胞克隆数,计算形成率。
8.多细胞球培养:取对数生长期的 AC133+EpCAM+细胞和 AC133-EpCAM-细胞,0.25% 胰酶消化后轻轻吹打,使之成为单细胞,用无血清培养基重悬,计数后,以小于104/ml密度接种至无血清培养基中进行常规培养;细胞培养液加入至T25或更小的玻璃培养瓶中,竖直放入培养箱培养,每2~3天半量换液,每6~8天传代一次;传代时离心收集微球体,重悬于胰酶替代品Accutase液中,37℃消化5~10 min,吹打数次至使之成为单细胞,离心洗涤后计数,种至无血清培养基中进行传代培养。
9.裸鼠成瘤实验:在裸鼠腋下将处于对数生长期的AC133+EpCAM+细胞和 AC133-EpCAM-细胞及其微球体细胞分别以3 ×103、3 ×104、3 ×105皮下接种,每3天观察一次肿瘤形成情况,连续观察4周后,处死小鼠取出肿瘤组织并测量其大小。
10.Transwell肿瘤细胞侵袭实验:将无血清培养液和Matrigel胶按2.5:1的比例混合均匀后包被到Transwell小室底部;取对数生长期的 AC133+EpCAM+细胞和AC133-EpCAM-细胞及其微球体细胞制备成单细胞悬液,将细胞浓度调整至1×104,加至小室,用含1%FBS的DMEM培养基培养;小室外加入含10%FBS的DMEM培养基;每组细胞重复3次,常规培养48 h后取出小室,擦去微孔膜上层细胞后,苏木素染色,显微镜观察微孔膜下层的细胞并计数;计算相对侵袭指数(V2/V1,其中 V1代表AC133+EpCAM+细胞或AC133-EpCAM-细胞的穿膜数,V2代表其微球体细胞的穿膜数)。
11.CCK-8法检测体外增殖力:AC133+EpCAM+及AC133-EpCAM-组细胞重悬于含EGF及bFGF的ATCC中,稀释为1x104/ml,以每孔200 uL接种于96孔板.共设1个空白对照组(无细胞的ATCC)和7个测定组。将接种好的96孔板进行培养,每间隔24 h以CCK-8法测定。以空白对照组调零,用酶联免疫检测仪于450 nm处测定各孔吸光度值,每种细胞每次测定3孔,取其平均值。以培养天数为横坐标,平均吸光度值为纵坐标,描绘细胞生长曲线。
三、统计学方法
采用SPSS11.0统计学软件进行数据分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1.AC133+EpCAM+细胞较 AC133-EpCAM-细胞表现出更好的折光性,细胞团直径更大,密度更高(图1)。
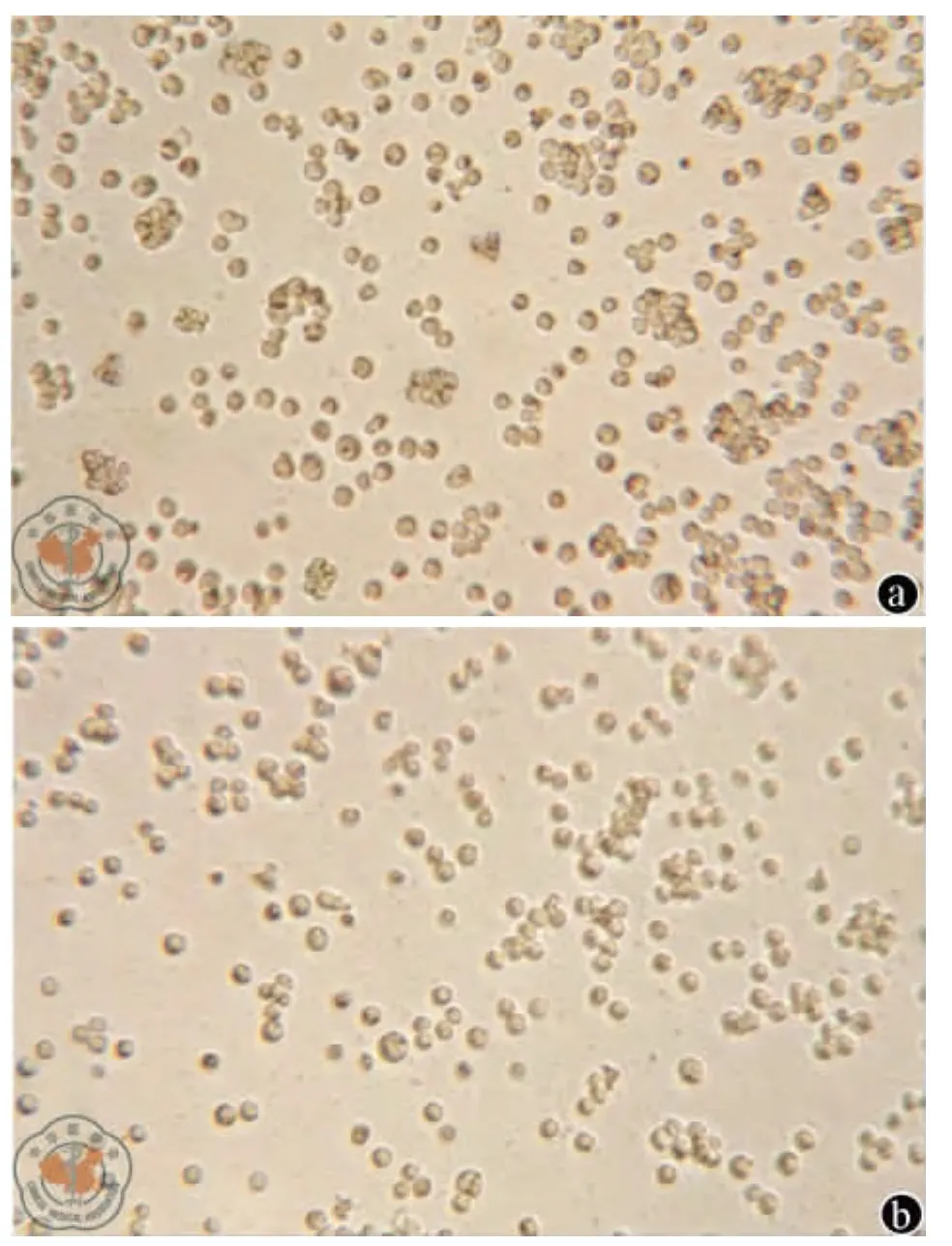
图1 AC133+EpCAM+细胞和AC133-EpCAM-细胞体外培养倒置相差显微镜观察图像
2.AC133+EpCAM+细胞和 AC133-EpCAM-细胞克隆形成实验结果:AC133+EpCAM+细胞和AC133-EpCAM-细胞在相同条件下前者较后者形成了更多的克隆细胞团,直径更大,密度更高(图2)。
3.AC133+EpCAM+细胞和 AC133-EpCAM-细胞微球体形成情况:培养24 h的细胞呈悬浮状态,有较小的细胞团块出现;3 d后可见大部分细胞呈碎渣样死亡,少数细胞成团长大,形态规则;6~8 d后可见到由数十到数百个细胞组成较大的圆形或卵圆形细胞微球体,致密均一,折光性良好,悬浮生长。传代培养后可见微球体的形成增多且形态趋于圆形(图3)。
4.裸鼠成瘤实验结果:AC133+EpCAM+结直肠癌干细胞具有很强致瘤性,100个AC133+EpCAM+结肠癌干细胞就能形成移植瘤,随着细胞数目的增多,成瘤率逐渐增高,肿瘤的直径增大;而AC133-EpCAM-细胞的成瘤能力相对很弱(图4,表1)。

图2 AC133+EpCAM+细胞和AC133-EpCAM-细胞克隆形成实验平皿在倒置显微镜下观察图像
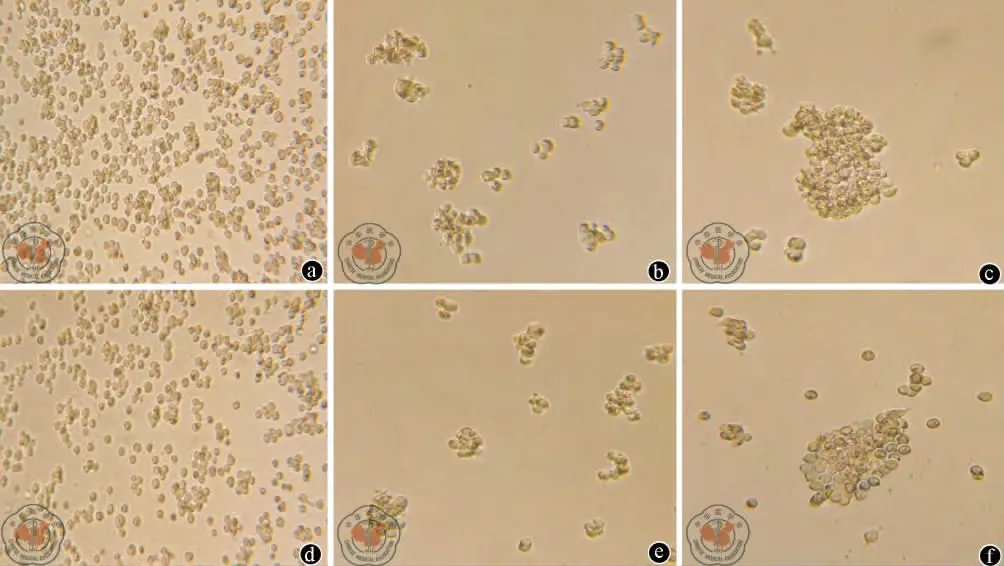
图3 AC133+EpCAM+细胞和AC133-EpCAM-细胞经多细胞球培养后倒置相差显微镜下观察图像

图4 接种AC133+EpCAM+细胞和AC133-EpCAM-细胞的裸鼠肿瘤标本图像
5.AC133+EpCAM+细胞和 AC133-EpCAM-细胞及其微球体的侵袭能力(图5):从图中可知,AC133+EpCAM+细胞表现出最强的侵袭能力,AC133-EpCAM-细胞最弱。
6.体外增殖能力检测:利用 CCK-8法检测AC133+EpCAM+和AC133-EpCAM-细胞体外增殖能力并绘制细胞生长曲线。AC133+EpCAM+组较AC133-EpCAM-组生长迅速.AC133+EpCAM+组细胞群体倍增时间为(20±2)h,而AC133-EpCAM-组细胞群体倍增时间为(42±5)h.两者比较差异有统计学意义(P <0.05,图6)。
讨 论
目前研究表明,只有极小部分肿瘤干细胞具有成瘤能力,且成瘤率较高[16-19]。如何找到一种简单有效的方法,准确地确定这类干细胞,一直是科学家不断探索的课题。由于肿瘤干细胞是无特异生理功能的未分化细胞,因此检测其特异性表面标记就成为一种分选与鉴定干细胞的重要方法。
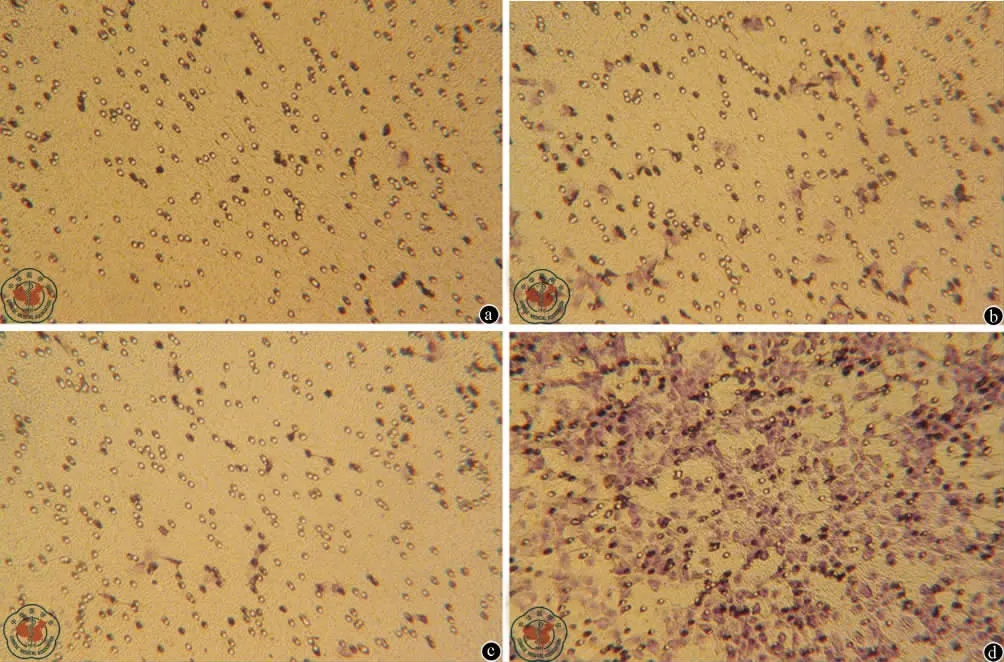
图5 AC133+EpCAM+细胞和AC133-EpCAM-细胞及其微球体微孔膜下层显微镜观察图像

表1 Balb-C裸鼠成瘤率的比较

图6 AC133+EpCAM+细胞和 AC133-EpCAM-细胞体外增殖能力生长曲线图
自我更新是干细胞的重要特性,体外培养的细胞常用克隆形成实验来检测干细胞的自我更新能力。肿瘤干细胞能在无血清添加的重组表皮生长因子和碱性成纤维生长因子培养基中悬浮生长,形成“细胞球”样结构,并且具有无限增殖的潜能,可在体外连续传代并不影响细胞球的结构。这种细胞球可反映实体肿瘤的立体生长方式和组织结构,并且可准确模仿肿瘤内的细胞间联系和微环境条件,特别是营养和氧浓度梯度[20]。2007 年,O’Brien等[21]首先报道了结直肠癌肿瘤干细胞存在于CD133+细胞群中,CD133+细胞群除了能在体外无血清培养基中以未分化肿瘤细胞球的形式快速增长,还能在免疫缺陷小鼠体内连续成瘤。因此,肿瘤干细胞能在无血清培养基中生长并形成细胞球是自我更新能力的体现。本实验中,EpCAM+AC133+细胞能在无血清培养基中悬浮生长,3周后能形成均匀一致的细胞球。而且在血清诱导下,结直肠癌干细胞标志物 AC133、EpCAM的表达逐渐减少,EpCAM+AC133+细胞比例逐渐下降,培养7 d后,失去悬浮生长能力,贴壁生长,表明其在体外培养后,产生了不同表型的子代细胞,仅一部分细胞保持了与母代细胞相似的表型和特性,这一部分细胞在干细胞培养条件下仍然具有形成克隆的能力,表明EpCAM+AC133+细胞在体外培养时仍具有分化与自我更新的能力。
肿瘤干细胞有表达干细胞相关标志、启动肿瘤发生和肿瘤形成的能力。Oliver等[22]认为仅需一个肿瘤细胞就能在体内复制出其来源组织的肿瘤。Al-Hajj等[23]证明只需100个表面抗原为 CD44+CD24-的乳腺癌细胞即可在NOD/SCID鼠体内形成移植瘤。这种能力与肿瘤干细胞自我更新分化及增殖能力有关,也是鉴定肿瘤干细胞最重要的环节。在本实验中,我们将分选后的EpCAM+AC133+细胞与EpCAM-AC133-细胞以不同浓度分别接种于NOD/SCID小鼠皮下观察其形成移植瘤的能力,以评价其致瘤性的差异。结果发现EpCAM+AC133+细胞的体内成瘤能力明显强于EpCAM-AC133-细胞(P<0.01),即使接种数少至100个细胞,也有40%的成瘤率,但成瘤时间较长,肿瘤也较小,接种数为5 000个细胞时则全部成瘤,成瘤时间明显缩短,瘤体较大,而EpCAM-AC133-细胞即使接种数为10 000个细胞也不能成瘤。另外,EpCAM+AC133+细胞的成瘤能力也强于未分选的细胞,即使接种10 000个未分选细胞,也仅有20%的成瘤率,低于接种100个EpCAM+AC133+细胞的成瘤率(40%),接说明肿瘤干细胞的比例是很低的。这显示EpCAM+AC133+有较强的致瘤能力,是结直肠癌的主要致瘤细胞,具有肿瘤干细胞的特性。
AC133是乳腺癌、脑胶质瘤、肝癌、前列腺癌等多种实体瘤的肿瘤干细胞标记物[24-25]。通过对CD133+结直肠癌细胞的分选和体外扩增,我们发现体外扩增的CD133+结直肠癌细胞具有类似神经干细胞球的生长特性,并有多向分化及自我更新能力;更为重要的是AC133+结直肠癌细胞较AC133-结直肠癌细胞具有更强的致瘤能力。该研究为AC133作为结直肠癌干细胞标记物提供了实验依据。为了使分选的结直肠腺癌干细胞更加纯净,我们在实验中增加了特异性的EpCAM分子作为分选标记,而且在实验中验证了AC133阳性细胞同时表达EpCAM分子。
肿瘤的侵袭和转移是临床上肿瘤得不到根治的一个重要原因,它是肿瘤细胞和宿主细胞、细胞外基质之间一系列复杂的、多步骤、多因素影响的过程,侵袭是整个过程的关键环节。本实验结果表明干细胞球的黏附性和侵袭性明显强于亲本细胞,从而解释了为什么肿瘤干细胞会成为肿瘤复发和转移的根源。
通过本研究不仅对人结直肠腺癌干细胞的鉴定和流式分选建立了技术平台,更重要的是为后续研究人结直肠癌干细胞的相关生物学特性提供了实验基础。
[1] 张秋菊,刘斌,邢传平.结直肠癌干细胞的研究与进展.中国组织工程研究与临床康复,2008,12(8):1529-1532.
[2] Kitamura N,Koshiba M,Hode O,et al.Expression of granulysin mRNA in the human megakaryoblastic leukemia cells line CMK.Aeta Haematoi,2002,108(1):13-18.
[3] Huang EH,Heidt DG,Li CW,et a1.Cancer stenl cell:a new paradigm for understanding tumor pmgmssion and therapeutic resistance.Surgery,2007,141(4):415-419.
[4] Spillane JB,Henderson MA.Cancer stenl celia:a review.ANZ J Surgery,2007,77(6):464-468.
[5] Jordan CT.The leukemic stem cell.Best Pratt Res Clin Haematol,2007,20(1):13-18.
[6] Li F,Tiede B,MassaguéJ,et al.Beyond tumorigenesis:cancer stem cells in metastasis.Cell Res,2007,17(1):13-14.
[7] Yin AH,Miraglia S,Zanjani ED,et al.AC133,a novel marker for human hematopoietic stem and progenitor cells.Blood,1997,90(12):5002-5012.
[8] Rajaraman R,Guernsey DL,Rajaraman MM,et al.Stem cells,senescence,neosis and self-renewal in cancer.Cancer Cell Int,2006,6:25.
[9] Stingl J,Caldas C.Molecular heterogeneity of breast carcinomas and the cancer stem cell hypothesis.Nat Rev Cancer,2007,7(10):791-799.
[10] Ichim CV,Wells RA.First among equals:the cancer cell hierarchy.Leuk Lymphoma,2006,47(10):2017-2027.
[11] Thiery JP,Sastre-Garau X,Vincent-Salomon B,et al.Challenges in the stratification of breast tumors for tailored therapies.Bull Cancer,2006,93(8):81-89.
[12] Zhang M,Rosen J M.Stem cells in the etiology and treatment of cancer.Curr Opin Genet Dev,2006,16:60-64.
[13] Griffit hs M J,Bonnet D,Janes SM.Stem cells of the alveolarepit helium.Lancet,2005,366:249-260.
[14] Kim CF,J ackson EL,Woolfenden AE,et al.Identification of bronchioal veolar stem cells in normal lung and lung cancer.Cell,2005,121:823-835.
[15] Dong J,Kislinger T,Jurisica I,et al.Lung cancer:developmental networks gone awry.Cancer Biol Ther,2009,8:312-318.
[16] Stingl J,Caldas C.Molecular heterogeneity of breast carcinomas and the cancer stem cell hypothesis.Nat Rev Cancer,2007,7(10):791-799.
[17] Yi L,Zhou ZH,Ping YF,et al.Isolation and characterization of stem cell-like precursor cells from primary human anaplastic oligoastrocytoma.Mod Pathol,2007,20(10):1061-1068.
[18] Rajaraman R,Guernsey DL,Rajaraman MM,et al.Stem cells,senescence,neosis and self-renewal in cancer.Cancer Cell Int,2006,6:25.
[19] Ichim CV,Wells RA.First among equals:the cancer cell hierarchy.Leuk Lymphoma,2006,47(10):2017-2027.
[20] Weilwald LB,Guinebretiere JM,Richon S,et al.In situ protein expression in tumor spheres:development of an immunostaining protocol for confocal microscopy.BMC Cancer,2010,10:106-118.
[21] O’Brien CA,Pollett A,Gallinger S,et al.A human colon cancer cell capable of initiating tumor growth in immuno-deficient mice.Nature,2007,445(7123):106-110.
[22] Oliver TG,Wechsler-Reya Rj.Getting at the root and stem of brain tumors.Neuron,2004,42(6):885-888.
[23] Cheng H,Leblond CP.Origin,differentiation and renewal of the four main epithelial cell types in the origin of the mouse small intestine.V.Unitarian the theory of the origin of the four epithelial cell types.Am J Anat,1974,141:537-561.
[24] Ricci-Vitiani L,Lombardi DG,Pilozzi E,et al.Identification and expansion of human colon-cancer-initiating cells.Nature,2007,445:111-115.
[25] Singh SK,Hawkins C,Clarke ID,et al.Identification of human brain tumour initiating cells.Nature,2004,432:396-401.
杜航向,杨治力,杨逸,等.AC133抗原联合EpCAM识别转移性结直肠癌干细胞的研究[J/CD].中华结直肠疾病电子杂志,2013,2(4):170-176.

