CdSe量子点的合成及其标记水杨酸受体研究
苏烨华,俞 英
(华南师范大学化学与环境学院,广东广州510006)
水杨酸是一种重要的内源信号分子,能够激活植物过敏反应和系统抗性,影响植物生长发育[1].水杨酸的细胞信号转导首先要与细胞表面的特异受体结合,确认和标记受体对研究水杨酸的作用机制非常重要.目前研究激素信号转导常用的方法是放射性标记法或用传统荧光染料标记法,但放射性标记存在放射性污染,传统的荧光试剂存在光漂白现象等缺点.量子点是一种良好的半导体发光材料,其直径一般介于2~8 nm 之间,有宽且连续分布的激发光谱和窄且对称分布的发射光谱,光学特性优异,且光化学稳定性好[2-4]. 目前量子点应用于植物细胞研究领域的报导较少,这可能是植物细胞的细胞壁阻挡以及细胞膜的选择透过性所导致[5].
双修饰量子点相对于单修饰量子点,具有稳定性更高,荧光性能更好的优势. 刘婧文等[6]分别以D、L-青霉胺和L-半胱氨酸作为组合修饰剂合成CdSe 纳米晶,发现双修饰剂修饰的纳米晶比单修饰剂修饰的纳米晶荧光强度高,稳定性好,并成功以CdSe 纳米晶作为荧光探针对大肠杆菌进行标记.郑爱芳等[7]在水相中以巯基乙酸和半胱氨酸为混合修饰剂合成了光谱可调的CdTe 纳米棒,该纳米棒被用作铜离子荧光探针. 陈帼敏等[8]用D-青霉胺和L-半胱氨酸双修饰CdSe 纳米晶,并进一步建立了测定痕量Hg(II)的方法.田建袅等[9]合成了以巯基乙酸和谷胱甘肽共同修饰CdTe 量子点,其量子产率63%,并成功将其应用于标记鼠纤维肉瘤细胞. 另 外,杨 卫 海[10]、YAN[11-12]、MOLONEY[13]、LI[14]等也分别合成不同双修饰的量子点并对其结果进行了一些探讨.
本文以MPA 和MSA 为修饰剂,合成了双修饰剂修饰的CdSe 量子点,提高量子点的水溶性和稳定性,应用于绿豆幼苗中标记水杨酸受体位点,有助于阐明受体的分布,为进一步分离纯化受体蛋白提供必要的理论依据.
1 实验部分
1.1 药品和仪器
F-2500 型荧光光谱仪(日本日立公司);UV-Vis 1700 型紫外-可见分光光度计(上海天美科学仪器公司);JEM-2100HR 型透射电子显微镜(日本电子公司);荧光显微镜(Nikon Eclipse 50i,日本尼康);TG16-W 微量高速离心机(广州广一科学仪器公司);pHS-3C 型酸度计(上海雷磁仪器厂).
对氨基水杨酸(98%,上海晶纯实业有限公司);NaBH4(96.0%,上海国药集团化学试剂有限公司);硒粉(99.99%,Strem Chemicals);CdCl2·2.5H2O(分析纯,≥99.0%,广州化学试剂厂);巯基丙酸(简称MPA,Aldrich 公司);NaOH、甲醇均为分析纯.
1.2 实验方法
1.2.1 对巯基水杨酸和3-巯基丙酸双修饰CdSe量子点( CdSe/MPA/MSA) 的合成 参照文献[15],以对氨基水杨酸为原料合成出对巯基水杨酸. 参考文献[16]合成巯基丙酸修饰的CdSe 的方法,称取0.25 mmol(0.019 7 g)硒粉和0.5 mmol (0.020 0 g)NaBH4放入反应瓶,加入1 mL 二次水,盖上瓶塞,冰箱中反应1 h,得到无色透明的NaHSe 溶液;三口烧瓶中加入50 mL 二次水,通氮气10 min,取0.02 mmol(0.004 7 g)CdCl2·2. 5H2O 加入溶解,加入0.05 mmol(4.35 μL)巯基丙酸,用1 mol/L 的NaOH调节溶液的pH 值至11.30,通氮30 min;取0.01 mmol(40 μL)新制的NaHSe 溶液加入至CdCl2·2.5H2O 溶液中,在100 ℃下恒温水浴回流30 min,得到Cd∶Se∶MPA =1 ∶0.5 ∶2.5 的 黄 绿 色CdSe 量 子 点(CdSe/MPA),以Se 计算,CSe=2.0 ×10-4mol/L.
在CdSe/MPA 的基础上,按MPA∶MSA 摩尔比为2.5∶1 的比例加入0.02 mmol(0.003 4 g)MSA,用NaOH 溶液调整溶液pH 至11.30,在90 ℃下加热回流45 min,得到MPA 和MSA 共同修饰的CdSe 量子点(CdSe/MPA/MSA). 在本实验条件下,得到的双修饰量子点的颜色与CdSe/MPA 基本相同.
1.2.2 CdSe/MPA/MSA 对绿豆的毒性分析 取100 颗绿豆种子放入培养皿中,分别加入二次水、MSA、CdSe/MPA、CdSe/MPA/MSA 4 种 溶 液,在27 ℃下恒温培养.培养30 h 后观察并计算发芽率,4 d 后观察绿豆幼苗的生长情况,确定成活率.在此期间要保证绿豆幼苗根部有培养液浸泡.
1.2.3 CdSe/MPA/MSA 标记绿豆幼苗水杨酸受体取绿豆幼苗的根、茎或子叶部位,徒手切片,放入离心管,分别加入二次水、MSA、CdSe/MPA、CdSe/MPA/MSA 等溶液,35 ℃条件下振荡培养4 h.
取出样品,除去培养液,加入二次水,以1 000 r/min 离心1 min 并重复3 次,将样品洗涤干净. 将处理完的样品转移至载玻片上,盖上盖玻片,注意保持样品处于湿润状态. 在荧光显微镜下以蓝光作为激发光源,放大100 倍进行观察拍照.
2 结果与讨论
2.1 CdSe/MPA/MSA 的制备条件优化
采用单因素法对双修饰量子点的合成条件进行优化,主要考察了pH、修饰剂的摩尔比、回流时间、回流温度等对量子点荧光强度的影响.
由图1A 看出当MPA∶MSA =2.5 ∶1 时,CdSe/MPA/MSA 的荧光最强,因为在这个配比条件下,量子点的表面缺陷相对较少;当MSA 所占比例小于1时,量子点的表面缺陷较多,因而CdSe/MPA/MSA的荧光强度较弱;而当MSA 所占比例大于1 时,CdSe/MPA/MSA 溶液中质点增多,导致量子点产生荧光自猝灭现象,所以荧光强度降低.
不同pH 对CdSe/MPA/MSA 量子点的荧光强度的影响如图1B. 合成CdSe/MPA/MSA 时,在pH为11.30 时为最佳酸度,此时其荧光强度达最大值.
不同的回流时间对CdSe/MPA/MSA 荧光强度的影响见图1C,回流45 min 以后,荧光强度随回流时间的延长而下降.因此,45 min 是回流最佳时间.
考察40~100 ℃范围内回流温度对CdSe/MPA/MSA 荧光强度的影响,随着温度的逐渐上升(图1D),CdSe/MPA/MSA 的荧光强度有逐渐增强的趋势,并在90 ℃时,荧光强度达到最强. 因此以90 ℃作为合成CdSe/MPA/MSA 的回流温度.
2.2 CdSe/MPA/MSA 的表征
2.2.1 CdSe/MPA/MSA 的透射电镜观察 图2 中黑点为CdSe/MPA/MSA 量子点,尺寸分布较为均一,形状大致呈球形,粒径约为3~4 nm. 说明双修饰量子点仍保持了粒径小,分散均匀的特点.
2.2.2 CdSe/MPA/MSA 的紫外及荧光光谱表征分别把CdSe/MPA/MSA、CdSe/MPA 以及MSA 的紫外光谱作了对比(图3A),发现CdSe/MPA/MSA 和CdSe/MPA 在400 nm 左右都有1个宽的吸收峰,且CdSe/MPA/MSA 的吸收峰相对CdSe/MPA 有一定的红移,幅度约为4 nm,说明对巯基水杨酸与CdSe/MPA 确实发生了作用.紫外红移可能是由于电子离域使CdSe/MPA/MSA 量子点的限域能降低,导致其激发态能量比CdSe/MPA 有所降低[17].
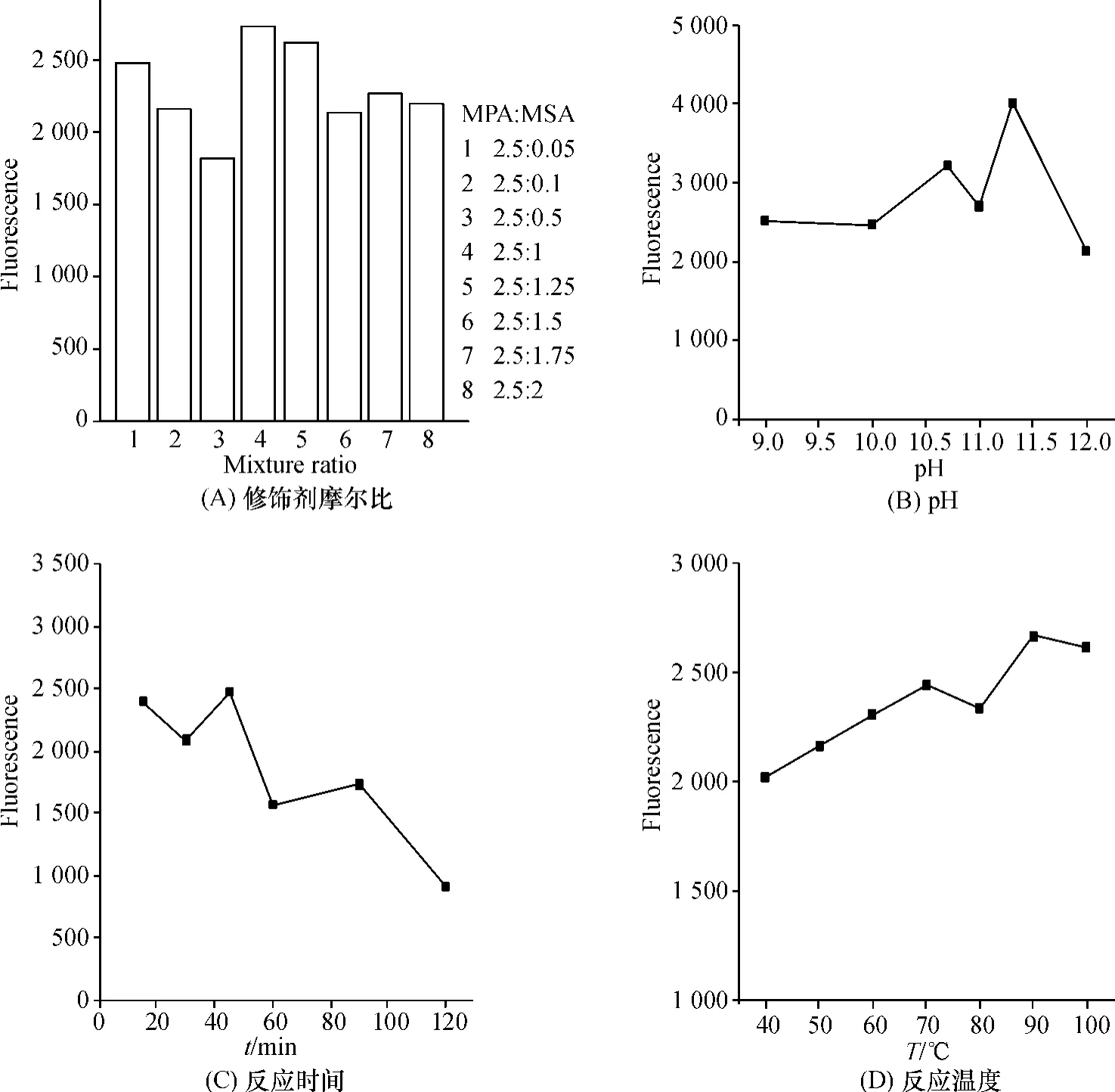
图1 不同条件对CdSe/MPA/MSA 荧光强度的影响Figure 1 Effect of different conditions on fluorescence intensity of CdSe/MPA/MSA

图2 CdSe/MPA/MSA 透射电镜图Figure 2 TEM photograph of CdSe/MPA/MSA
图3B 表明,相对于对巯基水杨酸本身荧光光谱λex/λem=303 nm/402 nm,CdSe/MPA 和CdSe/MPA/MSA 量子点的激发光谱都很宽,2 种量子点发射峰的位置都在540 nm 附近. 说明MSA 的荧光光谱并不会影响到水杨酸受体探针荧光光谱的检测.CdSe/MPA/MSA 荧光强度比CdSe/MPA 有明显增强,可能是MSA 作为第二修饰剂与CdSe 结合后,减少了CdSe 表面缺陷的缘故. 相对于CdSe/MPA,CdSe/MPA/MSA 的激发峰的第一个峰位置蓝移了大约25 nm,而后面的2个峰位置基本不变但强度明显上升,激发峰的宽度明显增加且强度上升,证明MSA 确实与CdSe/MPA 发生了作用.从图中也表明双修饰量子点保持了量子点的荧光光谱的特征.
2.3 CdSe/MPA/MSA 对绿豆幼苗标记
2.3.1 CdSe/MPA/MSA 对绿豆幼苗的毒性分析通过统计绿豆的发芽率和幼苗成活率来确定CdSe/MPA/MSA 毒性(表1). 在30 h 内在各种培养液绿豆的发芽率较高,说明在一定的误差范围内,各种培养液不会影响绿豆的发芽过程.
根据绿豆幼苗的根部形态统计成活率,若其根部枯萎,或者根部很细短且变黑则可确定幼苗已经死亡. 由表1 统计的成活率来看,MSA 溶液与二次水培养的绿豆幼苗成活率相同;而用量子点培养的样品其成活率相对二次水已大大降低,说明量子点对绿豆幼苗的毒性已经显现,并影响了绿豆幼苗的生长.量子点的毒性都是随着浓度的降低逐渐减小,特别是5 ×10-5mol/L 的量子点,无论是单修饰还是双修饰,用其培养的样品成活率与二次水相比相差不大;相对于单修饰量子点,双修饰量子点对绿豆幼苗的毒性稍有下降.

图3 CdSe/MPA/MSA 的紫外吸收光谱和荧光光谱Figure 3 The UV absortion spectrum and Fluorescence spectrum of CdSe/MPA/MSA

表1 CdSe/MPA/MSA 对绿豆的毒性分析Table 1 Toxicity of CdSe/MPA/MSA in mung bean
2.3.2 CdSe/MPA/MSA 标记绿豆幼苗水杨酸受体
水杨酸可以与绿豆幼苗中的水杨酸受体特异性结合,而CdSe 量子点可以测量的荧光信号,确定受体位点.
(1)CdSe/MPA/MSA 标记绿豆幼苗根部组织.CdSe/MPA 培养的样品相对于空白样品,未见明显荧光增强现象(图4);MSA 培养的样品,其组织外围相比空白样品有微弱的荧光增强,但是幅度不大;而CdSe/MPA/MSA 培养的样品,可观察到明显的荧光增强效应,其内皮层组织荧光现象比较明显,说明其中的水杨酸受体较密集;此时皮层薄壁组织清晰可见,可能分布水杨酸受体,但其聚集程度相对较低.CdSe/MPA/MSA 使绿豆幼苗根部组织荧光明显增强的原因是CdSe/MPA/MSA 中的MSA 能与绿豆幼苗根部的水杨酸受体结合,因此CdSe/MPA/MSA能不被洗脱而稳定存在于根部组织中.

图4 CdSe/MPA/MSA 标记绿豆幼苗根部Figure 4 CdSe/MPA/MSA labeled root of mung bean
(2)CdSe/MPA/MSA 标记绿豆幼苗茎部组织.CdSe/MPA 培养的样品相对空白样品未见明显的荧光增强现象(图5);MSA 溶液培养的样品外围有微弱荧光增强现象,但不能与本体荧光区别;而CdSe/MPA/MSA 培养的样品相对空白样品,可见其边界和内皮层组织都有一定的荧光增强现象,虽微弱,但其皮层薄壁组织也依稀可见. 说明绿豆幼苗茎部也可能存在水杨酸受体,但是相对于根部,其量极微小.
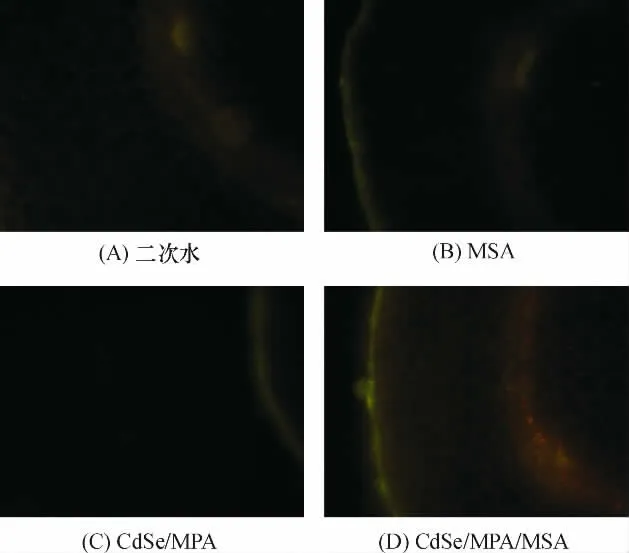
图5 CdSe/MPA/MSA 标记绿豆幼苗茎部Figure 5 CdSe/MPA/MSA labeled stalk of mung bean
(3)CdSe/MPA/MSA 标记绿豆幼苗子叶组织.空白样品显示红光,若样品中带红光,并不能作为水杨酸与受体结合的表现(图6). CdSe/MPA 和MSA溶液培养的样品都带有红光,这很可能是由于子叶的本底荧光所致;而CdSe/MPA/MSA 培养的样品,有明显的荧光增强效应,其荧光相比本底颜色有较大差别,较明亮.表明可能有水杨酸受体存在于子叶中.

图6 CdSe/MPA/MSA 标记绿豆幼苗子叶Figure 6 CdSe/MPA/MSA labeled cotyledon of mung bean seedlings
综上所述,绿豆幼苗的水杨酸受体主要存在于根部,茎部含量较少,子叶有水杨酸受体存在. 水杨酸受体主要分布于内皮层组织. CdSe/MPA 因为没有与受体结合的激素分子,通过洗涤离心后则不能存在于绿豆幼苗组织内;而MSA 虽然可以与受体结合,但在以蓝光作激发的条件下,其不能产生荧光;而CdSe/MPA/MSA 因为有水杨酸分子,同时也具有量子点的光学特性,因此可以利用其标记绿豆幼苗水杨酸受体.
3 展望
通过双修饰的方法合成了水杨酸受体探针,对探针的合成条件进行优化和表征,并利用量子点优良的光学性能简便地标记出绿豆幼苗中的水杨酸受体位点.目前量子点应用于植物的研究还处于初级阶段,其技术有待发展和完善,如何合成出在长波段发射荧光的量子点从而使背景干扰的影响降到最低,以及无毒副作用地使有特异识别功能的量子点进入植物细胞,甚至定量测定植物中相应的受体,都值得进一步的研究.
[1]MALAMY J,CARR J P,KLESSIG D F,et al. Salicylic acid:A likely endogenous signal in the risistance response of tobacco to viral infection[J]. Science,1990,250(4983):1002-1004.
[2]MICHALET X,PINAUD F F,BENTOLILA L A,et al.Quantum dots for live cells,in vivo imaging,and diagnostics[J]. Science,2005,307:538-544.
[3]王洋,邓玉林,庆宏,等. 量子点标记的生物实时动态示踪成像研究进展[J]. 高等学校化学学报,2008,29(4):661-668.
[4]MEDINTZ I L,UYEDA H T,GOLDMAN E R,et al.Quantum dot bioconjugates for imaging,labelling and sensing[J]. Nature Materials,2005,4:435-446.
[5]BALUSKA F,SAMAJ J P. Cytoskeleton-plasma membrane-cell wall continuum in plants Emerging links revisited[J]. Plant Physiol,2003,133(2):482-491.
[6]刘婧文,俞英,吴建中,等. 手性化合物组合修饰剂对CdSe 纳米晶荧光性能的影响及标记大肠杆菌的研究[J]. 无机化学学报,2011,27(10):1924-1930.
[7]郑芝芳,陈金龙. CdTe 纳米棒的水相合成与铜离子识别研究[J]. 无机材料学报,2009,24(2):251-254.
[8]陈帼敏,俞英,胡小刚,等. 手性双修饰剂修饰的CdSe 纳米晶的合成及选择性识别Hg(II)的研究[J].分析化学,2010,38(10):1405-1410.
[9]TIAN J X,LIU R J,ZHAO Y C,et al. Controllable synthesis and cell- imaging studies on CdTe quantum dots together capped by glutathione and thioglycolic acid[J].J Colloid Interf Sci,2009,336:504-509.
[10]杨卫海,严守雷,卫晨,等. 油胺/油酸稳定的CdSe量子点的绿色合成[J]. 分析测试学报,2010,29(1):1-5.
[11]YAN Y X,MU Y,FENG G D,et al. Novel strategy for synthesis of high quality CdTe nanocrystals in aqueous solution[J]. Chem Res Chinese U,2008,24(1):8-14.
[12]闫玉禧,牟颖,金钦汉. 一种新型CdTe 量子点关于测定铜离子的研究[J]. 生命科学仪器,2007(5):14-18.
[13]MOLONEY M P,GUNKO Y K,KELLY J M. Chiral highly luminescent CdS quantum dots[J]. Chem Commun,2007,38:3900-3902.
[14]LI J,HONG X,LI D,et al. Mixed ligand system of cysteine and thioglycolic acid assisting in the synthesis of highly luminescent water- soluble CdTe nanorods[J].Chem Commun,2004,15:1740-1741.
[15]WAGNER G,KUHMSTEDT H. Synthesis of glucosides of 2-hydroxy-4-mercaptobenzoic esters[J]. Archiv der Pharmazie und Berichte der Deutschen Pharmazeutischen Gesellschaft,1960(293):357-370.
[16]俞英,梁耀珍. 赖艳,等. 3-巯基丙酸修饰的CdSe/ZnS 量子点的合成及测定牛血清白蛋白的研究[J].分析科学学报,2009,25(1):59-62.
[17]林霞,黄风华,陈娟,等. 光谱法研究CdSe/CdS/ZnS量子点与壳聚糖的复合[J]. 化学研究,2010,21(3):85-87.

