固态氧化铝碳热还原反应研究进展
冯月斌,杨 斌,戴永年
(1.昆明理工大学 理学院,昆明 650500;2.昆明理工大学 冶金与能源工程学院 真空冶金国家工程实验室,昆明650093)
氮化铝陶瓷材料具有高热导率、低热膨胀系数、低介电常数和介电损耗、高强度、绝缘等一系列优良性能,在电子工业领域的应用前景十分广阔[1-4]。 碳热还原氮化法是商业化制取氮化铝粉的主要方法之一[5-6],将氧化铝粉和碳粉混合,在流动氮气中于1 673~2 073 K 反应生成氮化铝[2-3],总反应如式(1)所示:

一般认为该反应分为两步,一步是氧化铝的还原,另一步是氮化[7]。然而,由于固态氧化铝碳热还原反应机理至今仍无统一的认识,碳热法制备氮化铝的反应机理的具体解释也就无法一致。
氮氧化铝(阿隆)陶瓷材料具有优良的光学性能、耐高温性能、热震稳定性能和耐氧化性能,在航空航天、电子信息、化工、冶金、耐火材料等领域具有广泛的应用前景[8]。碳热还原氮化法制备氮氧化铝的成本低,适于工业生产[8],将氧化铝粉和碳粉置于流动氮气中,在1 843~2 073 K合成氮氧化铝[9],总反应如式(2)所示[8]:

但是,迄今还不能确定氮氧化铝是通过固相反应还是通过气相反应生成的,其合成机理仍有待研究[8]。
碳热法生产Al4C3[10]、AlSiON[11]及氧化铝基体陶瓷材料的高温处理[12]等也涉及固态氧化铝的碳热还原反应。
此外,氧化铝碳热还原反应也被尝试应用于金属铝的提取[13-14],常压下反应温度很高,采用减压条件可以降低反应温度[15-16],甚至使氧化铝在固态时反应。
因此,固态氧化铝碳热还原反应的认识对于其在陶瓷材料领域及铝冶金中的应用研究具有重要的意义。本文作者结合课题组的工作对固态氧化铝碳热还原反应的研究进展进行评述。
1 氧化铝碳热还原反应
常压下,氧化铝碳热还原反应需要约2 273 K以上的高温,反应物与产物形成熔体。减压条件或氮气、氩气下,氧化铝碳热还原反应所需温度降低,氧化铝为固态时即可反应。
氧化铝碳热还原反应体系中出现的各种产物已经逐步被认识,为反应机理的研究奠定了必要的条件。
氧化铝碳热还原反应的固态产物有Al4C3、Al2OC和 Al4O4C。1956年 FOSTER等[17]证实了碳氧化物Al4O4C和Al2OC的存在,并给出了各自的结构。此后,COX 和 PIDGEON[18]、JEFFREY 和 SLAUGHTER[19]、DLUZEWSKI 等[20]、GRASS 等[21]对 Al4C3、Al4O4C和Al2OC的结构相继进行了研究,目前这几种物质的结构已经得到了公认。KLIMOV 等[22]、HEYRMAN和 CHATILLON[23]、LIHRMANN 等[24-26]先后研究了Al2O3-Al4C3体系热力学,完整给出了 Al4C3、Al4O4C和Al2OC的热力学数据。
氧化铝碳热还原反应的含铝气态产物有 Al、Al2O、AlO、Al2O2和 AlO2[26],含铝气态产物会再次反应形成冷凝沉积物[27-28]。
2 固态氧化铝碳热还原反应机理
固态氧化铝碳热还原反应机理尚缺乏系统研究,大多是在涉及该反应的其他研究中进行讨论。由于研究条件不同,得到的反应机理存在着很大的差异,大致分为氧化铝分解反应、固-固相反应和气-固相反应机理。
2.1 氧化铝分解反应机理
氧化铝分解反应机理认为氧化铝高温分解为含铝气体和氧气,含铝气体随反应条件的不同再次反应形成不同的最终产物,如在减压条件或氩气下形成碳化铝、碳氧化铝等,在氮气下形成氮化铝。
LEFORT等[29]研究了氩气下氧化铝的碳热还原反应,提出固态氧化铝分解为气体Al和O2(式(3)),O2与C反应生成CO(式(4)),Al与CO反应生成Al2OC(式(5)),当CO分压低于5×10-3Pa时,Al与C反应生成 Al4C3(式(6))。
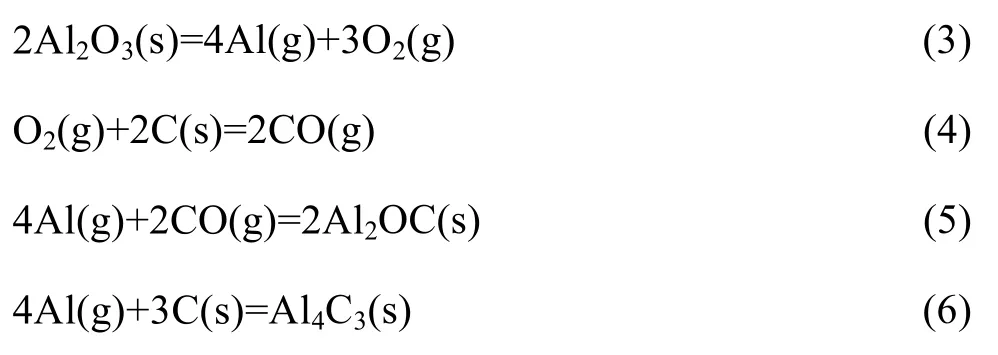
LEFORT和 BILL[30]在氮气下进行氧化铝碳热还原法合成氮化铝时,认为氧化铝同样分解生成气体Al和O2,然后Al与N2反应生成AlN。
黄利萍等[31]认为在氮气下进行氧化铝碳热还原法合成氮化铝时,由氧化铝蒸发出低价含铝气体Al、Al2O和Al2O2,这些含铝气体与C、N2反应形成AlN。
黄利萍和Lefort的分歧仅在于对氧化铝分解产生的含铝气体成分存在着不同的看法。
氧化铝分解反应机理成立的基础是证实氧化铝分解反应可以发生。KATSOV等[32]以电热原子吸收法研究氧化铝的蒸发,证实基本气体成分为 Al、Al2O和AlO,各含铝气体成分的含量由气氛中的氧含量决定。
L’VOV[33]解释了碳的作用,认为金属氧化物碳热还原过程中,碳的作用在于与氧气反应以维持较低的氧分压,使分解反应易于进行。如果L’VOV的观点正确,以其他可以降低氧分压的物质代替碳可以起到相同的作用,COCHRAN[34]发现在铝的存在下氧化铝的分解温度也可以降低,证明碳的作用是降低氧分压的说法是合理的。因此,氧化铝分解反应机理是合理的。
2.2 固-固相反应机理
固-固相反应机理分为两种:一是氧化铝与碳通过固-固相反应生成固态碳化铝和碳氧化铝;二是氧化铝与碳通过固-固相反应生成低价含铝气体。
2.2.1 固-固相反应生成固态产物
在减压条件或惰性气氛下进行氧化铝碳热还原反应时,常常得出固-固相反应生成固态产物的结论。这是由于在反应过程中出现了碳化铝和碳氧化铝,研究者常认为其由氧化铝与碳的直接固-固相反应生成。对反应机理的具体解释主要根据物相随反应条件的改变规律进行推测。
COX和PIDGEON[35]利用热分析技术研究了减压条件下1 698~2 199 K温度范围内氧化铝的碳热还原反应,以差热分析曲线确定氧化铝与碳发生化学变化的次数及其温度。据此,在各化学变化阶段取样进行X射线衍射(XRD)分析,根据物相变化推测反应机理,提出随温度升高依次发生反应(7)、(8)和(9),且Al2O3与C的固-固相反应主要生成Al4O4C(式(8)),而生成Al2OC(式(7))的量较少。
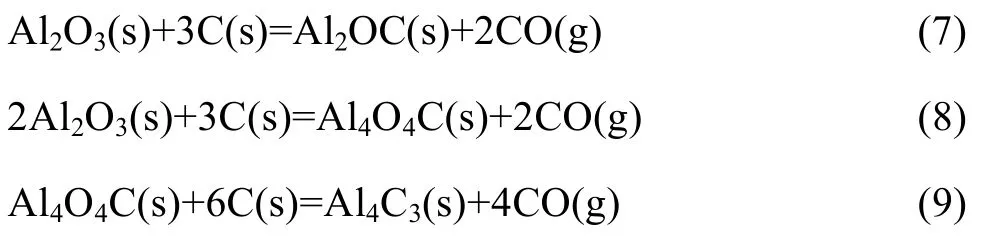
JOO和JUNG[10]研究了氩气下氧化铝碳热还原形成碳化铝的过程,以 XRD技术分析产物的物相,根据物相随反应温度的变化规律推测反应机理,认为氧化铝与碳发生固-固相反应生成中间产物 Al2OC(式(7)),依Al2O3与C的配比不同生成不同的最终产物,当C配比高时,生成Al4C3(式(10)),当Al2O3配比高时,生成Al4O4C(式(11))。

袁海滨等[36-38]研究了真空下碳热还原-歧化法提取金属铝的工艺,以 XRD技术分析残渣的物相,根据残渣的物相随反应温度的变化规律,提出氧化铝与碳反应首先生成 Al4O4C(式(8)),在更高温度下生成Al4C3(式(9)和(12))。

可见,固-固相反应生成固态产物的观点差异较大,且都未能合理解释含铝气体产物的形成及行为。JOO和JUNG[10]和袁海滨[36-38]的研究未提及含铝气态产物的形成。COX和PIDGEON[35]在反应器较冷区域发现了由Al4C3、C、Al和Al2O3组成的冷凝沉积物,认为由气体Al与C或CO反应形成,而气体Al由Al4O4C与Al4C3反应形成(式(13))。

COX和PIDGEON[35]明确否认氧化铝与碳反应生成含铝气态产物Al2O和AlO,主要依据是氧化铝碳热还原反应过程的测定压力与反应(7)、(8)和(9)的平衡压力相符,而与生成 Al2O、AlO 的反应(式(14)和(15))平衡压力不符。

但是,固态氧化铝碳热还原反应过程非常复杂,含铝气体还会再次反应,仅凭测定压力来判断固态氧化铝与碳所发生的反应并不合理。对于气体 Al由Al4O4C与Al4C3反应形成的推测也缺乏证据。
2.2.2 固-固相反应生成含铝气态产物
在氮气下采用氧化铝碳热还原法制备氮化铝的研究中,往往提出固-固相反应生成含铝气态产物的观点,一般认为固态氧化铝与碳发生固-固相反应生成含铝气态产物(如式(14)和(15)),然后含铝气态产物与氮气反应形成氮化铝[39-41]。
BACHELARD[39]提出固-固相反应机理是由于固相间接触面积的增加促进反应的进行。这一促进反应进行的途径不断被证实:沈明[40]发现采用亚稳结构的氧化铝作原料、提高反应温度和降低氧化铝颗粒的粒度可以提高反应速率,认为这些因素可以促进固相间的扩散。何国新[41]采用铝凝胶作为铝源降低了反应温度、缩短了反应时间,认为铝碳的均匀分散和良好结合促进了固相反应的进行;石功奇等[42]将反应物粉末进行压制,反应速率增大,认为反应物接触面积增大,促进了氧化铝与碳的固-固相反应;刘新宽等[43]采用高能球磨方法处理反应物,将反应物细化至纳米级,增加了反应物间的接触面积并使反应物混合均匀,有效降低了反应温度;NOBORU等[44]和 BAIK等[45]实现了反应物分子级接触,使反应更易进行。
但是,细化反应物颗粒、增加反应物表面积,即增加反应物活性,对气相反应同样有利。所以,增加固相间的接触面积可以促进反应的进行的现象并不能充分证明固-固相反应机理。
2.3 气-固相反应机理
金属氧化物的碳热还原反应一般被认为由CO间接还原氧化物生成低价金属和CO2,固体碳与CO2反应生成CO,温度高于1 273 K时,反应由两步组成(式(16)和(17))[46],总反应式为式(18)。

该机理也被用来解释氧化铝的碳热还原反应。
YU等[47]在研究以氧化铝催化各向同性碳的石墨化时,发现氧化铝与碳直接生成碳化铝的反应有限,推测氧化铝与碳之间的反应通过CO与Al2O3的气-固相反应进行(式(19)~(21)),CO由CO2与固体碳反应形成(式(17))。

HIRAI等[48]也认为在氧化铝碳热还原法制备氮化铝的过程中,由CO将Al2O3还原为Al2O气体,然后Al2O与氮气反应生成氮化铝。
但是,傅仁利等[49]评述氧化铝碳热还原法合成氮化铝的机理时,计算了反应(19)的吉布斯自由能变化如式(22)所示。

从式(22)可见,只有在CO2分压远低于CO分压的情况下,CO为还原剂所进行的碳热还原反应(19)才有可能进行,在如此低的CO2分压下,反应过程中所生成的 CO气体难以维持反应(19)的进行,所以,认为制备氮化铝过程中,CO还原氧化铝值得怀疑[49]。
另一方面,反应(19)~(21)均为体积增大过程,真空度越高,反应越容易进行,但CO气体作为反应物,太高的真空度使其分压降得很低,反而不利于反应进行。但本文作者研究真空下氧化铝碳热还原反应时发现,真空度越高,越有利于反应的进行,即使使用机械泵和油扩散泵联合抽真空,使真空度低于 1×10-2Pa,仍然未得到不利于反应的结果[50]。因此,CO 还原固态氧化铝的气-固相反应机理确实令人怀疑。
2.4 氧化铝碳热还原反应实验
本文作者所在课题组[50-51]在真空下进行了氧化铝与石墨的反应实验,原料压成柱状料块,研究的温度范围为1 643~1 843 K,压力维持在5~150 Pa。反应30 min后,料块表面粘附有沉积物,当反应温度较高时,表面沉积物将反应残料完全覆盖,很容易误认为反应物部分熔融。这一现象说明固态氧化铝碳热还原反应生成了含铝气体产物,由于连续抽真空的作用,气态产物逸出,在反应物表面再次反应形成了沉积物。
分别取原料、残渣和表面沉积物进行XRD分析,结果表明原料和残渣均由α-Al2O3和C组成;沉积物由Al4O4C、C、Al4C3和Al2O3组成。
进一步对原料、残渣和表面沉积物进行扫描电镜分析(SEM),图1所示为原料及1 743 K下反应后残渣、沉积物的SEM像。从图1(a)可见,原料中白色氧化铝颗粒致密,与灰黑色片状石墨界面清晰;从图1(b)可见,反应后白色氧化铝颗粒变得疏松,但与灰黑色片状石墨的界面仍然清晰,无固-固相反应时相互扩散的特征;从图1(c)可见,沉积物的形态与残渣截然不同。

图1 原料及1 743 K下反应30 min后残渣和沉积物的SEM像[50-51]Fig.1 SEM images of raw material (a), residue (b)and deposit (c)after reaction at 1 743 K for 30 min[50-51]
说明固态氧化铝与石墨反应生成含铝气态产物,该气态产物再次反应形成了含碳化铝、碳氧化铝的沉积物,且氧化铝与石墨未发生直接固-固相反应。
需要说明的是,由于含铝气体产物再次反应形成的沉积物与残渣混在一起,尤其是反应温度较高时,很难将二者区分开,导致作者在前期研究中将沉积物与残料一起进行XRD分析,根据其组成为Al2O3、C、Al4C3和Al4O4C,错误地判断Al4C3和Al4O4C由固态氧化铝与石墨直接反应形成。由此推测,持固-固相反应生成碳化铝、碳氧化铝观点的研究者极有可能采用了同样的研究方法。
VODOP′YANOV 等[52-53]和 LEFORT[29]分别在氩气和氮气下将氧化铝与碳分开进行实验,发现仍然可以反应。表明在氩气和氮气下,氧化铝碳热还原反应也极有可能不是通过固-固相反应进行的。
因此,氧化铝与碳之间发生固-固相反应的可能性极小。而前述分析表明,氧化铝分解反应机理较气-固相反应机理更为合理,且氧化铝分解产生的含铝气体在减压条件或惰性气氛下再次反应生成含碳化铝和碳氧化铝的终产物,在氮气下再次反应生成氮化铝。所以,碳热还原制备氮化铝的研究中较少提及碳化铝、碳氧化铝的形成。
3 总结与展望
1)固-固相反应机理缺乏直接证据,气-固相反应机理与热力学分析及真空减压条件的实验结果存在矛盾之处,而氧化铝分解反应机理具有直接证据的支持,所以氧化铝分解反应机理较为合理。
2)固态氧化铝碳热还原反应可能的机理如下:氧化铝高温分解为含铝气体和氧气,碳与氧气反应生成CO使氧分压降低,从而降低了氧化铝的分解温度。在减压条件或惰性气氛下含铝气体再次反应生成碳化铝和碳氧化铝等,在氮气下含铝气体再次反应生成氮化铝。
3)但是,固态氧化铝碳热还原反应机理的系统解释仍需要从以下两方面展开研究:系统研究不同反应条件下固态氧化铝与碳的反应,利用先进分析技术考察固相和气相组分的变化,以验证本论文的分析结论是否具有普遍性;系统研究固态氧化铝碳热还原过程中含铝气体形成的规律及其在不同条件下的再反应行为。
[1]高晓菊, 李国斌, 赵 斌, 刘国玺, 常永威, 乔光利, 韩剑锋,顾明俊.氮化铝陶瓷生产关键技术研究现状[J].兵器材料科学与工程, 2011, 34(3): 92-96.GAO Xiao-ju, LI Guo-bin, ZHAO Bin, LIU Guo-xi, CHANG Yong-wei, QIAO Guang-li, HAN Jian-feng, GU Ming-jun.Research status of AIN ceramics production technology[J].Ordnance Material Science and Engineering, 2011, 34(3):92-96.
[2]王柳燕, 张 宁.氮化铝粉体制备技术的研究现状与展望[J].粉末冶金工业, 2008, 18(3): 42-46.WANG Liu-yan, ZHANG Ning.Current status and prospect of preparation technology of nanometer aluminum nitride powder[J].Powder Metallurgy Industry, 2008, 18(3): 42-46.
[3]秦明礼, 曲选辉, 林健凉, 肖平安, 祝宝军, 汤春峰.氮化铝陶瓷研究和发展[J].稀有金属材料与工程, 2002, 31(1): 8-12.QIN Ming-li, QU Xuan-hui, LIN Jian-liang, XIAO Ping-an,ZHU Bao-jun, TANG Chun-feng.Progress in research and development of aluminum nitride(AlN)ceramics[J].Rare Metal Materials and Engineering, 2002, 31(1): 8-12.
[4]李鹏亮, 周敬恩, 席生岐.高能球磨制备立方 A1N 及其高温相变[J].无机材料学报, 2006, 21(4): 821-827.LI Peng-liang, ZHOU Jing-en, XI Sheng-qi.Cubic AlN synthesized by high energy ball milling and its phase conversion at high temperature[J].Journal of Inorganic Materials, 2006,21(4): 821-827.
[5]肖 劲, 邓松云, 吴胜辉, 陈燕彬, 李 劼.氮化铝粉体制备工艺研究[J].无机化学学报, 2010, 26(3): 464-468.XIAO Jin, DENG Song-yun, WU Sheng-hui, CHEN Yan-bin, LI Jie.Preparation technology of aluminium nitride[J].Chinese Journal of Inorganic Chemistry, 2010, 26(3): 464-468.
[6]肖 劲, 周 峰, 陈燕彬.微波碳热还原法制备氮化铝粉末的工艺研究[J].无机材料学报, 2009, 24(4): 755-758.XIAO Jin, ZHOU Feng, CHEN Yan-bin.Preparation of AlN powder by microwave carbon thermal reduction[J].Journal of Inorganic Materials, 2009, 24(4): 755-758.
[7]刘新宽, 马明亮, 周敬恩.碳热还原法制备氮化铝反应机制的研究进展[J].硅酸盐通报, 1999(1): 35-39.LIU Xin-kuan, MA Ming-liang, ZHOU Jin-en.Review of mechanisms of carbothermal reduction nitridation reactions[J].Bulletin of the Chinese Ceramic Society, 1999(1): 35-39.
[8]朱克武, 张 宁, 才庆魁, 龙海波.AlON 陶瓷材料的研究进展[J].中国非金属矿工业导刊, 2008(1): 16-19, 30.ZHU Ke-wu, ZHANG Ning, CAI Qing-kui, LONG Hai-bo.Research progress in AlON ceramics[J].China Non-metallic Mining Industry Herald, 2008(1): 16-19, 30.
[9]WILLEMS H X,HENDRIX M,DEWITH G,METSELAAR R.Thermodynamics of Alon II:Phase relations[J].Journal of the European Ceramic Society, 1992, 10(4): 339-346.
[10]JOO H U, JUNG W S.Conversion of basic dicarboxylate Al(Ⅲ)complexes to aluminum carbide under a flow of argon[J].Journal of Alloys and Compounds, 2008, 465(1/2): 265-268.
[11]LI F J, TORU W, TATAMI J, KOMEYA K, MEGURO T.Synthesis of beta-SiAlON powder by carbothermal reduction-nitridation of zeolites with different compositions[J].Journal of the European Ceramic Society, 2007, 27(6):2535-2540.
[12]URRETAVIZCAYA G, LÓPEZ J M P, CAVALIERI A L.Pressureless sintering of Al2O3/SiCwmaterials: effect of the reducing atmosphere[J].Journal of the European Ceramic Society, 1997, 17(13): 1555-1563.
[13]COCHRAN C N.Alternate smelting processes for aluminum(part I)[J].Light Metal Age, 1987, 45(11/12): 15-20.
[14]BRUNO M J.Aluminum carbothermic technology[R].Washington: U.S.Department of Energy Golden Field Office,2004.
[15]KRUESI M, GALVEZ M E, HALMANN M, STEINFELD A.Solar aluminum production by vacuum carbothermal reduction of alumina-thermodynamic and experimental analyses[J].Metallurgical and Materials Transactions B, 2011, 42(1):254-260.
[16]YU Q C, YUAN H B, ZHU F L, ZHANG H, WANG C, LIU D C, YANG B.Carbothermic reduction of alumina with carbon in vacuum[J].Journal of Central South University: English Edition,2012, 19(7): 1812-1816.
[17]FOSTER L M, LONG C, HUNTER M S.Reactions between aluminium oxide and carbon: The Al2O3-Al4C3phase diagram[J].Journal of the American Ceramic Society, 1956, 39: 1-11.
[18]COX J H, PIDGEON L M.The X-ray diffraction patterns of aluminium carbide and aluminium oxycarbide Al4O4C[J].Canadian Journal of Chemistry, 1963, 41: 1414-1416.
[19]JEFFREY G A, SLAUGHTER M.The structure of aluminum tetroxycarbide Al4O4C[J].Acta Crystallographica, 1963, 16:177-184.
[20]DLUZEWSKI P, GORECKA J N, PASZKOWICZ W,YAMAGUCHI A.Transmission electron microscopy and X-ray diffraction study of aluminium oxycarbideα′-Al2CO[C]//KREISEL J, DUBOURDIEU C.Proceedings of International Conference on Thin Film Deposition of Oxide Multilayers Hybrid Structures.Les Ulis: EDP Science, 2001:273-275.
[21]GRASS V E, RYABKOV Y I, GOLDIN B A, SITNIKOV P A.X-Ray diffraction study of aluminum monoxycarbide[J].Journal of Structural Chemistry, 2004, 45(1): 100-106.
[22]KLIMOV V L, BERGMAN G A, KARLINA O K.Thermodynamic properties of aluminum monooxycarbide Al2OC[J].Russian Journal of Physical Chemistry, 2006, 80(11):1816-1818.
[23]HEYRMAN M, CHATILLON C.Thermodynamics of the Al-C-O ternary system[J].The Electrochemical Society, 2006,153(7): E119-130.
[24]LIHRMAN J M.Thermodynamics of the Al2O3-Al4C3systemⅠ:Thermochemical functions of Al oxide, carbide and oxycarbides between 298 and 2 100 K[J].Journal of the European Ceramic Society, 2008, 28(3): 633-642.
[25]LIHRMAN J M.Thermodynamics of the Al2O3-Al4C3systemⅡ: Free energies of mixing, solid solubilities and activities[J].Journal of the European Ceramic Society, 2008, 28(3): 643-647.
[26]LIHRMAN J M.Thermodynamics of the Al2O3-Al4C3system Ⅲ:Equilibrium vapour pressures and activation energies for volatilization[J].Journal of the European Ceramic Society, 2008,28(3): 649-656.
[27]ISH-AHALOM M.Formation of aluminum oxynitride by carbothermal reduction of aluminum oxide in nitrogen[J].Journal of Material Science Letters, 1982, 1(4): 147-149.
[28]HALMANN M, FREI A, ATEINFELD A.Carbothermal reduction of alumina: Thermochemical equilibrium calculation and experimental investigation[J].Energy, 2007, 32(12):2420-2427.
[29]LEFORT P, TETARD D, TRISTANT P.Formation of aluminium carbide by carbothermal reduction of alumina: Role of the gaseous aluminium phase[J].Journal of the European Ceramic Society, 1993, 12(2): 123-129.
[30]LEFORT P, BILLY M.Mechanism of AlN formation through the carbothermal reduction of Al2O3in a flowing N2atmosphere[J].Journal of the American Ceramic Society, 1993,76(9): 2295-2299.
[31]黄利萍, 黄熊璋, 符锡仁, 沈宝珍.氮化铝粉末的制备[J].硅酸盐学报, 1986, 14(3): 332-338.HUANG Li-ping, HUANG Xiong-zhang, FU Xi-ren, SHEN Bao-zhen.Preparation of aluminum nitride powder[J].Journal of the Chinese Ceramic Society, 1986, 14(3): 332-338.
[32]KATSOV D A, SHTEPAN A M, GRINSHTEIN I L,PUPYSHEV A A.Atomization of aluminium oxide in electrothermal atomic absorption analysis[J].Spectrochimica Acta B: Atomic Spectrcopy, 1992, 47(8): 1023-1041.
[33]L’VOV B V.The physical approach to the interpretation of the kinetics and mechanisms of thermal decomposition of solids:The state of the art[J].Thermochimica Acta, 2001, 373(2):97-124.
[34]COCHRAN C N.Aluminum suboxide formed in reaction of aluminum with alumina[J].Journal of the American Chemistry Soceity, 1955, 77(8): 2190-2191.
[35]COX J H, PIDGEON L M.The aluminum-oxygen-carbon system[J].Canadian Journal of Chemistry, 1963, 41: 671-683.
[36]YUAN Hai-bin, YANG Bin, YU Qing-chun, XU Bao-qiang,ZHU Yu-yan, FENG Yue-bin, DAI Yong-nian.Reaction mechanism of AlCl generated by carbothermic chloride to produce aluminum in vacuum[C]//Proceedings of the 9th Vacuum Metallurgy and Surface Engineering Conference.Beijing: Electronics Industry Press, 2009: 39-45.
[37]袁海滨, 冯月斌, 杨 斌, 郁青春, 徐宝强, 王鹏程, 戴永年.氧化铝在低价氯化铝法炼铝过程中的行为[J].中国有色金属学报, 2010, 20(4): 777-783.YUAN Hai-bin, FENG Yue-bin, YANG Bin, YU Qing-chun, XU Bao-qiang, WANG Peng-cheng, DAI Yong-nian.Thermal behavior of alumina in process of carbothermic reduction and chloride to produce aluminum[J].The Chinese Journal of Nonferrous Metals, 2010, 20(4): 777-783.
[38]袁海滨, 冯月斌, 徐宝强, 杨 斌, 郁青春, 戴永年.低价氯化铝法从氧化铝直接碳热还原炼铝的机理分析[J].真空科学与技术学报, 2010, 30(3): 259-264.YUAN Hai-bin, FENG Yue-bin, XU Bao-qiang, YANG Bin, YU Qing-chun, DAI Yong-nian.Direct extraction of aluminum from alumina by carbothermic reaction-chlorination and possible mechanisms[J].Chinese Journal of Vacuum Science and Technology, 2010, 30(3): 259-264.
[39]BACHELARD R.Aluminum nitride by carbothermal reduction[J].Materials Science and Engineering A, 1989, 109:247-251.
[40]沈 明.还原氮化法合成 AlN粉末的反应机理初探[J].硬质合金, 1991, 8(2): 24-27.SHEN Min.Investigation on reaction mechanism of synthesis AlN powders by reduction-nitriding technique[J].Cemented Carbide, 1991, 8(2): 24-27.
[41]何国新.铝源对碳热还原氮化法制备A1N粉末的影响[J].硅酸盐通报, 1993(4): 4-7.HE Guo-xin.Effect of aluminum source on synthesis process and properties of AlN powder prepared via carbothermalreduction and nitridation method[J].Bulletin of the Chinese Ceramic Society, 1993(4): 4-7.
[42]石功奇, 王 健, 丁培道.碳热反应合成 AlN粉末的研究[J].兵器材料科学与工程, 1995, 18(2): 34-39.SHI Gong-qi, WANG Jian, DING Pei-dao.Study of carbothermal synthesis of AlN powders[J].Ordnance Material Science and Engineering, 1995, 18(2): 34-39.
[43]刘新宽, 马明亮, 周敬恩.高温球磨对氧化铝碳热还原反应的影响[J].粉末冶金技术, 1999, 17(2): 99-102.LIU Xin-kuan, MA Ming-liang, ZHOU Jing-en.Influence of high energy ball milling at high temperature on carbothermal reduction of alumina[J].Powder Metallurgy Technology, 1999,17(2): 99-102.
[44]NOBORU H, YASUSHI S, TAKASHI B, HIROYOSHI Y,SHIGEHITO D.Preparation of aluminum nitride powder from aluminum polynuclear complexes[J].Journal of the American Ceramic Society, 1991, 74(6): 1282-1287.
[45]BAIK Y, SHANKER K, MCDERMID J R, DREW R A L.Carbothermal synthesis of aluminum nitride using sucrose[J].Journal of the American Ceramic Society, 1994, 77(8):2165-2172.
[46]傅崇说.有色冶金原理[M].北京: 冶金工业出版社, 1993:51-74 .FU Chong-yue.Principle of non-ferrous metallurgy[M].Beijing:Metallurgical Industry Press, 1993: 51-74.
[47]YU J K, UENO S, LI H X, HIRAGUSHI K.Improvement of graphitization of isotropic carbon by Al2O3formed from aluminum chelate compound[J].Journal of the European Ceramic Society, 1999, 19(16): 2843-2848.
[48]HIRAI N, NIWA T, IWATA T, OZAWA M, KATAYAMA H J.Formation of aluminum nitride by carbothermic reduction of alumina in a flowing nitrogen atmosphere[J].Journal of the Japan Institute of Metals, 1989, 53(10): 1035-1040.
[49]傅仁利, 于洪珍, 张月铭, 周和平.碳热还原法合成氮化铝的机理与热力学条件[J].中国矿业大学学报, 2002, 31(5):415-420.FU Ren-li, YU Hong-zhen, ZHANG Yue-ming, ZHOU He-ping.Mechanisms and thermodynamics conditions of carbothermal reduction nitridation reactions[J].Journal of China University of Mining & Technology, 2002, 31(5): 415-420.
[50]冯月斌.氧化铝真空碳热还原和碳热还原-氯化-歧化反应研究[D].昆明: 昆明理工大学, 2011: 13-15.FENG Yue-bin.Study on the carbothermal reduction and carbothermal reduction-chlorination-disproportionation of alumina in vacuum[D].Kunming: Kunming University of Science and Technology, 2011: 13-15.
[51]冯月斌, 杨 斌, 戴永年.真空下碳热还原氧化铝热力学[J].中国有色金属学报, 2011, 21(7): 1749-1755.FENG Yue-bin, YANG Bin, DAI Yong-nian.Thermodynamics of the carbothermal reduction of alumina in a vacuum[J].The Chinese Journal of Nonferrous Metals, 2011, 21(7): 1749-1755.
[52]VODOP′YANOV A G, KOZHEVNIKOV G N, ZAKHAROV R G.On the interaction of aluminum oxide with carbon[J].Russian Metallurgy, 1978(4): 12-17.
[53]VODOP′YANOV A G, SEREBRYAKOVA A V,KOZHEVNIKOV G N.Kinetics and mechanism of the interactions of aluminum oxides with carbon[J].Russian Metallurgy, 1982, 43(1): 39-43.

