茉莉酸和乙烯信号途径参与了油菜菌核病防卫反应
王 政, 姚银安
(1.江苏大学生命科学研究院, 镇江 212013; 2.中科院新疆生态与地理研究所, 乌鲁木齐 830011)
甘蓝型油菜(Brassicanapus)是中国最重要的油料作物,其所产菜籽油占中国食用植物油供应的50%。油菜菌核病(Sclertiniasclerotiorum(Lib.)de Bary)是限制中国油菜生产的主要因子之一。S.sclerotiorum是一种死体营养型病原菌[1],它导致中国油菜产量损失高达30%,严重时达到50%~80%。然而,人们对油菜菌核病的抗病分子机制尚不清楚。
植物对病原菌的抗性表现在多个方面和多个层次。当病原菌突破植物预制型防卫机制后,可诱导防卫机制发挥重要的抗病作用。这些诱导型防卫反应在植物体内由多种信号分子介导,其中,素茉莉酸(Jasmonic acid, JA)和乙烯(Ethylene, ET)是植物重要的防卫反应信号分子[2]。
JA和ET广泛存在于植物体中。如图1所示,茉莉酸在植物体中是经过十八碳途径(octadecanoid pathway)合成而来,其关键合成酶为脂氧合酶(lipoxygenase, LOX)和丙二烯氧合酶(allene oxide synthase, AOS)[3];ET合成的关键限速步骤是从S-腺苷甲硫氨酸到(S-adenosyl methionine) 到1-氨基环丙烷-1-羧酸 (1-aminocyclopropane-1-carboxylic acid, ACC) 的转化,这一过程由ACC氧化酶(ACS)催化而成,因此,ACS是乙烯合成的关键酶[4]。JA 和ET可以协同介导许多防御相关基因如PDF1.2 (plant defensin 1.2)和HEL(hevein-like protein gene, also called pathogenesis-related gene 4)的表达,在拟南芥-病原菌的相互作用中已被广泛的研究[5-8]。

图1 JA 和ET在植物体的合成途径(参考文献[9-10])
在油菜中,研究已经显示过表达JA和ET的正调控因子BnMPK的转基因植株显著提高菌核病抗性[11];基于拟南芥基因组芯片的研究结果也显示,油菜受到菌核病侵染时,JA信号途径中的基因表达发生显著改变[12]。这些结果暗示,JA和ET介导的信号反应在油菜抗菌核病中可能扮演着重要的作用,然而,这些研究缺乏JA和ET信号反应相关于S.sclerotiorum侵染的在油菜中的直接数据。
本研究应用拟南芥JA和ET关键合成基因和信号途径标志基因在油菜中的同源基因,在两个不同菌核病抗性的油菜品种中比较分析这些基因的S.sclerotiorum诱导表达谱,为更好地理解JA和ET信号反应在油菜抵抗S.sclerotiorum侵染中的作用提供直接数据。
1 材料与方法
1.1 材料与试剂
甘蓝型油菜品种中双九号(菌核病抗病品种)和84039(菌核病高感品种)、大肠杆菌(Escherichiacoli) DH5α菌株来自于本实验室;核盘菌(Sclerotiniasclerotiorum)菌核采自大田油菜茎杆。TRIzol RNA 提取试剂为Invitrogen产品,DNase1(RNase-free),逆转录酶(M170A)为Promega产品;SYBR Green Realtime PCR Master Mix为TOYOBO产品。
1.2 仪器与设备
蛋白核酸检测仪为DU 650 BECKMAN,USA;荧光定量PCR仪为RTTM-Cycler(博奥)。
1.3 方法
1.3.1 植株培养
油菜种子在25℃催芽后,选露白种子播于9cm×9cm的钵中,温室中土培(土∶蛭石=5∶1),光周期为:16 h光照(25℃)/8 h黑暗(20℃),相对湿度70%左右。
1.3.2 RNA 的提取及cDNA的制备
根据Trirol RNA提取试剂盒的操作进行总RNA提取。用蛋白核酸检测仪(DU 650 BECKMAN,USA)结合1.2%琼脂糖变性胶凝胶电泳结果测算RNA纯度和浓度。
按照Promega公司逆转录酶(M170A)的操作说明进行cDNA的制备。体系含有2 μg RNA,1 μL Oligo(dT),4 μL 的5×MMLV Reaction Buffer,1 μL的 dNTP(10mmol/L),RNase 抑制剂20 U,MMLV逆转录酶200 U。然后用DEPC水补至20 μL,混匀,42℃温育1 h,70℃水浴15 min灭活逆转录酶。
1.3.3 核盘菌接菌
当油菜幼苗长到四叶一心期进行核盘菌接菌,接菌前4~5 d将植株进行23℃恒温培养。菌核在PDA平板上于22℃静置培养3~4 d,当菌核即将铺满平板时,用φ5 mm打孔器沿菌丝外缘打孔,取菌丝块,用于接种,对照用无菌培养基块。
上述不同处理后,分别在0、6 h、24 h、72 h将叶片剪下,锡箔纸包裹,用液氮速冻后转入-80℃冰箱保存。
1.3.4 化学处理
用96%乙醇配制成0.1 mM MeJA的MeJA处理液;用灭菌双蒸水配制成1 mM ACC的ACC处理液。分别用这两种处理液喷雾处理四叶一心期的油菜品种中双号9离体叶片,MeJA处理以不含MeJA的乙醇溶液为对照(CK1);ACC处理以灭菌双蒸水为对照(CK2)。处理12 h后取样。
1.3.5 定量RT-PCR
定量RT-PCR方法:参照SYBR®Green Realtime PCR Master Mix-Plus-试剂盒(Takara),采用B.napusactin作为内标基因,引物由上海生工合成,基因引物序列信息见表1。

表1 荧光定量RT-PCR引物序列
荧光定量反应体系为20 μL:含有SYBR Mix 10 μL,正反向引物(10 μ mol/L)各0.8 μL,模板2 μL和DEPC处理过的无菌水。反应程序为:94℃、5min;94℃、15 s,55℃、20 s,72℃、30 s,40个循环;反应结束后先加热到95℃,然后降至72℃,再缓慢升温至95℃,记录荧光信号的变化,得出扩增产物的熔解曲线。进行3次重复实验。按照2-ΔΔCt方法对实验数据进行处理,并且求出系统误差[13]。
2 结果与分析
2.1 甘蓝型油菜茉莉酸关键合成基因的诱导表达分析
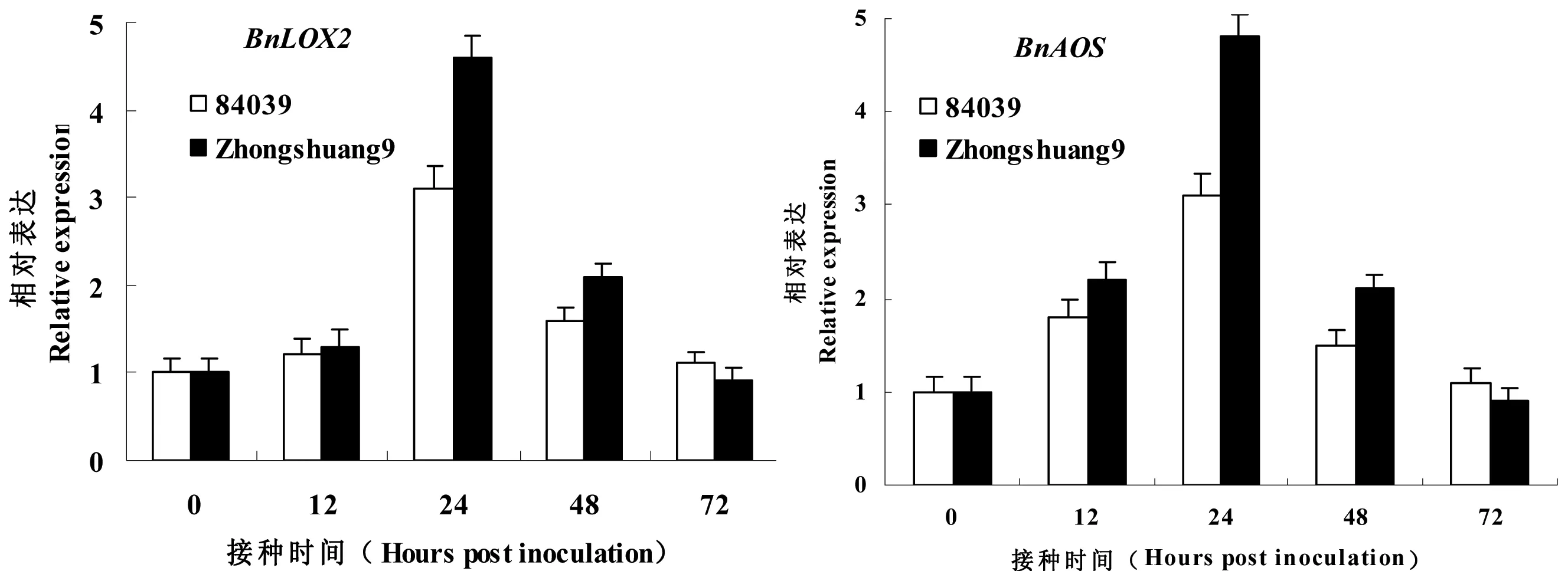
图2 茉莉酸合成基因的菌核病诱导表达
为了调查油菜中茉莉酸合成关键基因的菌核病诱导表达,本实验从NCBI数据库中搜索它们在油菜中的同源基因BnAOS和BnLOX2基因序列,设计引物,运用定量RT-PCR进行S.sclerotiorum诱导表达分析。如图2所示,BnLOX2和BnAOS在两个品种中均被S.sclerotiorum的侵染快速诱导,在接种24 h时达到最大,显示出这两个基因有相似的表达图谱,表明S.sclerotiorum的侵染能够快速诱导油菜防卫信号分子JA水平的增加。同时,在S.sclerotiorum接种24 h时,这两个基因在抗病品种中的相对表达量显著高于感病品种。
2.2 甘蓝型油菜乙烯关键合成基因的诱导表达分析
当用S.sclerotiorum接种12 h时,乙烯合成关键基因BnACS2在两个品种中均被快速表达,在接种24 h时达到最大,同时在接种12 h和24 h时,BnACS2在抗病品种中的相对表达量显著高于感病品种(图 3)。这些结果表明,S.sclerotiorum的侵染能够启动油菜体内乙烯快速的合成。

图3 乙烯合成基因的菌核病诱导表达
2.3 JA/ET信号途径标志基因的诱导表达分析
基于JA和ET关键合成基因的诱导表达结果,本研究进一步调查JA和ET介导的信号途径是否被S.sclerotiorum激活,因此JA/ET信号途径的标志基因BnPDF1.2和BnHEL的S.sclerotiorum诱导表达被调查。如图4所示,在S.sclerotiorum接种12 h时,在两个品种中BnPDF1.2的表达显著增加,在24 h达到最大;而BnHEL在S.sclerotiorum接种24 h时显著诱导表达;同时,在接种24 h和48 h时,这两个基因在抗病品种中的相对表达量显著高于感病品种。这些结果进一步表明S.sclerotiorum的侵染能够激活油菜JA和ET介导的防卫信号反应。
2.4 JA和ET功能类似物MeJA和ACC的药理学实验
以上结果显示,JA和ET防卫信号反应在S.sclerotiorum诱导表达中被协同激活。为了解释这一现象,本研究应用药理学实验即用JA和ET的功能类似物MeJA和ACC处理油菜,然后使用qRT-PCR方法调查信号基因的表达情况。正如图5所示,MeJA的处理不仅能够激活信号基因BnPDF1.2和BnHEL的表达,而且显著提高JA和ET合成基因BnLOX2、BnAOS和BnACS2的表达;同时,ACC除了BnPDF1.2和BnHEL的表达之外,也显著提高BnAOS和BnACS2的表达。这些结果表明,JA和ET信号反应能够相互促进,并且JA和ET信号反应本身存在自我放大的功能。
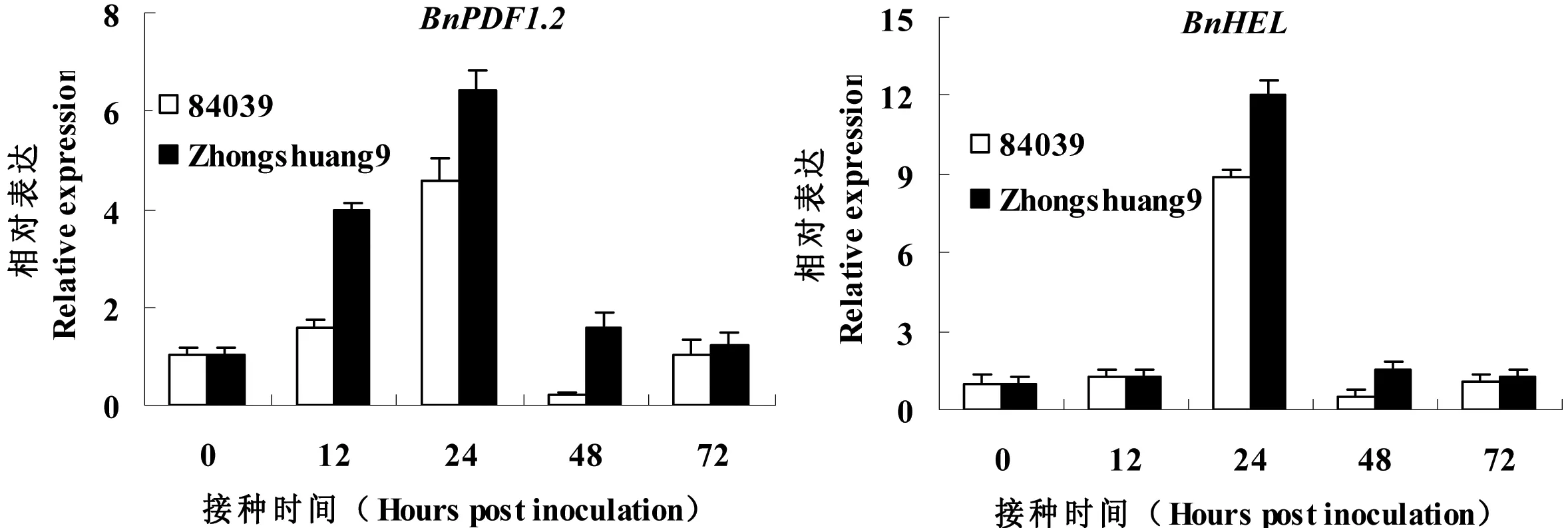
图4 茉莉酸和乙烯信号途径标志基因的菌核病诱导表达

图5 MeJA 和 ACC 的药理学实验
3 讨论
JA和ET防卫信号途径已经在各种植物-病原系统中进行了研究,但是对于油菜-菌核病这一重要的寄主——病原菌系统,有关它们的研究还未系统展开。本实验的结果显示,S.sclerotiorum不仅能够诱导油菜JA和ET合成途径关键基因BnAOS、BnLOX2和BnACS2的表达,而且也激活了JA和ET信号途径的标志基因BnPDF1.2和BnHEL的表达,这些结果说明S.sclerotiorum对油菜的侵染激活了JA和ET防卫信号反应。同时显示,这两个信号反应激活在抗病品种比在感病中更为有效,这进一步说明这两个信号反应在油菜抗S.sclerotiorum的侵染中发挥作用。
一个运用拟南芥基因序列RT-PCR的结果显示,S.sclerotiorum侵染导致JA反应基因WRKY33和WRKY40在油菜抗病品种中的表达显著高于在感病品种中的表达[14];基于基因组芯片的研究结果也显示,菌核病侵染油菜激活了JA信号途径中基因的表达[12];进而,过表达JA和ET信号途径的正调控因子BnMPK4显著提高油菜菌核病抗性[11];同时,拟南芥对死体营养性病原菌灰霉病(Botrytiscinerea)和黑斑病(Alternariabrassicicola)的抗性依赖于JA和ET信号反应[15-16],这些结果与本研究共同支持了一个观点即JA/ET信号防卫途径在植物抗死体营养性病原菌中具有重要的作用[2]。
本研究的药理学实验结果显示油菜中存在ET、JA信号反应的自我放大效应以及两者之间的相互促进作用,这很好地解释了油菜中JA和ET防卫信号反应在S.sclerotiorum诱导表达中的协同激活效应。这个结果类似于A.brassicicola侵染拟南芥中ET 和 JA信号反应的基因表达图谱[17];另外,如图3所示,我们也注意到S.sclerotiorum接种后,ET的合成基因BnASC2在抗病品种中在12 h就被显著激活,先于JA和ET信号反应在24 h的激活最高点,这一数据建议ET和JA信号的激活可能具有顺序性而非平行的关系。在拟南芥的研究也显示,ET能够解除JA信号的体内阻遏,暗示ET信号的激活可能早于JA信号[18]。因而,我们推测S.sclerotiorum的侵染首先使得体内ET含量的升高,然后通过自我放大环以及ET对JA信号的促进作用,使得JA和ET信号反应在接种24 h快速地达到激活最高点(图4)。然而这需要进一步实验研究。
[1]Bolton M D, Thomma B P H J, Nelson B D.Sclerotiniasclerotiorum(Lib.) de Bary: biology and molecular traits of a cosmopolitan pathogen[J].Mol Plant Pathol, 2006, 7:1-16.
[2]Glazebrook J.Contrasting mechanisms of defense against biotrophic and necrotrophic pathogens[J].Annu Rev Phytopathol, 2005, 43:205-227.
[3]Von Malek B, Van der Graaff E, Schneitz K, et al.TheArabidopsismale-sterile mutant dde2-2 is defective in the ALLENE OXIDE SYNTHASE gene encoding one of the key enzymes of the jasmonic acid biosynthesis pathway[J].Planta, 2002, 216:187-192.
[4]Wang K L, Li H, Ecker J R.Ethylene biosynthesis and signaling networks[J].Plant Cell, 2002, 14: 131-151.
[5]Xu M J, Dong J F, Zhu M Y.Nitric oxide mediates the fungal elicitor-induced hypericin production of hypericum perforatum cell suspension cultures through a jasmonic acid dependent signal pathway[J].Plant Physiol, 2005, 139:991-998.
[6]Seo H S, Song J T, Cheong J J, et al.Jasmonic acid carboxyl methyltransferase: a key enzyme for jasmonate-regulated plant responses[J].Proc Natl Acad Sci, 2001, 98: 4788-4793.
[7]Browse J.Jasmonate passes muster: a receptor and targets for the defense hormone[J].Annu Rev Plant Biol, 2009, 60:183-205.
[8]Van der Ent S, Van Wees S C M, Pieterse C M J.Jasmonate signaling in plant interactions with resistance-inducing beneficial microbes[J].Phytochemistry, 2009, 70:1581-1588.
[9]Turner J G, Ellis C, Devoto A.The jasmonate signal pathway[J].Plant Cell, 2002, 14 Suppl: 153-164.
[10]Wang K L, Li H, Ecker J R.Ethylene biosynthesis and signaling networks[J].Plant Cell, 2002, 14: 131-151.
[11]Wang Z, Mao H, Dong C, et al.Overexpression ofBrassicanapusMPK4 enhances resistance toSclerotiniasclerotiorumin oilseed rape[J].Mol Plant Microbe Interact, 2009, 22:235-244.
[12]Zhao J, Wang J, An L, et al.Analysis of gene expression profiles in response toSclerotiniasclerotioruminBrassicanapus[J].Planta, 2007, 227: 13-24.
[13]Livak K J, Schmittge T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method [J].METHODS, 2001, 25:402-408.
[14]Perchepied L, Balagué C, Riou C, et al.Nitric oxide participates in the complex interplay of defense-related signaling pathways controlling disease resistance toSclerotiniasclerotioruminArabidopsisthaliana[J].Mol Plant-Microbe Interact, 2010, 23(7):846-860.
[15]Asselbergh B, Curvers K, Franca S C, et al.Resistance to botrytis cinerea in sitiens, an abscisic acid-deficient tomato mutant, involves timely production of hydrogen peroxide and cell wall modifications in the epidermis[J].Plant Physiol, 2007, 144:1863-1877.
[16]Oh I S, Park A R, Bae M S, et al.Secretome analysis reveals anArabidopsislipase involved in defense againstAlternariabrassicicola[J].Plant Cell, 2005, 17:2832-2847.
[17]van Wees S C, Chang H S, Zhu T, et al.Characterization of the early response ofArabidopsistoAlternariabrassicicolainfection using expression profiling[J].Plant Physiol, 2003, 132: 606-617.
[18]Leon-Reyes A, Du Y, Koornneef A, et al.Ethylene signaling renders the jasmonate response of Arabidopsis insensitive to future suppression by salicylic acid[J].Mol Plant Microbes Interact, 2010, 23: 187-197.

