PI3K/Akt/mTOR 信号通路在巨噬细胞自噬及动脉粥样硬化斑块不稳定中的作用*
王和峰, 翟纯刚, 庞文会, 王 晨, 杨 敏,赵 凯, 李大庆, 张 运, 李继福△, 陈文强△
(1山东大学齐鲁医院心内科,山东 济南250012;2山东大学附属省立医院,山东 济南250021)
大量证据表明动脉粥样硬化(atherosclerosis,AS)的发展是个慢性炎症过程,而AS 斑块的急性炎症是导致斑块破裂、促进急性冠脉综合征(acute coronary syndrome,ACS)发生的关键因素,炎症反应是斑块易损性最重要的内在因素之一[1]。斑块中的巨噬细胞是斑块炎症反应的关键因素。如何减少斑块中的巨噬细胞的浸润,促进易损斑块的稳定已引起国内外学者的高度重视。
研究发现AS 斑块中巨噬细胞的变化与细胞的自噬(autophagy)关系密切,自噬参与了AS 的发生、发展过程[2]。自噬是保持细胞稳态重要的过程,可以被饥饿、病原入侵、细胞分化以及正常生长的调节所诱导。自噬表现为细胞生长过程中形成的能够降解长寿命蛋白以及自体多余的或失去功能的细胞器的功能。研究发现磷脂酰肌醇3 激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路在自噬中发挥关键的调节作用,针对该信号通路选择抑制性药物治疗肿瘤已经取得较为满意的效果[3-5]。本研究拟选择Akt抑制剂康士得(casodex)、mTOR 抑制剂雷帕霉素(rapamycin)及mTOR-siRNA 选择性抑制PI3K/Akt/mTOR 信号通路,促进巨噬细胞自噬,探寻抑制斑块炎症的可能机制和稳定易损斑块治疗的新策略。
材 料 和 方 法
1 材料
1.1 实验细胞与动物 小鼠巨噬细胞株RAW 264.7 购自中国科学院上海生命科学研究所;雄性纯种新西兰大白兔24 只,体重1.5 ~2.5 kg,购自山东省农业科学院。
1.2 试剂和药品 口服雷帕霉素(纯度98%),购于上海中康伟业生物科技有限公司;细胞干预雷帕霉素购自Calibiochem;口服康士得购自阿斯利康制药有限公司;细胞干预康士得(B9061)购自Sigma;RNA 逆转录试剂盒购自Fermentas;实时荧光定量PCR 试剂盒购自TaKaRa;蛋白提取试剂盒购自碧云天公司;抗体p-mTOR(#5536)、mTOR(#2983)、p-Akt(#4056)、Akt(#9272)和LC3-Ⅱ(#3868)购自Cell Signaling;RAM-11(MO63301)抗体购自Dako;siRNA 购自广州瑞博生物科技有限公司;白细胞介素4(interleukin 4,IL-4)、白细胞介素10(interleukin 10,IL-10)、干扰素γ(interferon γ,IFN-γ)和白细胞介素2(interleukin 2,IL-2)ELISA 试剂盒购自eBioscience。
1.3 仪器 JEM-1200 透射电子显微镜购自JEOL,iLab 血管内超声仪购自Boston Scientific。
2 方法
2.1 细胞培养及分组 小鼠巨噬细胞RAW 264.7生长在RPMI-1640 培养基,常规培养细胞,用相应试剂处理,取对数生长期的细胞,培养24 h 后,随机分为空白对照组、康士得组[康士得(20 μmol/L)共培养细胞48 h]、雷帕霉素组[雷帕霉素(10 nmol/L)共培养细胞48 h]以及siRNA 组[mTOR-siRNA(30 nmol/L)共培养细胞48 h]。
2.2 AS 动物模型的复制 24 只雄性新西兰纯种兔给予球囊损伤+高脂喂养(1%胆固醇,每只120 ~140 g·d-1)喂养8 周,8 周末随机分为对照组、康士得(1.0 mg·kg-1·d-1)组和雷帕霉素(0.5 mg·kg-1·d-1)组,每组8 只,干预4 周。
2.3 血管内超声( intravascular ultrasound,IVUS) 检查 采用血管内超声仪进行病变部位的检查,血管内超声探头为3.2 F,频率为40 MHz。血管内超声探头导管通过狭窄病变至血管远端,然后以0.5 mm/s 的速度缓慢回撤探头导管,标记斑块远端、近端图像,录像供脱机分析和存档。
2.4 透射电镜观察超微结构 药物共培养巨噬细胞48 h 后,收取各组细胞置于3%戊二醛中固定、PBS 洗涤、1%饿酸固定、梯度乙醇丙酮脱水、包埋、聚合、超薄切片、铅染后观察。干预动物4 周末,处死动物,分离腹主动脉血管段,处理方法同上。
2.5 细胞免疫荧光标记 24 孔板细胞爬片,2%多聚甲醛固定共培养的细胞,PBS 冲洗后,1% Triton X-100 细胞透入,5%BSA (牛血清白蛋白)封闭,加入相应Ⅰ抗后4 ℃孵育过夜。PBS 冲洗后,加入荧光Ⅱ抗,室温避光孵2 h,DAPI 染细胞核后,放荧光淬灭剂封片,共聚焦显微镜下观察。
2.6 Western blotting 检测细胞中总Akt、总mTOR、磷酸化Akt( p-Akt) 、磷酸化mTOR( p-mTOR) 及LC-3-Ⅱ蛋白的表达 收获细胞,PBS 洗涤3 次,用试剂盒提取蛋白后,采用BCA 蛋白定量法测定蛋白浓度。6% ~15%SDS 聚丙烯酰胺凝胶进行蛋白电泳,蛋白分离后200 mA 转膜至PVDF 膜上。室温下5%脱脂奶粉封闭膜2 h,用相应的Ⅰ抗4 ℃孵育膜过夜,洗涤后换HRP 标记Ⅱ抗室温孵育2 h。洗涤后采用化学发光试剂盒在GE ImageQuant LAS 4000 mini 超灵敏化学发光成像仪显影,使用ImageJ 的软件分析条带灰度值。
2.7 实时荧光定量RT-PCR 检测Akt、mTOR 和Beclin 1 的mRNA 表达 巨噬细胞总RNA 分离提取,反向转录成cDNA,以cDNA 为模板,采用SYBR Green进行实时荧光PCR 反应;反应参数:95 ℃30 s,1 个循环;95 ℃5 s,55 ℃10 s,40 个循环,样本中目的基因的计算方法为2-ΔΔCt[6]。小鼠Akt 上游引物5’-AGTCCCCACTCAACAACTTCT-3’,下 游 引 物 5’-GAAGGTGCGCTCAATGACTG-3’;小鼠mTOR 上游引物5’-CAGTTCGCCAGTGGACTGAAG-3’,下游引物5’-GCTGGTCATAGAAGCGAGAC-3’;小鼠Beclin 1 上游引物5’-GTCCACGCTCGACCTTCTTAC-3’,下游引物5’-CACTTGCCAGTCTTAACCTCTG-3’;甘油醛-3-磷酸脱氢酶(GAPDH)为内参照,小鼠GAPDH上游引物5’-AGGTCGGTGTGAACGGATTTG-3’,下游引物5’-TGTAGACCATGTAGTTGAGGTCA-3’。
2.8 巨噬细胞分泌炎症因子测定 取共培养48 h的细胞上清液,用酶联免疫吸附实验(ELISA)测定IFN-γ、IL-4、IL-10 和IL-2 的水平。严格按照ELISA试剂盒说明操作,IL-4、1L-10、IFN-γ 和IL-2 的可测范围分别为4 ~500、30 ~4 000、15 ~2 000 和2 ~200 ng/L,重复3 次实验,平行各组上清液标本检测3 次。
2.9 HE 染色及组织免疫组化染色 分离腹主动脉标本固定在4%多聚甲醛1 ~2 d。梯度乙醇脱水、透明、石蜡包埋。烤片,脱蜡至水,抗原修复后,免疫组化染色:3% 双氧水室温作用15 min,血清封闭15 min 后,加相应Ⅰ抗,4 ℃孵育过夜,洗涤后Ⅱ抗室温孵育1 h,DAB 显色,苏木素染色后,脱水透明及封片。HE 染色:苏木素染色后,用水冲洗,1%盐酸乙醇脱水,再用水冲洗,伊红染色,梯度乙醇脱水透明并中性树胶封片。
3 统计学处理
数据用均数± 标准差(mean ± SD)表示,应用SPSS 13.0 软件处理,采用单因素方差分析,以P <0.05 为差异有统计学意义。
结 果
1 体外细胞研究结果
1.1 透射电镜观察超微结构 药物共培养巨噬细胞48 h 后,与对照组比较,康士得组、雷帕霉素及mTOR-siRNA 组的自噬体均显著增加,见图1。
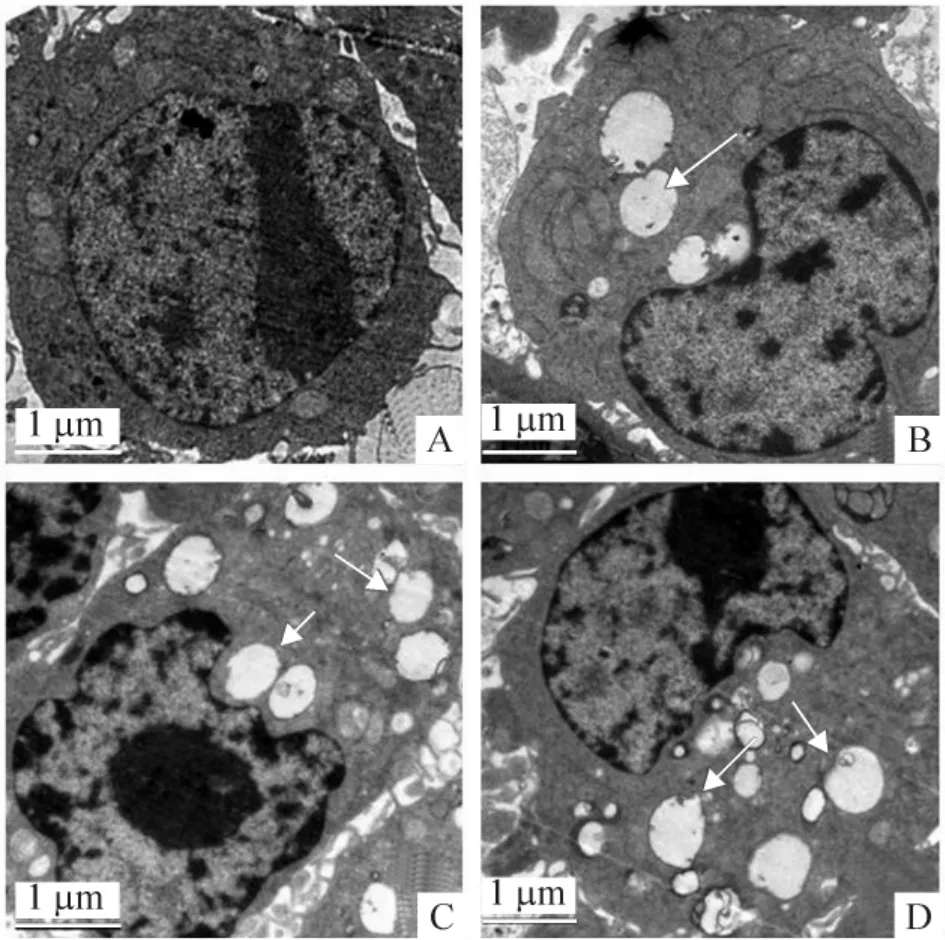
Figure 1. Transmission electron microscopy revealed that autophagosomes (indicated by arrows)in casodex,rapamycin and mTOR-siRNA groups were significantly increased as compared with control group. A:control;B:casodex;C:rapamycin;D:mTOR-siRNA.图1 透射电镜显示对照组、康士得组、雷帕霉素组及mTOR-siRNA 组的自噬体
1.2 细胞免疫荧光标记 与对照组比较,康士得组、雷帕霉素及mTOR-siRNA 组的微管相关蛋白LC3-II 的表达均增加,见图2A。
1.3 Western blotting 检测结果 与对照组比较,康士得组、雷帕霉素及mTOR-siRNA 组的微管相关蛋白LC3-II 表达均显著增加(均P <0.01),见图2B;而p-Akt 及p-mTOR 蛋白表达均显著减少(均P <0.01);Akt 蛋白表达均未见显著差异;mTOR 蛋白表达在mTOR-siRNA 组显著减少(P <0.01),而在康士得和雷帕霉素组未见显著差异,见图3。
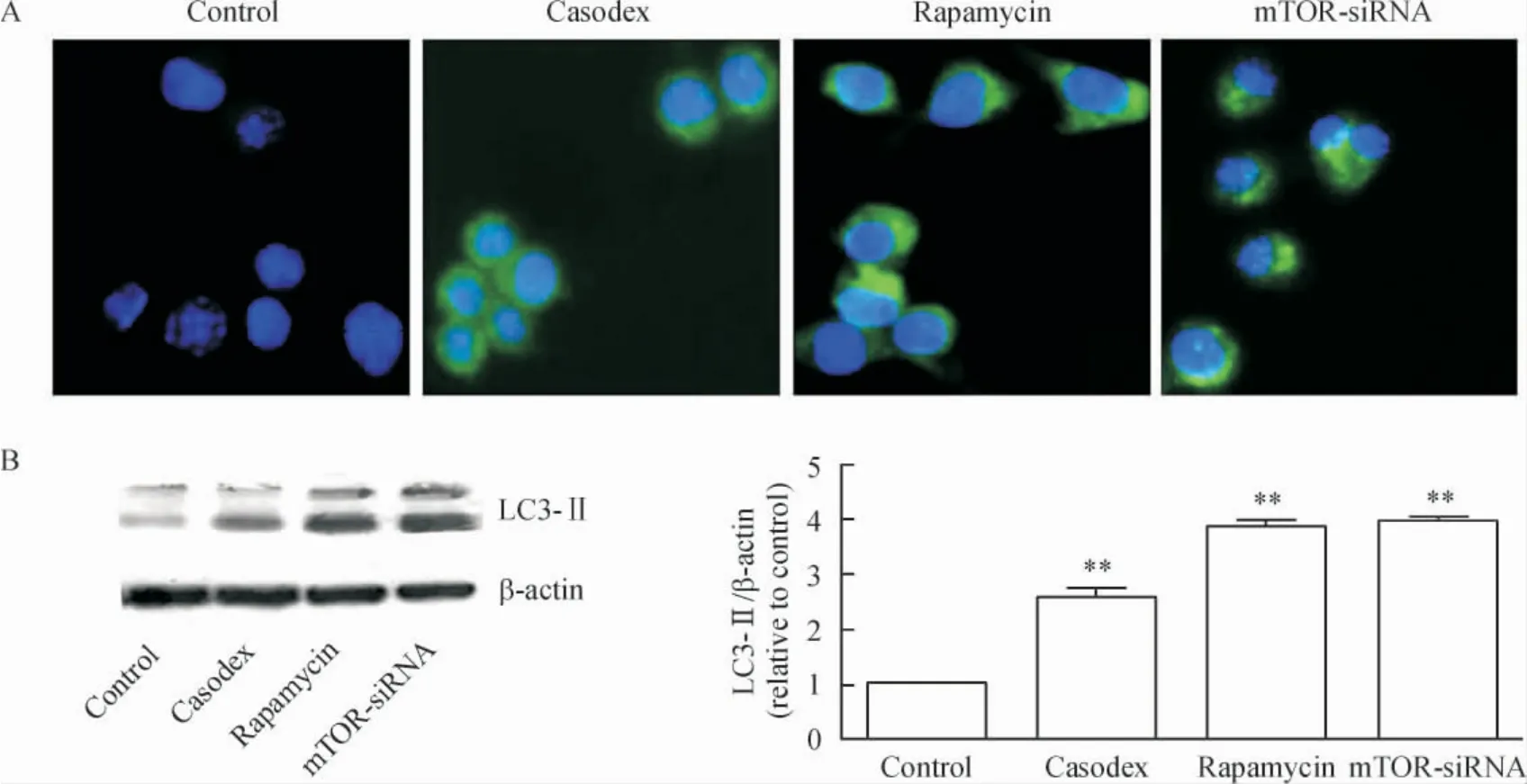
Figure 2. Both cell immunofluorescence (A;× 400)and Western blotting (B)showed that microtubule-associated protein LC3-II expression in casodex,rapamycin and mTOR-siRNA groups was significantly higher than that in control group. Mean±SD.n=3. **P <0.01 vs control group.图2 对照组、康士得组、雷帕霉素组及mTOR-siRNA 组微管相关蛋白LC3-II 的表达
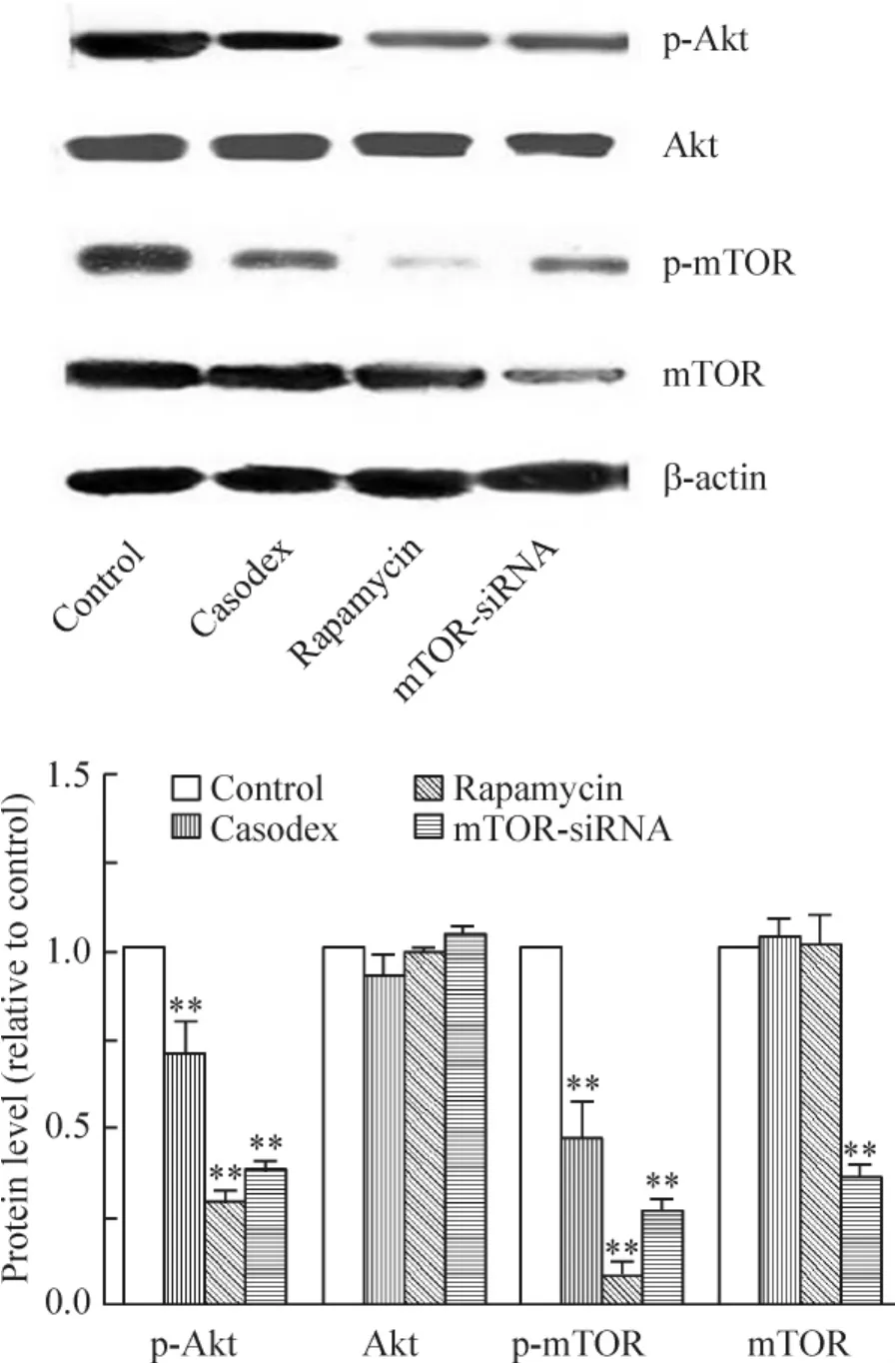
Figure 3. The expression of p-AKT and p-mTOR detected by Western blotting in control,casodex,rapamycin and mTORsiRNA groups. Mean ±SD.n=3. **P <0.01 vs control group.图3 对照组、康士得组、雷帕霉素组及mTOR-siRNA 组的p-Akt 及p-mTOR 的表达
1.4 实时荧光定量RT-PCR 检测结果 与对照组相比较,康士得组(1.73 ±0.07)、雷帕霉素组(3.61±0.38)及mTOR-siRNA 组(3.83 ±0.18)的自噬相关蛋白Beclin 1 mRNA 相对表达水平显著上调(P <0.05,P <0.01);与对照组相比较,康士得组(0.10±0.01)、雷帕霉素组(0.25 ±0.01)及mTOR-siRNA组(0.22 ±0.03)的Akt mRNA 相对表达水平显著下调(均P <0.01);与对照组相比较,康士得组(0.35±0.04)、雷帕霉素组(0.11 ±0.02)及mTOR-siRNA组(0.12 ±0.02)的mTOR mRNA 相对表达水平显著下调(均P <0.01),见图4。
1.5 巨噬细胞分泌的炎症因子 (1)IL-10 水平:与对照组[(221.10 ±3.70)ng/L]比较,康士得组[(170.90 ±6.08)ng/L]、雷帕霉素组[(112.70 ±8.81)ng/L]及mTOR-siRNA 组[(119.70 ±11.15)ng/L]明显降低(P <0.05 或P <0.01);(2)IFN-γ水平:与对照组[(11.32 ±0.42)ng/L]比较,康士得组[(12.88±1.02)ng/L]未见显著差异,雷帕霉素组[(17.41 ±1.19)ng/L]及mTOR-siRNA 组[(17.18 ±1.10)ng/L]显著增加(P <0.05);(3)与对照组比较,IL-4 及IL-2 的分泌未见显著差异,见图5。
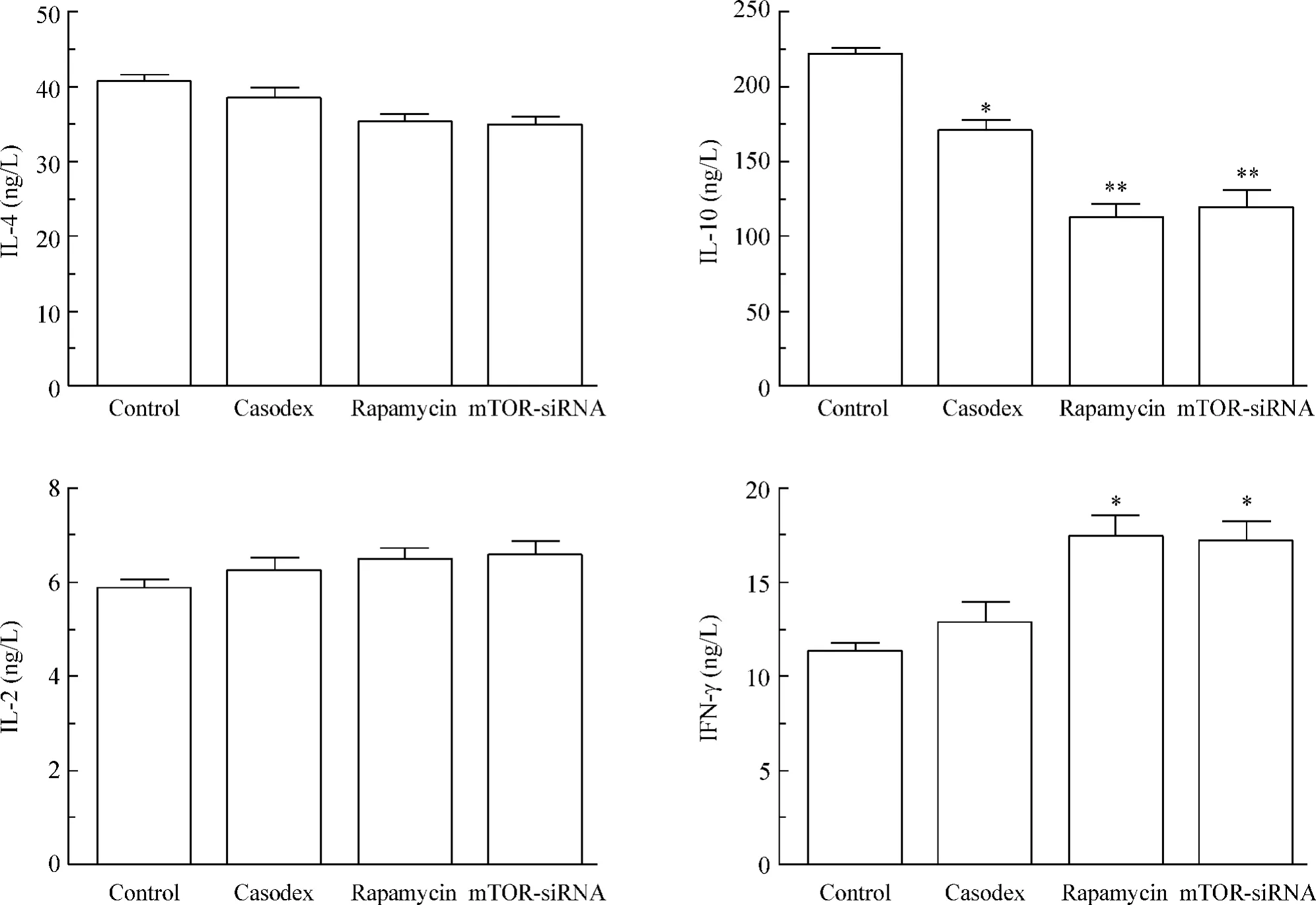
Figure 5. Concentrations of IL-4,IL-10,IL-2 and IFN-γ in cell culture supernatants detected by ELISA. Mean ±SD.n =3. * P <0.05,**P <0.01 vs control group.图5 细胞培养上清液中IL-4、IL-10、IL-2 和IFN-γ 的含量
2 动物实验研究结果
2.1 IVUS 检测结果 与对照组比较,康士得组及雷帕霉素组的外弹性膜面积(external elastic membrane area,EEMA)、斑块面积(plaque area,PA)及斑块负荷(plaque burden,PB)明显减少(均P <0.05),见表1。

表1 3 组兔干预4 周时IVUS 检测结果的比较Table 1. IVUS results of the rabbits after 4 weeks of intervention(mean±SD.n=8)
2.2 组织透射电镜检测结果 与对照组相比较,康士得组及雷帕霉素组斑块组织中的自噬体显著增多,其特点是细胞收缩,广泛空泡化,细胞器的减少,见图6。
2.3 组织免疫荧光法 与对照组相比较,康士得组[(23.12 ± 1.72)%]及 雷帕 霉 素组[(46.13 ±3.29)%]的微管相关蛋白LC3-II 面积/斑块面积的比例显著增加(均P <0.01),见图7。
2.4 HE 染色 与对照组比较,康士得组及雷帕霉素组的斑块纤维帽厚度不同程度地升高,内、中膜厚度减低(均P <0.01),见图8。
2.5 免疫组织化学染色 与对照组相比,康士得组(0.62 ±0.09)及雷帕霉素组(0.05 ±0.01)巨噬细胞RAM-11 的相对表达显著减少(P <0.05,P <0.01),见图9;与对照组相比较,康士得组(0.80 ±0.04)及雷帕霉素组(0.10 ±0.02)的p-mTOR 相对表达显著减少(P <0.05,P <0.01),见图10。
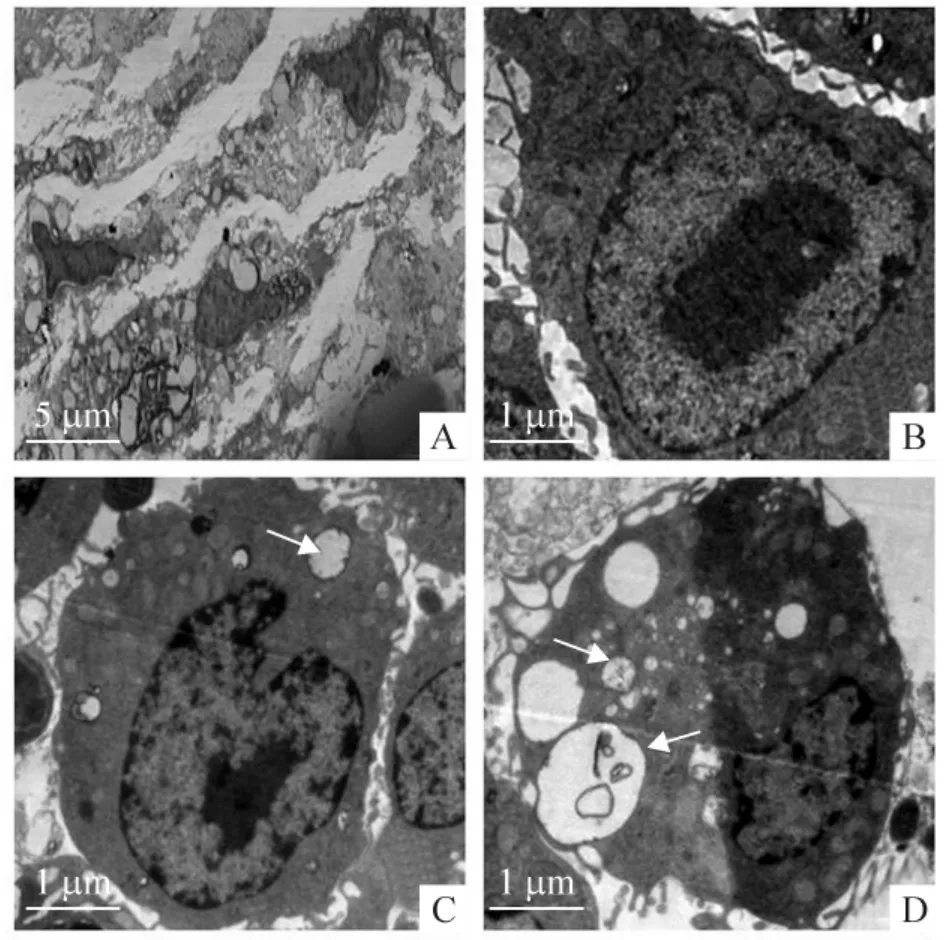
Figure 6. Transmission electron microscopy revealed that more typical autophagosomes (indicated by arrows)were detected in plaques of casodex and rapamycin groups as compared with control group. A:macrophage in plaques;B:control;C:casodex;D:rapamycin.图6 透射电镜观察对照组、康士得组及雷帕霉素组斑块中的自噬体
讨 论
ACS 主要是由于AS 易损斑块破裂、血栓形成造成冠状动脉急性闭塞所致。因此,斑块易损性已成为国内外研究的热点问题。斑块是否破裂取决于斑块内在特性和外在因素的共同作用,而前者是斑块不稳定性的决定因素。深入研究斑块不稳定性的发生机制,使易损斑块向稳定的方向转变,是预防ACS的重要方法。
通过对ACS 病人的尸检中发现冠状动脉斑块中存在大量的巨噬细胞、淋巴细胞和肥大细胞,其中巨噬细胞是破裂斑块中细胞的主要成分。斑块的纤维帽中侵入的巨噬细胞越多,斑块就越脆弱,这与巨噬细胞分泌基质金属蛋白酶,降解细胞外基质导致纤维帽变薄有关。同时,在斑块破裂过程中,巨噬细胞分泌大量的炎性因子,促进斑块向不稳定方向转化[7]。因此,斑块中的巨噬细胞是斑块不稳定的关键因素,如何减少斑块中的巨噬细胞的浸润,促进易损斑块的稳定已引起国内外学者的高度重视。
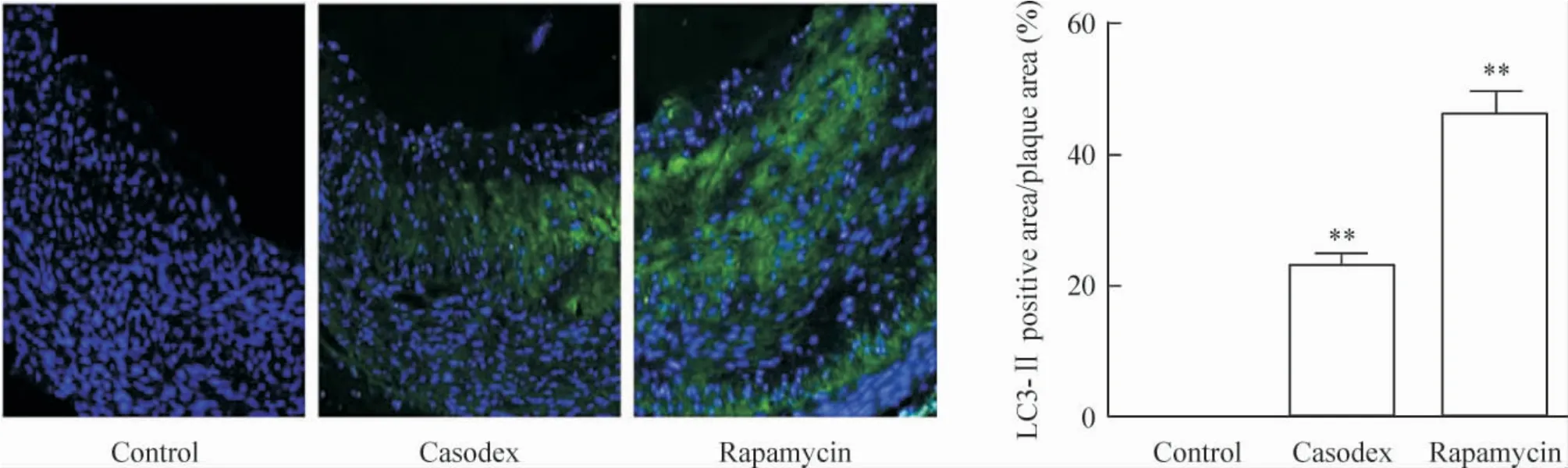
Figure 7. The ratio of LC3-II area to plaque area detected by immunofluorescence (×40). Mean±SD.n=8. **P <0.01 vs control group.图7 细胞免疫荧光标记观察各组LC3-II 面积/斑块面积
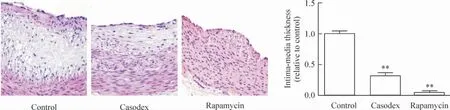
Figure 8. Thickness of the fibrous cap in casodex and rapamycin groups was higher than that in control group,while intima-media thickness was significantly reduced(HE staining,×40). Mean±SD.n=8. **P <0.01 vs control group.图8 HE 染色观察对照组、康士得组及雷帕霉素组的斑块纤维帽及内、中膜厚度
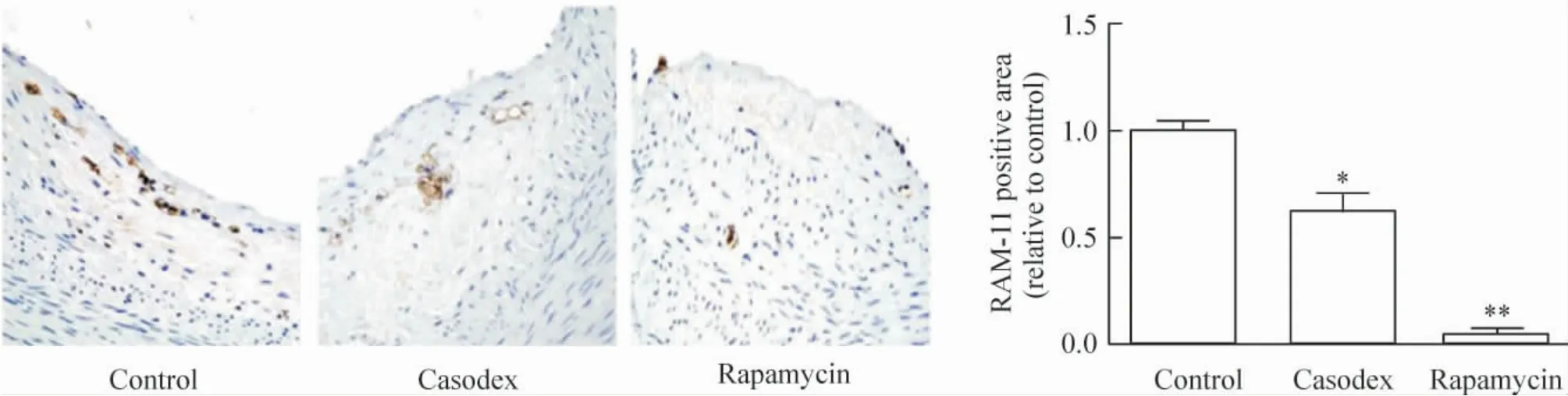
Figure 9. RAM-11 expression in macrophages detected by immunohistochemical staining (×40). Mean±SD.n=8. * P <0.05,**P<0.01 vs control group.图9 免疫组织化学观察各组巨噬细胞RAM-11 表达
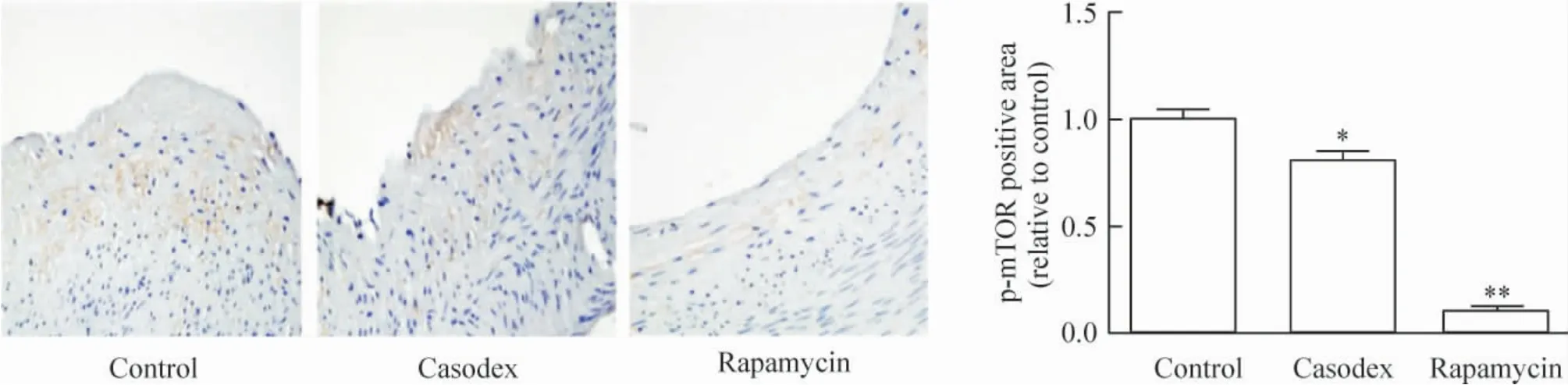
Figure 10. p-mTOR expression in casodex and rapamycin groups was significantly reduced as compared with control group detected by immunohistochemical staining (×40). Mean±SD.n=8. * P <0.05,**P <0.01 vs control group.图10 免疫组织化学染色观察对照组、康士得组及雷帕霉素组的p-mTOR 表达
自噬顾名思义为“自食”,是一种在细胞溶酶体中降解蛋白质和细胞器渐进的相对保守的机制。基础自噬代表了一种修复,维持生命的过程,但毫无控制的自噬活动会促进细胞死亡[8]。研究表明,自噬在AS 形成和发展中发挥重要的调节因素。在AS 早期,巨噬细胞的自噬减少了泡沫细胞的积聚,抑制了斑块的形成和发展。在AS 的中晚期,巨噬细胞的自噬减少斑块中的炎症反应,起到稳定斑块的作用,而平滑肌细胞的自噬促进纤维帽变薄,使斑块向不稳定方向发展。Martinet 等[2]认为低密度脂蛋白、炎症以及代谢性应激可以促进AS 斑块中细胞的自噬。斑块细胞的自我吞噬是斑块细胞通过降解损伤的细胞器从而防止外部氧化应激损害。Verheye 等[9]利用扫描电镜、免疫组织化学染色等方法发现AS 斑块中巨噬细胞和平滑肌细胞均存在自噬现象。Altman等[4]研究发现氧化应激能够引起斑块细胞的自噬,其中PI3K/Akt/mTOR 信号通路起到关键的调节作用。
国内外学者已经针对PI3K/Akt/mTOR 信号转导通路选择抑制性药物治疗肿瘤。Ghosh 等[10]研究发现雄激素依赖性前列腺癌细胞株LNCaP 和雄激素非依赖性前列腺癌细胞株C4-2 均能被PI3K 抑制剂LY294002 而不能被 MAPK/ERK 激酶抑制剂PD98059 抑制;Akt 抑制剂康士得导致LNCaP 细胞生长阻滞,却不能抑制C4-2 细胞的增殖。mTOR 抑制剂雷帕霉素可以使C4-2 细胞增殖水平下降50%[11]。最近研究发现利用药物依维莫司和雷帕霉素抑制mTOR,通过促进肿瘤细胞的自噬而抑制肿瘤的发生发展[12]。
我们通过体外巨噬细胞以及体内AS 不稳定斑块兔模型的研究发现,利用Akt 抑制剂康士得、mTOR 抑制剂雷帕霉素及mTOR-siRNA 干预巨噬细胞或AS 家兔后,Akt 及mTOR 的表达明显减少,说明可以有效地阻断PI3K/Akt/mTOR 信号转导通路。经干预后,巨噬细胞自噬现象明显增强,表现为透射电镜下观察自噬体明显增多,微管相关蛋白LC3-II和自噬相关蛋白Beclin 1 的表达水平明显上调。微管相关蛋白LC3 最初合成一个未处理的形式即前体LC3,但立即被Atg4 裂解,产生一种活跃的细胞溶质形式被称为LC3-I。随着Atg7 的催化和E2 酶Atg3的结合,LC3-I 和丰富的膜磷脂即磷脂酰乙醇胺相互作用产生了LC3-II。脂化反应导致了LC3 的构象变化,这对自噬体的形成非常重要。因为LC3-II 的相对量反映了自噬体的含量,这种LC3 亚型是目前最广泛用来检测自噬体的分子标记。Beclin 1 基因是第一个确认的哺乳动物的自噬基因,也是第一个确认的在自噬溶酶体降解途径中起肿瘤抑制的基因,对自噬体的形成至关重要[13]。本研究结果充分说明,选择性抑制PI3K/Akt/mTOR 信号转导通路能够明显促进巨噬细胞的自噬现象。
体外巨噬细胞的干预研究显示,经康士得、雷帕霉素或mTOR-siRNA 选择性抑制PI3K/Akt/mTOR信号转导通路后,巨噬细胞分泌的IL-10 明显降低,而IFN-γ 的分泌显著增加,表明炎症反应明显降低。体内动物研究发现,经康士得或雷帕霉素干预后,IVUS 显示康士得组及雷帕霉素组的外弹性膜面积、斑块面积及斑块负荷与对照组比较均明显减少,病理学检测发现AS 斑块中巨噬细胞RAM-11 染色明显减少,斑块纤维帽的厚度不同程度地升高,内、中膜厚度减低。以上结果表明阻断信号通路后可以明显降低炎性反应,使AS 斑块逐渐转变为稳定斑块。
总之,选择性抑制PI3K/Akt/mTOR 信号通路能诱导巨噬细胞自噬,减少斑块巨噬细胞的浸润,抑制炎症反应进而稳定动脉粥样硬化易损斑块。
[1] Libby P. Inflammation in atherosclerosis[J]. Nature,2002,420(6917):868-874.
[2] Martinet W,De Meyer GR. Autophagy in atherosclerosis:a cell survival and death phenomenon with therapeutic potential[J]. Circ Res,2009,104(3):304-317.
[3] Wullschleger S,Loewith R,Hall MN. TOR Signaling in growth and metabolism[J]. Cell,2006,124(3):471-484.
[4] Altman JK,Yoon P,Katsoulidis E,et al. Regulatory effects of mammalian target of rapamycin-mediated signals in the generation of arsenic trioxide responses[J]. J Biol Chem,2008,283(4):1992-2001.
[5] Sinnberg T,Lasithiotakis K,Niessner H,et al. Inhibition of PI3K-AKT-mTOR signaling sensitizes melanoma cells to cisplatin and temozolomide[J]. J Invest Dermatol,2009,129(6):1500-1515.
[6] Livak KJ,Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J]. Methods,2001,25(4):402-408.
[7] Falk E,Shah PK,Fuster V. Coronary plaque disruption[J]. Circulation,1995,92(3):657-671.
[8] 刘友斌,杨树森,樊 瑛,等. 自噬与心肌缺血/再灌注损伤[J]. 中国病理生理杂志,2009,25(12):2478-2482.
[9] Verheye S,Martinet W,Kockx MM,et al. Selective clearance of macrophages in atherosclerotic plaques by autophagy[J]. J Am Coll Cardiol,2007,49(6):706-715.
[10]Ghosh PM,Malik SN,Bedolla RG,et al.Signal transduction pathways in androgen-dependent and -independent prostate cancer cell proliferation[J].Endocr Relat Cancer,2005,12(1):119-134.
[11]Weyergang A,Berg K,Kaalhus O,et al. Photodynamic therapy targets the mTOR signaling network in vitro and in vivo[J]. Mol Pharm,2009,6(1):255-264.
[12]Chen WQ,Zhong L,Zhang L,et al. Oral rapamycin attenuates inflammation and enhances stability of atherosclerotic plaques in rabbits independent of serum lipid levels[J]. Br J Pharmacol,2009,156(6):941-951.
[13]晏 浩,徐建军,李文林,等. MicroRNA-30a 调控Beclin-1 对缺氧复氧乳鼠心肌细胞的保护效应[J]. 中国病理生理杂志,2012,28(4):583-588.
——雷帕霉素

