吉西他滨对CD34 + CD38 - 髓系白血病干细胞的增殖抑制和凋亡诱导作用*
韩慧娟, 胡亮杉, 邓 兰, 高莹莹, 郭坤元△
(1南方医科大学珠江医院血液内科,广东 广州510282;2广东省第二人民医院检验科,广东 广州510317)
吉西他滨(gemacitabine,GEM)是一种与Ara-C结构相似的新型的脱氧胞苷相似物和核苷还原酶抑制剂,它属于抗代谢类抗癌药物,主要作用于DNA合成期和G1后期,可阻止细胞由G1进入S 期[1]。有较强的细胞毒性,广泛用于实体瘤的治疗,不良反应小疗效显著[2-3]。国外陆续开展了吉西他滨联合其它化疗药物治疗难治性多发性骨髓瘤、淋巴瘤及自体造血干细胞移植治疗的临床试验,结果显示患者的缓解率和总的生存期较其它化疗方案有所提高,而且其毒副反应发生相对轻微,具有良好的耐受性[4]。但有关急性髓性白血病(acute myeloid leukemia,AML)的临床试验尚未见相关报道,目前对白血病的研究仅限于群体细胞研究。而白血病干细胞(leukemic stem cells,LSCs)是急性髓性白血病复发和耐药的重要原因[5],白血病研究治疗应针对LSCs。因此本研究以处于LSCs 发育阶段的CD34+CD38-KG1a 细胞为靶,以Ara-C 为对照,研究GEM 对其增殖、细胞周期及凋亡影响,为GEM 的白血病临床应用提供一定的理论和实验依据。
材 料 和 方 法
1 材料与试剂
人急性髓细胞白血病细胞株KG1a 细胞由中国医学科学院血液学研究所馈赠,由本实验室传代,佘妙容等[5]成功将KG1a 细胞植入NOD/SCID 小鼠,获得CD34+CD38-KG1a 细胞。GEM(纯度>98%;Sigma);阿糖胞苷(cytosine arabinoside,Ara-C;哈尔滨博莱制药有限公司),0.4%台盼蓝染液(Gibco);RPMI-1640 液体培养基(HyClone);胎牛血清(杭州四季青公司);Annexin V-FITC/PI 细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司);细胞周期检测试剂盒(江苏碧云天生物技术研究所);CD34-PE、CD38-FITC 及同型对照小鼠抗人抗体(Biolegend);低熔点琼脂(Amresco)。
2 方法
2.1 KG1a 细胞培养 KG1a 细胞培养于含10%胎牛血清的RPMI-1640 培养基中,置于37 ℃、5%CO2、饱和湿度培养箱中培养,2 ~3 d 传代。
2.2 流式细胞术检测KG1a 细胞表面CD34 和CD38 抗原表达 收集5 ×105个对数生长期的KG1a细胞,2 000 r/min 离心5 min,PBS 洗涤2 次,100 μL PBS 重悬细胞后分别加入小鼠抗人单克隆抗体CD34-PE 和CD38-FITC 各20 μL,室温下避光孵育30 min,PBS 洗涤2 次,即刻上机检测。以同型对照FITC 和PE 荧光抗体为对照,流式细胞仪检测,实验重复3 次。
2.3 流式细胞术检测KG1a 细胞周期及凋亡变化
收集对数生长期KG1a 细胞1 ×106个接种于6 孔板,每孔2 mL,分别加入终浓度GEM(0.05 mg/L、0.1 mg/L、0.5 mg/L)、Ara-C(0.05 mg/L、0.1 mg/L、0.5 mg/L )和生理盐水(对照组),24 h 后离心收集全部细胞,用1 mL PBS 重悬,取0.5 mL,PBS 洗2遍,用70%冰乙醇重悬细胞,-20 ℃固定过夜,PBS洗涤1 遍,弃上清加入300 μL DNA 染液(内含PI 100 mg/L 和RNA 酶2 ×104U/L)37 ℃避光染色30 min,PBS 洗涤2 遍,流式细胞仪检测细胞周期。0.5 mL 用PBS 洗涤2 次,弃上清,用500 μL 的结合缓冲液重悬细胞,分别加入Annexin V-FITC 和PI 各5 μL,室温下避光孵育15 min,流式细胞仪检测细胞凋亡,实验重复3 次。
2.4 软琼脂克隆法观察KG1a 细胞增殖能力 将1.0%琼脂糖与2 ×RPMI-1640 培养液(20%胎牛血清)等体积混合,制成0.5%底层琼脂凝胶加入6 孔板,每孔1 mL,室温凝固。(1)GEM 和Ara-C 作用24 h组:取对数生长期细胞,GEM、Ara-C(0.05 mg /L、0.1 mg/L、0.5 mg /L)及生理盐水(对照组)作用24 h,2 000 r/min 离心5 min,PBS 洗涤2 遍,弃上清,重悬计数,调整细胞为每孔2 500个,加入到0.8%的琼脂糖与2 × RPMI-1640 培养液等体积混合制成0.4%上层琼脂凝胶中。(2)GEM 和Ara-C 持续作用组:取对数生长期细胞,调整细胞为每孔2 500 个,加入到0.8%琼脂糖与2 × RPMI-1640 培养液等体积混合制成0.4%上层琼脂凝胶中,每孔分别加入0.05 mg/L、0.1 mg/L 和0.5 mg/L GEM 和Ara-C,生理盐水作为对照组,以上每组设3 个复孔,待凝固后将培养板置于37 ℃、5% CO2及饱和湿度环境下培养,分别在14 d 和21 d 将培养板放置于倒置显微镜下观察其形态,并拍照,以>50 个细胞团为1 个集落,计数其集落数。
3 统计学处理
数据以均数± 标准差(mean ± SD)表示,应用SPSS 13.0 软件处理,多组间均数比较采用析因设计资料的方差分析,两组均数比较采用t 检验,以P <0.05 为差异有统计学意义。
结 果
1 KG1a 细胞表面CD34 和CD38 抗原的表达
流式细胞术检测结果显示,CD34+CD38-KG1a细胞占(98.02 ±0.72)%,即实验用KG1a 细胞处于白血病干细胞发育阶段,见图1。
2 GEM 阻滞KG1a 细胞在G1/G0期
0.05 mg/L 和0.1 mg/L GEM 和Ara-C 培养24 h对KG1a 细胞的细胞周期均无影响(P >0.05)。而0.5 mg/L GEM 使KG1a 细胞进入G1/G0期,G1/G0期细胞增多(P <0.05),S 期和G2/M 期细胞减少(P <0.05)。0.5 mg/L Ara-C 对G1/G0期和S 期细胞无明显影响(P >0.05),使G2/M 期细胞减少(P <0.05)。可见不同浓度GEM 作用KG1a 细胞24 h 后,G1/G0期细胞所占比例随着药物浓度的增大而增加,S 期与G2/M 期细胞比例相应下降,呈现G1/G0期阻滞现象,见图2。
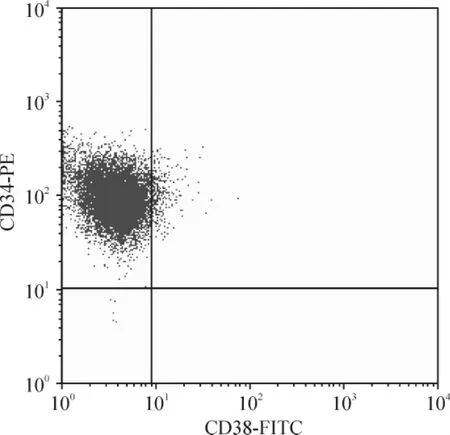
Figure 1. Percentage of CD34 + CD38 - acute myeloid leukemia KG1a cells.图1 KG1a 细胞表面CD34 和CD38 抗原的表达
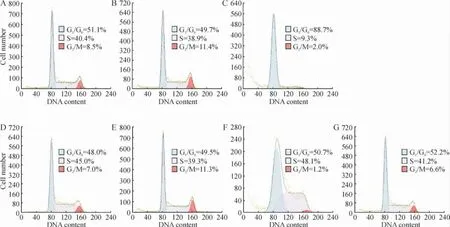
Figure 2. Effects of different concentrations of GEM and Ara-C on cell cycle of KG1a cells(for 24 h).A:0.05 mg/L GEM;B:0.1 mg/L GEM;C:0.5 mg/L GEM;D:0.05 mg/L Ara-C;E:0.1 mg/L Ara-C;F:0.5 mg/L Ara-C;G:control.图2 不同浓度GEM 及Ara-C 对KG1a 细胞细胞周期的影响
3 吉西他滨抑制KG1a 细胞的集落形成能力
0.05 mg/L、0.1 mg/L 和0.5 mg/L GEM 作用KG1a 细胞24 h 后,每孔2 500 个,软琼脂培养第14 d,0.1 mg/L 和0.5 mg/L 组克隆数分别为376.00 ±28.75 和93.00 ±9.61,低于盐水对照组(538.00 ±43.86,P <0.05),第21 d 克隆数为390.00 ±27.06和97.00 ±8.02,低于盐水对照组(599.00 ±16.01,P<0.05),0.05 mg/L GEM 组14 d 和21 d 克隆数分别为507.00 ±27.87 和686.00 ±61.10,与对照组(538.00 ±43.86 和599.00 ±16.01)相比,差异无统计学意义(P >0.05)。同时点同浓度GEM 与Ara-C组间相比,GEM 组集落均少于Ara-C 组,差异有统计学意义(P <0.05),而Ara-C 低浓度组对KG1a 细胞无抑制作用,高浓度组有抑制作用,差异均有统计学意义(P <0.05)。0.05 mg/L、0.1 mg/L 和0.5 mg/L GEM 和Ara-C 持续作用组,每孔2 500 个,软琼脂培养14 d 和21 d 均未见集落生长,抑制作用强于对照组(538.00 ±43.86 和599.00 ±16.01,P <0.05)。这说明单次用药Ara-C 对肿瘤干细胞抑制作用不明显,而加大浓度及作用时间会增加对肿瘤干细胞的杀伤作用。而GEM 无论单次用药还是持续用药,对抑制KG1a 细胞及增殖作用均优于同浓度Ara-C 组,见图3。

Figure 3. Effect of GEM on the colony formation and morphosis of KG1a cells (methyl violet staining,×100 in a,b,c,d and e). A:0.1 mg/L GEM for 24 h;B:0.1 mg/L Ara-C for 24 h;C:0.1 mg/L GEM for 21 d;D:0.1 mg/L Ara-C for 21 d;E:control.图3 GEM 对KG1a 细胞集落与形态的影响
4 GEM 对KG1a 细胞的诱导凋亡作用
0.05 mg/L 和0.1 mg/L GEM 和Ara-C 对KG1a细胞的早、晚期凋亡率与盐水对照组比较均无显著差异(P >0.05),而0.5 mg/L GEM 对KG1a 细胞的早、晚期凋亡率与盐水对照组相比明显升高(P <0.05)。而0.5 mg/L Ara-C 组与盐水对照组相比晚期凋亡率无显著差异(P >0.05),早期凋亡率升高(P <0.05),见图4。这些结果表明,Ara-C 具有诱导细胞早期凋亡作用,无诱导晚期凋亡作用;浓度为IC50的GEM 对KG1a 细胞不具有早晚期诱导凋亡作用,增大药物浓度对KG1a 细胞均具有诱导早、晚期凋亡作用,且其诱导凋亡作用优于同浓度Ara-C 组。
讨 论
AML 是一种血液系统的恶性克隆性疾病,化疗是治疗AML 最常用且有效的手段之一[6],尽管化疗改善了患者病情缓解和远期生存,但仍有15% ~25%患者因耐药或者复发导致治疗失败和死亡,并且大于40%的缓解患者在2 年内复发。目前认为具有长期自我更新能力的LSCs 是白血病治疗后耐药和复发的主要根源。肿瘤干细胞是肿瘤起源、发展和转移的种子细胞,只有消除肿瘤干细胞才能提高肿瘤的治愈率,LSCs 是白血病的肿瘤干细胞,以LSCs 为靶的治疗正在成为各种治疗的新定位[7]。LSCs 对AML 的治疗策略应考虑联合对LSCs 有抑制作用的化疗方案,佘妙容等[5]成功将KG1a 细胞植入NOD/SCID 小鼠,获得CD34+CD38-KG1a 细胞,研究表明CD34+CD38-的KG1a 细胞对蒽环类药物耐药并抵抗NK 细胞的杀伤效应,故本实验采用CD34+CD38-KG1a 细胞为研究对象。
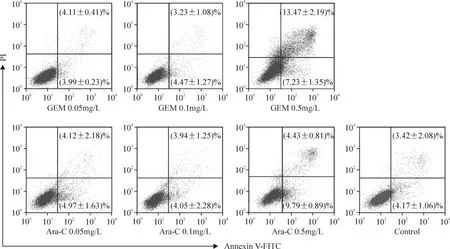
Figure 4. Effect of GEM on the apoptosis of KG1a cells (for 24 h).Mean±SD.n=3.图4 GEM 对KG1a 细胞凋亡率的影响
核苷类药物是急性白血病治疗常用药物,代表药物为Ara-C。GEM 作为新型核苷类药物,通过抑制核糖核苷酸还原酶和竞争性插入DNA 链中脱氧胞苷的位点导致DNA 链断裂,阻滞细胞周期并诱导细胞凋亡[8]。GEM 较Ara-C 相比,其水溶性和磷酸化效率比阿糖胞苷强,代谢活化产物对核苷激酶有更高的亲和力,可增加其穿透靶细胞膜、抑制脱氧胞嘧啶脱氨酶、减少细胞内代谢物的降解,从而减缓药物排泄,使细胞内可持续高水平积聚活化的核苷。GEM 具有自我增效、抗肿瘤活性强、抗瘤谱广,且与其它化疗药物无交叉耐药且毒性反应无叠加,给药后迅速分布至全身等优点,但对白血病干细胞治疗尚无相关研究。本实验研究GEM 对具有抑制LSCs特性的CD34+CD38-KG1a 细胞的增殖及诱导凋亡作用。
研究表明,细胞周期失调是肿瘤细胞无限增殖的重要原因之一,本研究发现GEM 能使KG1a 细胞大多阻滞在G1/G0期,导致细胞分裂期细胞数量减少,细胞增殖受抑,并随着浓度的增加抑制越明显。软琼脂克隆实验是体外检测细胞自我更新和增殖潜能的有效方法,14 d 之前培养集落多为分化阶段较晚、增殖能力较差细胞形成,21 d 培养的晚期集落主要由干/祖细胞形成,反映了干细胞的增殖潜能。在本研究中发现,在24 h 作用组,不同浓度GEM 均对CD34+CD38-KG1a 细胞的早期及晚期集落的形成显著抑制,GEM 持续作用组在7 d、14 d 和21 d 均未见克隆生长,GEM 可较大限度抑制CD34+CD38-的KG1a 细胞的增殖。而Ara-C 组在0.05 mg/L 和0.1 mg/L 均不具有早、晚期集落抑制作用,0.5 mg/L 浓度Ara-C 对早期集落有抑制作用,但与同浓度GEM相比,抑制作用较弱,其抑制作用对晚期集落形成无明显抑制作用。Ara-C 直接作用组在7 d、14 d 和21 d 均未见集落形成,说明单次用药Ara-C 对肿瘤干细胞抑制作用不明显,而加大浓度及作用时间会增加对肿瘤干细胞的杀伤作用,而GEM 无论单次用药还是持续用药,对抑制KG1a 细胞增殖作用均优于同浓度Ara-C 组。
本研究发现,0. 1 mg/L GEM 作用24 h 后对KG1a 细胞无诱导凋亡效应。而GEM 在大于0. 5 mg/L 浓度下具有早、晚期凋亡作用,诱导凋亡作用优于同浓度Ara-C 组。本实验表明GEM 增殖抑制作用强于阿糖胞苷,可能是因为其有更好的胞浆穿透性,并通过将CD34+CD38-的KG1a 细胞阻滞在G1/G0期来发挥作用。
[1] 黎建军,古模发,刘立志,等.CIK 细胞回输联合吉西他滨和顺铂治疗鼻咽癌放疗后肝肺转移瘤的效果及机制研究[J].中国病理生理杂志,2011,27(2):272-277.
[2] Davies AM,Ruel C,Lara PN,et al. The proteasome inhibitor bortezomib in combination with gemcitabine and carboplatin in advanced non-small cell lung cancer:a California Cancer Consortium Phase Ⅰstudy[J]. J Thorac Oncol,2008,3(1):68-74.
[3] Peters GJ,van der Wilt CL,van Moorsel CJ,et al.Basis for effective combination cancer chemotherapy with antimetabolites[J].Pharmacol Ther,2000,87(2-3):227-253.
[4] Nieto Y,Thall P,Valdez B,et al. High-dose infusional gemcitabine combined with busulfan and melphalan with autologous stem-cell transplantation in patients with refractory lymphoid malignancies[J].Biol Blood Marrow Transplant,2012,18(11):1677-1686.
[5] She M,Niu X,Chen X,et al. Resistance of leukemic stem-like cells in AML cell line KG1a to natural killer cell-mediated cytotoxicity[J]. Cancer Lett,2012,318(2):173-179.
[6] 徐霜清,祝爱珍,刘成成,等.盐霉素抑制耐格列卫的人慢性粒细胞白血病细胞株K562/Glv 增殖并诱导其凋亡[J].中国病理生理杂志,2012,28(7):1208-1212.
[7] 郭坤元,姚开泰.以肿瘤干细胞为靶的免疫治疗[J].中国肿瘤生物治疗杂志,2012,19(3):343-347.
[8] Giovannetti E,Mey V,Loni L,et al. Cytotoxic activity of gemcitabine and correlation with expression profile of drugrelated genes in human lymphoid cells[J]. Pharmacol Res,2007,55(4):343-349.

